Artigos de investigación opcionais de docencia
Avaliación de tres substratos empregados na inmunofluorescencia indirecta Proba de medición antimitocondrial antimitocondrial para o diagnóstico da cirrosis biliar primaria
Poma Huanca, Patricia1 Sosa Tordya, Luis Fernando1
Correspondencia: Patricia Poma
Av. Saavedra 2224 (Edificio Seladis, piso 4). Teléfono: 2612445 en [email protected]
1 Instituto de Servizo de Laboratorios de Diagnóstico e Investigación en Saúde (SELADIS) -FCFB-UMSA
Resumo
Primaria A cirrosis biliar (CBP) é unha enfermidade hepática inflamatoria crónica de etioloxía descoñecida caracterizada pola destrución de dutos de bilis intrahepáticos que desencadea unha cirrosis fígado. No presente estudo, avaliáronse tres substratos comúnmente usados para detectar antimitocondriais (AMA) por inmunofluorescencia indirecta (IFI) para o diagnóstico de CBP. Os substratos avaliados foron: Cut (renuncia do rato), células HEP-2 (células epiteliales derivadas do carcinoma laríngeal humano) e as células BHK-21 (Fibroblastos de riles de Hamster de Siria) que se comparaban cos resultados da proba de confirmación comercial Medidas anti-mitocondrial M2 anti-antigens (Elisa, Trinity Biotech).
25 SERA foron seleccionados con resultados positivos para Elisa (Índice > 1,10ui / ml ). Os controis negativos foron SERA de pacientes que non tiñan unha historia de enfermidade hepática e presentaron resultados negativos para AMA (Índice DIG ID = “F7A626D265”> a 0.90 UI / ml).
Dos tres substratos avaliados, a liña celular BHK-21 baseada en utilidade limitada, con valores de 56% de eficiencia, 48% de sensibilidade, especificidade do 64% e unha taxa de concordancia de KAPPA de 0,12 (baixo) con respecto aos resultados do estándar de proba de ouro (ELISA-AMA). Para o substrato HEP-2, atopouse unha concordancia moderada (kappa = 0.6) contra o ouro estándar, obtivo unha especificidade = 100%, sensibilidade = 60% e 80% de eficiencia Os cortes renales histolóxicos mostraron unha sensibilidade, especificidade e eficiencia do 92%; Tamén mostraron resultados con maior conformidade co método ELISA (kappa = 0.84). Dos tres métodos de inmunofluorescencia avaliados, determinouse que o que usa os cortes renales histolóxicos é o máis eficiente e, polo tanto, podería ser unha ferramenta útil como un método de tamiz no diagnóstico de CBP.
Palabras clave
Cirrosis biliar primaria (CBP), antimitocondriais (AMA), inmunofluorescencia indirecta (IFI).
Resumo
Cirrosis biliar primaria (PBC) é un inflamatorio crónico A enfermidade hepática da etioloxía descoñecida caracterizada pola destrución dos dutos da bilis intrahepática que desencadea a cirrosis do fígado. No presente estudo avaliamos tres substratos comúnmente usados para anticorpos mitocondriais (AMA) por inmunofluorescencia indirecta (IIF) para o diagnóstico de PBC. Os substratos foron avaliados: as células histolóxicas (renunias do rato), as células hep-2 (células epiteliales derivadas do carcinoma humanularismo) e BHK-21 (hamster ril fibroblastos dourados sirios) que foron compartidos cos resultados da proba confirmatoria (Enzima Immunassay) Antigens comerciais Medido M2 MITOCONDRIAL anticorpos (Elisa, Trinity Biotech).
Seleccionamos 25 seres positivos para AMA por ELISA (Índice > 1.10 IU / ML). Os controis negativos seran foron de patantes que non tiñan historia de enfermidade hepática e tiveron resultados negativos para AMA (Índice < 0.90 IU / ml).
dos tres substratos Probado, a base da liña celular BHK -21 mostrouse que ten unha utilidade limitada, valores de eficiencia do 56%, a sensibilidade do 48%, a especificidade do 64% eo índice de concordancia de KAPPA de 0,12 (baixo) Meade sobre os resultados do ouro estándar Proba (Elisa -ama). Para HEP-2 foi un acordo moderado (KAPPA = 0.6) fronte ao estándar de ouro, obtivemos o 100% da especificidade, a sensibilidade = 60% eo 80% da eficiencia. Os renales do rato histolóxico mostraron unha sensibilidade, especificidade e eficiencia do 92%, os resultados tamén mostraron un mellor acordo co método ELISA (kappa = 0.84). Dos tres métodos de inmunofluorescencia avaliados, determinouse que o renal de rato histolóxico é o substrato máis eficiente e, polo tanto, podería ser útil como unha proba de selección para diagnosticar a CBP.
PALABLES CLAVE
Primaria Cirrose biliar (PBC), anticorpos anti-mitocondriais (AMA), inmunofluorescencia indirecta (IIF).
Introdución
O CBP, así como Ahrensy Payne en 1950, é unha enfermidade hepática progresivamente crónica, caracterizada pola inflamación e destrución de dutos de biliar interlobular e septal mediated t linfocitos que culman a un Insuficiencia hepática. Suponse que é unha enfermidade autoinmune porque é comúnmente asociada a acidosis tubulares renales, vitiligo, tiroidite de hashimoto, síndrome de sjôgren, fenómeno de Raynaud, síndrome de crista, artrite reumatoide, lupus sistémico e deficiencia na función de linfocito T supresores (Zumueta & Navarrete, 2008).
As súas principais manifestacións clínicas son a fatiga, o prurito, a ictericia, a presenza de xantomés, xantelasmas e consecuencias da absorción intestinal, como unha deficiencia de vitaminas e osteoporose (CBP1). O CBP afecta a mulleres máis entre 30 e 60 anos de idade, a relación de implicación do home feminino é de 9 a 1. Ademais, determinouse que hai asociación xenética con HLA-DR8. (Idrovo, 2007).
Un marcador serolóxico característico da enfermidade é a presenza de AMA, o obxectivo antigénico sendo a proteína M2 da membrana interna da mitocondria (compoñente E2 do piruvato deshidroxenase), outros As proteínas antigénicas mitocondriais como M4, M8 e M9 están implicadas en menos proporción. Os métodos AMA están presentes no 90% dos pacientes con CBP, e en 30% dos casos, pode ser acompañada por un patrón de fluorescencia citoplasmática e / ou defecto periférico na proba de anticorpos antinucleares. (Bruguera & Ichiyanagui, 2008). El ama a eles nunha menor frecuencia, tamén se pode atopar en enfermidades hepáticas inducidas por drogas, sífilis, tuberculose e outras enfermidades autoinmunes hepáticas. (O’Brien, Xordania, Guindi, Hans & Dienes, 2009).
O diagnóstico serolóxico de CBP está baseado en IFI e ELISA. O IFI usa como substrato de cortes histolóxicos de fígado, estómago ou rato ou rata e a liña celular HEP-2. As probas de Elisa usan como un sustrato de antíxeno do complexo de deshidroxenase de piruvato obtido a partir de corazón bovino ou porcino (Dahnrich, pares, llorenq Cavalry, Wolfgang & Probst, 2009).
Unha característica de vantaxe da proba IFI é que permite avaliar ao mesmo tempo varios tipos de proteínas antigénicas no mesmo substrato (exemplos: SP100, GP210, LB2, LKM1, LC1, SLA, M1 – M9) Que o fai a Proba moi sensible, por outra banda, a proba de ELISA usa antíxenos purificados para un único marcador de laboratorio que lle dá unha característica maior. Na proba de ELISA, unha mostra que contén anticorpos de alta afinidade en baixa concentración pode presentar a mesma densidade óptica que unha mostra con anticorpos de baixa afinidade, pero con alta concentración non proporciona información cuantitativa como coa técnica IFI, onde é posible determinar por unha serie de dilución o título máximo de anticorpos presente na mostra dun determinado paciente (Cortés & Malera, 2009).
entre 2008 e 2009, no Histocompatibilidad e laboratorio inmunogenético do Instituto Seladis, observouse que había 162 solicitudes de determinación de AMA a partir de 162, 49 deron reactivos para AMA. Para facer un bo diagnóstico e seguimento deste tipo de enfermidades, métodos de diagnóstico comercial ou optimizado e de alta sensibilidade e especificidade de diagnóstico son necesarios. O coñecemento destes aspectos causa a garantía na que o diagnóstico de laboratorio por un determinado método é eficiente e fiable. Antes mencionado, avalíanse tres substratos no traballo actual (Cortes renales de rato histolóxico, liñas HEP-2 Cells e BHK-21 Celular da proba IFI para o diagnóstico de CBP que Mide adora para determinar cal substrato é o máis sensible , específico, eficiente e que ten un mellor acordo coa proba de ELISA que ama MIDE.
Materiais e métodos
Poboación en estudo
As mostras utilizadas neste estudo veu de pacientes que asistiron ao Instituto Seladis durante abril de 2008 a maio de 2009. As mostras de Panel SERA positivo procederon de pacientes con diagnóstico clínico de CBP con seroloxía negativa para a hepatite viral e deron resultados de ELISA (Trinity Biotech) para o positivo AMA (Índice de mostra > 1,10 ui / ml). As mostras do panel SERA NEGATIVO foron seras de pacientes aparentemente saudables sen unha historia de enfermidade hepática (resultados de transaminasa, fosfatase alcalina e bilirrubina normal, seroloxía para o virus negativo de hepatite e os resultados de Elisa para a amante negativa (índice < 0,90 ui / ml).Cada un dos paneis de soro estivo constituído por 25 mostras. Todos os pacientes que usaron a SERA para construír os paneis SERA POSIBLE e negativo deron o seu consentimento para facer a súa mostra utilizada no presente estudo.
Análise de datos
Todos os datos do presente Estudo realizáronse coa axuda da base de datos Excel 2007, utilizáronse os indicadores estatísticos para validacións como o índice de KAPPA e a Mac Nemar Test (López de Ullibarri & Cura, 2008) .
Preparación de impresións
imprints co substrato de célula BHK-21
Todo este procedemento realizouse en fluxo de capota laminar (Gelaire) e traballou con novos e material estéril.
A Alícano de células almacenadas en nitróxeno líquido e foi transferida a un tubo de falcón de 15 ml e engadiuse 3 ml de RPMI 1640 que estaba centrifugado en 2500 rpm por 5 min, esta vez foi eliminado polo sobrenadante e a pellet foi resuspiada a 1 ml de RPMI 1640 s A punta (10% de bobino de leite fetal (SFB) complementado, antibióticos (gentamicina e estreptomicina), despois transferíase a unha caixa de cultura celular de 25 cm2 e incubada durante unha semana a 37 ° C, 5% C02 e 90% relativo de humidade.
Unha vez que a placa estaba en confluencia, estaba pechada por 10 min a 37 ° C para todas as células, as células adheridas na base da caixa de cultivo, as células que se despegan 15 ml de tubo de falcón foron colocados e centrífuos en 1500 rpm durante 5 min. O sobrenadante foi eliminado, a pellet foi resuspiada en 1 ml de RPMI1640 complementada e a concentración celular foi axustada en 2.5×106 células / ml. En 12 las diapositivas (MP biomédicos, EE. UU.), Pinturas preparáronse colocando 8 UL das células axustadas a cada ben. As pegadas foron centrifugadas a 1000 rpm por 3 minutos e as pegadas foron envoltas con paraphilm (3M), para que a conservación deles fose levada a 4 ° C durante 30 minutos e despois preserváronse a -20 ° C ata uso.
Impresións cos recortes dos riles do rato do rato histórico de sustrato
Os riles de 25 ratos (albinos suízos) de 28 semanas foron extraídos con peso medio de 20 g +/- 2 g, que foron doados polo bioterio da facultade de ciencias farmacéuticas e bioquímicos. Os riles foron lavados con buffer salino de fosfatos (PBS) constituído de fosfato de sodio 112,5 mmol / l, 30 mmol / l fosfato de potasio, cloruro de sodio 1.15 mol / l, azida de sodio 0.95 g / l pH 7,5 A continuación, os riles foron colocados nun prato petri que contén carboximetilílico de sodio (Sigma Aldrich) e estaba a conxelación a -20 ° C ata o momento de uso. Para realizar os cortes de cristal, os tacos estaban preparados cos riles embalados nun 4% carboximetil de carboyulosa de sodio. Os cortes realizáronse para conxelar usando un cristal (LECA) a -27 ° C, colocáronse catro cortes renales para cada folla de diapositiva. Os cortes feitos tiñan diámetro medio de 5 mm e 5 um espesor.
Preparación do conxugado fluorescente
para determinar o título óptimo do conxugado fluorescente (Anti-Gammaglobulin IGG e IGM marcados con tioiscianate de fluoresceína) dilucións (1/100, 1/150, 1/200 e 1/300) preparáronse con dil | u.ye do conxugado (50 ul de evans azul 0,4% en 3,5 ml de PBS).
A titulación do conxugado fluorescente para o “IFI que usa como cortes histolóxicos de substrato de renales de renunio e liña BHK-21.
Para a titulación do conxugado fluorescente usouse positivo e negativo controis por amor da casa comercial organteteca, Alemaña.
As impresións con ACETONE PA (-20 ° C) foron fixadas por 8 min, hidratadas por 10 minutos nun jar de Koplin que contén PBS (10x) PH 7.2 . Dilucións (1/10,1 / 20 e 1/40) do control positivo e negativo foron realizadas. Entón, 40 ul de dilucións de SERA foron sementadas , 30 min foi incubado a temperatura ambiente (T ° A) e nunha cámara húmida para evitar o secado de cortes ou células histolóxicas fixas. As impresións foron lavadas por 10 minutos en PBS e axitación continua. As pegadas foron secas con papel absorbente e foron colocadas de novo nunha cámara mollada. 25 ul foi colocado de dilucións para ser avaliadas do conxugado fluorescente (1/100.1 / 150, 1/200 e 1/300). Foi incubado na escuridade por 30 minutos en ° a. Despois deste tempo, realizouse o proceso de lavado e secado descrito anteriormente. A solución de montaxe (12% mowiol, glicerol, 30% glicerol, tris 20 mmol / l, 0,95 g / l azida de sodio) engadiuse e colocouse unha cobertura en cada diapositiva para evitar o secado das impresións. Finalmente, as placas de microscopio UV con aumento de 40x foron lidas.
Inmunofluorescencia indirecta (IFI)
A proba IFI con celas HEP-2, realizouse de acordo coas instrucións do fabricante do kit Comercial (o sitio de unión, Reino Unido).Brevemente: 1/40 e 80 e 1/160 dilucións foron realizadas dos paneis SERA e control de SERA.
30 minutos foron incubados a T ° A. As placas correspondentes foron lavadas por 10 minutos e secas, conxugadas e incubadas na escuridade durante 30 minutos, entón as impresións foron lavadas e secadas de novo e colocáronse os medios de montaxe. As placas de microscopio UV con aumento de 40x.
Para a realización de probas IFI con células BHK-21 e os recortes histolóxicos foron seguidos o protocolo descrito na titulación conxugada, coa excepción que se utilizou o título óptimo do conxugado para cada substrato. Con todos os substratos avaliados, usouse simultaneamente un control positivo e negativo (orgentec). O control positivo de AMA debe producir un patrón citoplasmático de cor de mazá verde con intensidade (++) a partir de 1/40 dilución. O control negativo non debe emitir fluorescencia a 1/10 dilución en células renais ou 1/40 en liñas celulares. (Sitio de unión, 2011).
Para a interpretación dos resultados da proba IFI, consideráronse mostras negativas cando había ausencia de fluorescencia de mazá verde en citoplasma. Unha mostra foi considerada positiva se a cor do citoplasma era maior que o control negativo. (Fig. 1).
Para o propósito do estudo, o kit de Elisa que mide anticoras contra a marca M2 mitocondrial Trinity Biotech Antigen foi considerada como un estándar de ouro, que informa dunha sensibilidade 91% e especificidade de 100% (Jones & Metcalf, 2008).
Resultados
Ao facer a análise previa dos pacientes que asistiron ao servizo de laboratorio determináronse que de todas as probas solicitadas para a detección de enfermidades autoinmunes durante dous acordos (2008 e 2009) a determinación de AMA (ELISA) foi solicitada polo 7% dos casos, con 69 solicitudes sendo 2008 e 93 en 2009, tendo un total de 162 Casos presuntivos de cirrose biliar primaria nos dous acordos. Das 162 mostras 49 foron feitas como reactivas para AMA. Observouse que a maioría dos pacientes diagnosticados como reactivos de amor eran mulleres (80%). SERA de 20 mulleres e 5 homes foron contemplados no Panel Sera Positivo. A Idade Media dos Pacientes cuxas mostras foron incluídas no presente estudo foi de 46 anos, con valores extremos de 22 e 77 anos.
Dilutions foron realizadas: 1/10, 1/120 e 1/40 de controis positivos e negativos. Avaliouse o título ideal ao que se puido usar o conxugado. As dilucións foron avaliadas 1/100, 1/150, 1/200 e 1/300. Este experimento foi feito en triplicado e, como resultado, observouse que se obtivo a 1/150 dilución, verdadeira positiva (VP) e os verdadeiros resultados negativos (VN) do control comercial SERA,
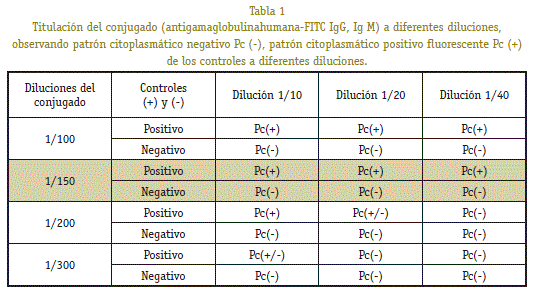
Avaliación dos resultados da proba de diagnóstico nos tres substratos avaliados
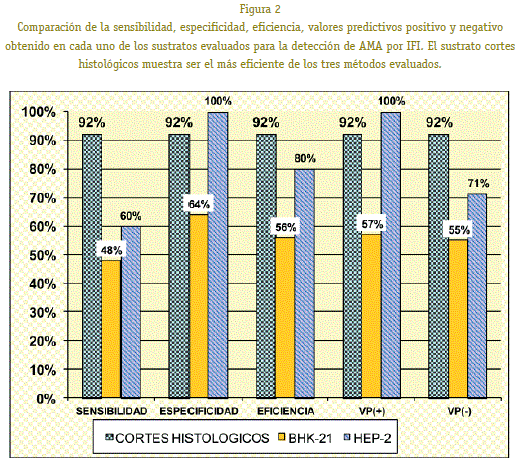
Ao avaliar a sensibilidade, a especificidade, os valores predictivos positivos e negativos ea eficiencia dos tres substratos avaliados, obsérvase que a liña celular BHK-21 é o substrato menos eficiente, mostrouse o substrato celular HEP-2 Menos especificidade, menor sensibilidade e, polo tanto, menos eficiencia que os recortes histolóxicos do substrato. Os resultados amosan claramente que os recortes histolóxicos do substrato son o método máis eficiente para o diagnóstico por IFI para CBP.
Determinación de Concordancias de diferentes substratos empregados para os resultados frontales de AMA IFI atopados por ELISA
As probas de concordancia utilizadas foron: KAPPA Índice e MC Test Nemar para dúas probas relacionadas (combinadas). Os resultados das diferentes probas de concordancia (P < 0,05) para os diferentes substratos fronte ao método ELISA que mide antíxenos antígenos anti-mitocondriais M2 (estándar de ouro). O valor crítico esperado na proba MC NEMAR foi de 3,84 (P < 0,05).
Cortes histolóxicos mostraron un índice de Kappa de 0, 84 que segundo a escala Do índice corresponde a unha moi boa concordancia cos resultados obtidos polo método ELISA. A proba de MC Nemar presentou un resultado de 0,25.
O lineo celular presentou un índice de kappa de 0,12 (concordancia deficiente) cos resultados obtidos polo método ELISA. A proba de ducha de MC Nemar mostrou un valor de 1.13.
A liña celular HEP-2 presentou un índice de KAPPA de 0,6 (moderado concordancia) fronte aos resultados obtidos polo método ELISA. O valor de MC NEMAR foi de 12.1.
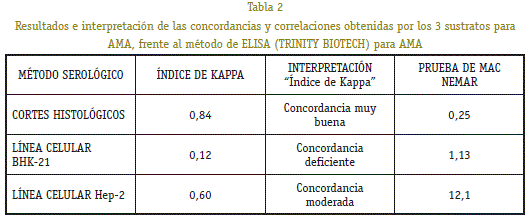
porque os recortes histolóxicos mostraron que é o método IFI máis eficiente para o diagnóstico de CBP Por IFI, os resultados foron comparados cun método comercial IFI para AMA.O índice Kappa atopou foi 0,66 (moi boa concordancia). A proba MC Nemar presentou un valor de 1.33.
Discusión
Ao analizar casos positivos para CBP no noso laboratorio, determinamos que o 80% dos casos afecta ás mulleres, sendo a relación das mulleres / Man 4: 1 Estes descubrimentos son similares aos relativos por: Abarca, Peña Herrera & Garces (2006) onde determinan a etioloxía, a supervivencia, as complicacións e a mortalidade na cirrosis hepática en Ecuador Evidenciar unha proporción de muller / home de 2,4: 1; Tamén Cedeño & Medina (2008) determina que o 90% das mulleres están afectadas por esta enfermidade. Das 25 mostras positivas que se empregaron neste estudo 20 veu das mulleres. Valera, Smok & Poniachik (2007) No estudo realizado no Hospital Clínico da Universidade de Chile e na Clínica Las Condes de Chile en 115 pacientes, mostrou que 110 eran mulleres O que equivalía ao 96% ao atopar unha relación de participación de muller / home de 9: 1, sábese que os factores hormonais son un dos factores que predispón ás enfermidades autoinmunes. (Rojas, 2007, p.324).
No presente estudo determinamos que a idade á que se presentan os casos CBP é de 45 anos. Os datos similares foron relativos por Dávalal, Román & BUSTOS (2007) nun estudo da hepatite autoinmune na que incluíron a CBP máis as súas formas clínicas e factores relacionados coa resposta ao tratamento que mostra o rango de idades de afectación de 48 a 59 anos, unha posible explicación a este fenómeno é que nesta époque o timo perdeu en gran medida a súa capacidade de destruír os linfocitos de auto-reactorio por selección negativa, que é un factor predisponer á enfermidade autoinmune.
Fai un bo diagnóstico clínico e laboratorio para este e outro tipo de enfermidades autoinmunes é vital, principalmente debido ao carácter invalidador do paciente ou o feito de que poidan poñer en risco a vida do paciente noutros casos. Neste último aspecto Jones & Metcalf (2008) determinou que os pacientes con CBP na enfermidade III / IVDE teñen unha maior mortalidade (43,6%) que a poboación normal. Polo tanto, no caso dun diagnóstico de laboratorio de CBP, debe estar dispoñible unha proba de maior eficiencia. Na nosa experiencia observamos que o uso de substratos se, as liñas celulares (BHK-21, HEP-2) ou os recortes de cristal de tecidos (fígado ou renal de renunio) poden ser evidenciados a nivel citoplasma celular que está directamente relacionado con enfermidades hepáticas tipo inmunolóxico, infeccións virales ou outro autoinmune extra que teño naturezas, etc. (Almeida et al., 2008).
dos tres substratos avaliados determinamos que os que se basean nas liñas celulares teñen unha utilidade limitada, especialmente aqueles que utilizan a liña celular BHK-21 que teñen unha eficiencia do 56% , Sensibilidade do 48% e especificidade do 64%. Aínda que este substrato considérase bo determinar anticorpos antinucleares. (Sosa & Sánchez, 2007) non é para o diagnóstico de CBP xa que ten unha baixa concordancia coa proba de ouro estándar avaliada (Elisa-ama). Non hai informes sobre a bibliografía sobre a presenza ou a ausencia destes antíxenos mitocondriais na liña celular BHK-21.
Un descubrimento interesante foi descubrir que coa liña celular HEP-2 a pesar de ter unha concordancia moderada (Segundo o índice de KAPPA) contra a proba de ELISA, mostrou que ten unha especificidade do 100%, vale a pena que se este substrato fose usado, non se observou ningunha fluorescencia no nivel do citoplasma celular, podería dicirse que o paciente non está presente A enfermidade pero aínda así, é necesario usar unha proba máis eficiente para confirmar a mencionada. En canto á sensibilidade deste substrato, non se observa ningunha diferenza significativa con células BHK-21.
Os cortes criotáticos dos renales do rato demostraron ser os máis eficientes con 92% de sensibilidade e especificidade do 92% respectivamente. Tamén mostraron resultados máis amplos co método ELISA-AMA (KAPPA 0.84). En xeral, sábese que a sensibilidade e especificidade dos métodos IFI para AMA son do 95% (Valera, Smok & Ponia-Chik, 2007). Estes resultados móstranos que o método IFI optimizado na histocompatibilidad e o laboratorio inmunogenético do Instituto Seladis é tan bo como métodos similares ofrecidos por diferentes casas comerciais.Aínda que hai diferenzas a nivel de sensibilidade e a especificidade co método ELISA (método definitivo para diagnosticar CBP), o único ou quizais a vantaxe máis importante do método IFI versus o método ELISA é que non só se limita a detectar o O antíxeno Mitocondrial M-2, pero pode dar resultados positivos contra os antíxenos M1 a M9. Orientando ao médico deste xeito ao diagnóstico de enfermidades hepáticas autoinmunes, tipo I, II, III ou outro autoinmune non fígado e mesmo casos de infeccións virales. (Meléndez & DUJARRIC, 2008). Outra vantaxe non é menos importante é que o método optimizado fai a proba aos pacientes máis accesibles porque o custo do reactivo por proba é BS. 13 contra BS. 45 do kit de inmunofluorescencia e BS. 31.50 do kit de Elisa O método optimizado tamén mostra desvantaxes, o primeiro é o consumo de tempo (sacrificar o rato, a extracción e a conservación dos RI-ÑONES, as dilucións en serie de mostras de control, os lavados, a lectura no microscopio de fluorescencia). Para a experiencia propia, atopamos que se investiu unha hora a unha hora e media de procesar as mostras por IFI que por Elisa. Tamén é importante resaltar que os profesionais son necesarios para facer a lectura e interpretación dos patróns fluorescentes. Outro descubrimento importante atopado foi que os diferentes patróns citoplasmáticos fluorescentes poderían ser evidenciados nun certo substrato. Cos resultados obtidos a partir deste estudo, era posible determinar que dos tres substratos avaliados, os recortes renales do rato histolóxico son o substrato máis eficiente e é o substrato que ten a mellor concordancia cos resultados da proba de ELISA para o diagnóstico de CBP. Doutra banda, determinouse que hai unha moi boa concordancia cos resultados IFI dun kit comercial de características similares. A proba de diagnóstico utilizada permitiunos validar a proba IFI que usa cortes histolóxicos como unha pantalla de proba para o diagnóstico de CBP.
Referencias
Eduardo, Z., Villena, J., Navarrete, S., & Figueroa. (2008). Relación clínica clínica clínica e patolóxica da bilis primaria. Enfermidades do aparello dixestivo 1 (4), 5-8. Repita de http://www.cfnavarra.es/salud/anales/textos/vol26/n3/revis2a.html
Bruguera, M. (2009). Diagnóstico e tratamento. Enfermidades de dutos distantes de bilis intrahepáticos no adulto: Cholangite e Ductopenia.Med Clin (Barcelona), 1 07,338 341. Recuperado de http://www.donostiaospitalea.orgcats/cats61.htm
IDROOVO, C. ( 2007). Cirrosis biliar primaria. Tratamento. Bogotá. Fundación Santa Fe Madrid: Elsevier
Ichiyanagui, c., & Rodríguez ,. (2008). Enfermidades colestáticas hepáticas. Departamento de Enfermidades do Dispositivo Digestivo. 1 (4). Recuperado de http://www.cfnavarra.es/salud/anales/textos/vol26/n3/revis2a.html.
Brien, C., Jordan, J., Maha, G., Hans, Q., Dienes, J., & Heathcot, L. (2009 ) Seguimento a longo prazo de anticatómitos anticatómitos anticatómicos anticatómicos anticatólogos positivos de anticatoloxía 48 (2), 550-556. Recuperado de
Dahnrich, c., Pares, a., Blorenc, c., Rosemann, A., Wolfgang, S., & Vergani, D. (2009). Detectar antimitodriales específicos antiitoconómicos específicos de cirroshondrial. Química Clinical Stocker, 55: 5,978-985, recuperada de http://www.biomedexperts.com/Profile.bme/1655595/dimitrios_bogdanos
Cortés, L., & Manchera, L. (2008). Concordancia entre Elisa e IFI para a determinación de anticorpos tipo IGG contra Gondii Toxoplasma. Asociación de inflexoloxía colombiana. Recuperado de http://www.aeped.es/protocolos/infectologia/index.htm
Ullibarri, L. (2008). Medidas de concordancia: o índice Kappa do deseño e análise de experimentos clínicos Galpararso 6.169-171. Recuperado de http://www.fisterra.com/mbe/investiga/kappa/kappa2.pdf
Cure, E. (2004). Manual de procedementos de control de calidade para os laboratorios de seroloxía dos bancos de sangue. Washingtog, D.C: Organización de Saúde Panamericana.
sitio de unión. HEP-2 ANA / SUBSTRATE DIRECTOS. Inserir do kit comercial.
Trinity Biotech. Captación de mitocondria inserción do kit comercial. Jones, D., & METCAL. (2008). Prognóstico pronóstico da cirrosis biliar primaria. Hepatologi 26.1138-1142. Recuperado de http://www.donostiaospitalea.org//cats/cats61.htm
ABARCA, J., Peñaherrera, V., & Garces, c. (2006) .. Etioloxía, supervivencia, complicacións e mortalidade en cirrosis hepática en Ecuador. Avaliación retrospectiva de 15 anos en América Latina 1,29-34.
CEDEÑO, L., & Medina, J. (2008). Cirrose biliar primaria. Medisano. Recuperado de http://74.125.47.132/search?q=cache:xSGNf_1n07MJ:bvs.sld.cu/revistas/san/vol11_307/san12307.htm Cirrosis biliar primaria en mulleres.
Valera, J.M., SMOK G., & PONYOCHIK, G. (2008). Cirrose biliar primaria: trece anos de experiencia en dous centros de referencia.Rev Méd Chile 4,469-474. Recuperado de http://www.scielo.cl/scielo.php?pid=S003498872006000400010&script=sci_arttext
Red, W. (2004). Inmunoloxía. 13Aed. Medellin Colombia.Corporation para investigacións biolóxicas P 324.
Dávalo, M., Román, R., & BUSTIOS, C. (2008). Hepatitis autoinmune: formas clínicas e factores relacionados coa resposta ao tratamento. Gastroenterrol. 24: 305-313. Recuperado de http://www.cfnavarra.es/salud/anales/textos/vol26/n3/revis2a.html.
Almeida, J. (2002). Anticorpos antiribosomales como marcadores de actividade en Les. Anales de Medicina Interna. Madrid.
porcel, J. (2007). Probas de laboratorio para o estudo das enfermidades sistémicas autoinmunes. Clínica-Urr.org, recuperado de http://www.clinica-unr.org/Especiales/20/Especiales%20Laboratorio_Porcel.pdf
Harrison (2007). Criterios de diagnóstico de hepatite autoinmune. Manual de. Terapéutica médica.
SOSA, L.F., & Sánchez, L. (2004). Validación de métodos serolóxicos que se usan para o diagnóstico de enfermidades reumáticas definidas: Lupus eritudosus sistémico (Les). Biofarbo. 12, 15-19.
Meléndez, M., & Dujarric, M. (2008). Avaliación da inmuno-histoquímica para o diagnóstico de diseases.rev autoinmune cubana Invest BioMed 23 (3): 133-8 Recuperado de http://bvs.sld.cu/revistas/ibi/vol23_3_04/ibi01304.pdf.