predarea obiectelor de cercetare opționale
Evaluarea a trei substraturi utilizate în imunofluorescența indirectă Testarea anticorpilor antimitocondriali de măsurare pentru diagnosticarea cirozei biliari primare
poma Huanca, Patricia1 Sosa Tordya, Luis Fernando1
Corespondență: Patricia Poma
AV. Saavedra 2224 (clădirea Sladis, etajul 4). Telefon: 2612445
[email protected]
1 Institutul de Servicii de laboratoare de diagnosticare și cercetare în sănătate (Seadis) -FCFB-Umsa
Rezumat
Primar Ciroza biliară (CBP) este o boală hepatică inflamatorie cronică a etiologiei necunoscute caracterizată prin distrugerea conductelor biliare intrahepatice care declanșează o ciroză hepatică. În studiul de față, au fost evaluate trei substraturi utilizate în mod obișnuit pentru a detecta anticorpi antimitocondriali (AMA) prin imunofluorescența indirectă (IFI) pentru diagnosticul CBP. Substraturile evaluate au fost: tăiate histologice (rinichi de șoarece), celule HEP-2 (celule epiteliale derivate din carcinomul laringian uman) și celulele BHK-21 (fibroblastele de rinichi de aur de la Siria), care au fost comparate cu rezultatele testului de confirmare comercială Măsuri anti-anti-anti-anti-anti-anti-mitocondriale (ELISA, Trinity Biotech).
25 SERA au fost selectate cu rezultate pozitive pentru ELISA (indexul > 1,10UI / ml ). Controalele negative au fost seruri ale pacienților care nu au avut o istorie de boală hepatică și au prezentat rezultate negative pentru AMA (index < la 0,90 UI / ml).
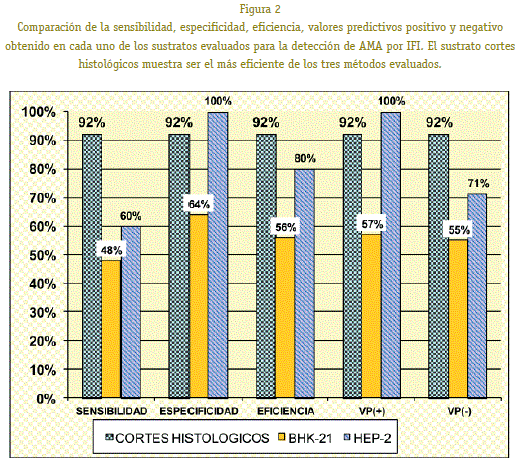
Dintre cele trei substraturi evaluate, linia celulară BHK-21 bazată pe utilitate limitată, cu valori de eficiență de 56%, sensibilitate de 48%, specificitate de 64% și o rată de concordanță KAPPA de 0,12 (scăzut) în ceea ce privește rezultatele standardului de testare a aurului (ELISA-AMA). Pentru substratul HEP-2, a fost găsit o concordanță moderată (kappa = 0,6) față de aurul standard, s-a obținut o specificitate = 100%, sensibilitate = 60% și o eficiență de 80% tăieturile de rinichi histologice au arătat o sensibilitate, specificitate și eficiență de 92%; De asemenea, au arătat rezultate cu o mai mare conformă cu metoda ELISA (Kappa = 0,84). Dintre cele trei metode de imunofluorescență evaluate, sa stabilit că cea care utilizează tăieturi de rinichi histologice este cea mai eficientă și, prin urmare, ar putea fi un instrument util ca metodă de sită în diagnosticul CBP.
Cuvinte cheie
Ciroză primară biliară (CBP), anticorpi antimitocondriali (AMA), imunofluorescența indirectă (IFI).
Rezumat
Ciroză primară biliară (PBC) este un inflamator cronic Boala hepatică a etiologiei necunoscute caracterizată prin distrugerea conductelor biliare intrahepatice care declanșează ciroză hepatică. În studiul de față am evaluat trei substrate utilizate în mod obișnuit pentru anticorpi mitocondriali (AMA) prin imunofluorescența indirectă (IIF) pentru diagnosticul PBC. Substraturile au fost evaluate: celule histologice (rinichi de șoarece), celule HEP-2 (celule epiteliale derivate din carcinomul hanalalingungual) și BHK-21 (Hamster Rinichi Fibroblaste de aur Sirian), care au fost împărțite cu rezultatele testului de confirmare (imunitatea enzimelor), antigene comerciale Măsurați anticorpi mitocondriali M2 (ELISA, Trinity Biotech).
Am selectat 25 de seruri pozitive pentru AMA de către ELISA (index > 1,10 UI / ml). Controalele negative Sera au fost de la patitoare care nu aveau istorie de boală hepatică și au avut rezultate negative pentru AMA (indicele < 0,90 UI / ml).
al celor trei substraturi Testați, pe baza liniei celulare BHK -21 s-au dovedit a avea o utilitate limitată, valori de eficiență de 56%, sensibilitate 48%, specificitate de 64% și indicele de concordanță Kappa de 0,12 (scăzut) Meade pe rezultatele aurului standard Testul (ELISA -AMA). Pentru HEP-2 a fost un acord moderat (kappa = 0,6) față de standardul de aur, am obținut 100% din specificitate, sensibilitate = 60% și 80% din eficiență. Rinichiul histologic al mouse-ului a arătat o sensibilitate, o specificitate și o eficiență de 92%, rezultatele au arătat, de asemenea, un acord mai bun cu metoda ELISA (Kappa = 0,84). Din cele trei metode de imunofluorescență au fost evaluate, s-a determinat că rinichiul histologic al mouse-ului este cel mai eficient substrat și, prin urmare, ar putea fi util ca un test de screening pentru diagnosticarea CBP.
Cuvinte cheie
primar Ciroză biliară (PBC), anticorpi anti-mitocondriali (AMA), imunofluorescență indirectă (IIF).
Introducere
CBP, precum și Ahrensy Payne în 1950, este o boală hepatică cronică progresiv, caracterizată prin inflamarea și distrugerea conductelor biliare interlobulare și septice mediate limfocitele T care culminează într-o insuficiență hepatică. Se presupune că este o boală autoimună deoarece este asociată în mod obișnuit cu acidoza tubulară renală, vitiligo, hashimoto tiroidită, sindromul Sjôgren, fenomenul Raynaud, sindromul crest, artrita reumatoidă, lupusul și deficit de lupus sistemic în funcția limfocitelor (Zumueta & Navarrete, 2008).
Principalele sale manifestări clinice sunt oboseala, pruritul, icterul, prezența xanterilor, xantelasme și consecințe ale absorbției intestinului, cum ar fi o deficiență de vitamine și osteoporoză (CBP1). CBP afectează femeile mai mult între 30 și 60 de ani, relația de implicare a omului feminin este de la 9 la 1. De asemenea, sa stabilit că există o asociere genetică cu HLA-DR8. (Idrovo, 2007).
Un marker serologic caracteristic al bolii este prezența AMA, țintele antigene fiind proteina M2 a membranei interne a mitocondrii (componenta E2 a piruvatelor dehidrogenazei), altele Proteinele antigenice mitocondriale cum ar fi M4, M8 și M9 sunt implicate în mai puțin proporție. AMAS sunt prezente la 90% dintre pacienții cu CBP, iar în 30% din cazuri pot fi însoțite de model fluorescent citoplasmatică și / sau model periferic în testul anticorp antinuclear. (Bruguera & Ichiyanagui, 2008). El le iubește pe o frecvență mai mică, poate fi găsită și în boala hepatică indusă de droguri, sifilis, tuberculoză și alte boli autoimune hepatic. (O’Brien, Iordania, Guindi, Hans & dienes, 2009)
Diagnosticul serologic al CBP se bazează pe IFI și ELISA. IFI utilizează ca tăieturi histologice substrate ale stomacului ficat, rinichi sau șoarece și linia celulară HEP-2. Testele ELISA folosesc ca un substrat de antigen al complexului piruvat dehidrogenazei obținut din inima bovină sau porcină (Dahnrich, perechi, cavaleria Llorenq, Wolfgang & probst, 2009)
O caracteristică avantajoasă a testului IFI este că permite să evalueze în același timp câteva tipuri de proteine antigenice în același substrat (exemple: SP100, GP210, LB2, LKM1, LC1, SLA, M1 – M9) Ce îl face a Testați foarte sensibili, pe de altă parte, testul ELISA utilizează antigeni purificați pentru un singur marker de laborator, care îi conferă o caracteristică mai mare. În testul ELISA, un eșantion care conține anticorpi de înaltă afinitate în concentrație scăzută poate prezenta aceeași densitate optică ca o probă cu anticorpi de afinitate scăzută, dar cu o concentrație ridicată, prin urmare, nu furnizează informații cantitative ca și cu tehnica IFI, în care este posibil să se determine Printr-o serie de diluții Titlul maxim de anticorp prezentă în eșantionul unui pacient dat (amortizat & malera, 2009).
între 2008 și 2009, în Histocompatibilitatea și laboratorul imunogenetic al Institutului de la Seadis, sa observat că au existat 162 cereri de determinare AMA din 162, 49 au dat reactive pentru AMA. Pentru a face un bun diagnostic și monitorizarea acestui tip de boală, metode de diagnostic comercial sau optimizat și specificitate ridicată de sensibilitate și diagnosticare. Cunoașterea acestor aspecte determină garanția în care diagnosticul de laborator printr-o anumită metodă este eficientă și fiabilă. Înainte de a fi menționat, trei substraturi sunt evaluate în activitatea de față (tăieturi de rinichi histologice, celule HEP-2 de linie și linia celulară BHK-21 a testului IFI pentru diagnosticul CBP pe care Mide îl iubește pentru a determina ce substrat este cel mai sensibil , specifice, eficiente și care are un acord mai bun cu testul ELISA pe care Mide îl iubește.
Materiale și metode
Populația studiată
Probele utilizate în acest studiu A venit de la pacienții care au participat la Institutul de la Seadis în perioada aprilie 2008- mai 2009 > 1,10 ui / ml). Eșantioanele panoului negativ al SERA au fost SERA de pacienți aparent sănătoși fără o istorie de boală hepatică (rezultatele transaminazei, fosfatază alcalină și bilirubina normală, serologia pentru virusul hepatitei negative și rezultatele ELISA pentru amanta negativă (index < 0,90 UI / ml).Fiecare dintre panourile serice au fost constituite din 25 de eșantioane. Toți pacienții care au folosit serurile pentru a construi panourile SERA pozitive și negative și-au acordat consimțământul să-și facă eșantionul utilizat în studiul de față.
Analiza datelor
Toate datele prezentului Studiul a fost efectuat cu ajutorul bazei de date Excel 2007, indicatorii statistici au fost utilizați pentru validații precum Indicele KAPPA și testul Mac NEMAR (López de Ullibarri & Cura, 2008) .
Prepararea impresiei
Imprinturile cu substratul celular BHK-21
Toate aceste proceduri a fost realizata in laminar de curgere (Gelaire) si a lucrat cu noua și un material steril.
O alicotă a celulelor stocate în azot lichid și a fost transferată într-un tubal de 15 ml Falcon și 3 ml de RPMI 1640, apoi a fost centrifugată la 2500 rpm timp de 5 minute, de data aceasta a fost eliminat de supernatant, iar peleta a fost resuspendată pe 1 ml de RPMI 1640 S Uppement (10% zer fetal Bobino (SFB) suplimentat, antibiotice (gentamicină și streptomicină), apoi transferați într-o cutie de cultură celulară de 25 cm2 și incubată timp de o săptămână la 37 ° C, 5% C02 și 90% rudă de umiditate.
Odată ce placa a fost în confluență a fost închisă timp de 10 minute la 37 ° C pentru toate celulele celulele au aderat la baza cutiei de cultură, timpul celulelor decolează 15 ml tubul Falcon a fost plasat și centrifugat la 1500 rpm timp de 5 minute. Supernatantul a fost îndepărtat, peleta a fost resuspendată în 1 ml de RPMI1640 suplimentat și concentrația celulară a fost ajustată la celule de 2,5×106 / ml. În diapozitive cu 12 godeuri (MP Biomedicals, SUA), amprentele au fost preparate prin plasarea a 8 UL a celulelor ajustate la fiecare godeu. Imprinturile au fost centrifugate la 1000 rpm timp de 3 minute, iar amprentele au fost învelite cu parafilm (3M), pentru că conservarea lor a fost transportată la 4 ° C timp de 30 de minute și apoi păstrată la -20 ° C până la utilizare.
Imprinturile cu substratul tăieturile de rinichi histologic de șoarece
rinichi de 25 de șoareci (albinouri elvețiene) de 28 săptămâni au fost extrase cu greutate medie de 20 g +/- 2 g, pe care au fost donați de Bioterio a Facultății de Științe Pharmaceutice și Biochimice. Rinichii au fost spălați cu tampon salină de fosfați (PBS) constituiți din fosfat de sodiu 112,5 mmol / L, 30 mmol / l fosfat de potasiu, clorură de sodiu 1,15 mol / l, azidă de sodiu 0,95 g / l pH 7,5 Apoi, rinichii au fost plasați într-o farfurie Petri conținând carboximetil celuloză de sodiu (Sigma Aldrich) și îngheța la -20 ° C până la momentul utilizării. Pentru a efectua tăieturile de cristal, au fost preparate tacos cu rinichii ambalate în 4% carboximetil celuloză. Cuturile au fost efectuate pentru a îngheța folosind un cristat (Leyca) la -27 ° C, patru tăieturi de rinichi au fost plasate pentru fiecare foaie de diapozitive. Cuturile făcute au avut diametrul mediu de grosime de 5 mm și 5 um.
Prepararea conjugatului fluorescent
pentru a determina titlul optim al conjugatului fluorescent (IgG anti-gamaglobulină și IgM marcate cu fluorescein tioisocianat) diluții (1/100, 1/150, 1/200 și 1/300) au fost preparate cu DIL | U.YE de conjugat (50 UL de Evans Blue 0,4% în 3,5 ml PBS).
titrarea conjugatului fluorescent pentru „IFI care utilizează ca tăieturi histologice substrate ale rinichiului de șoarece și a celulelor BHK-21 BHK-21.
pentru titrarea conjugatului fluorescent a fost utilizat pozitiv și negativ Controale pentru iubirea de la Organtec Casa Comercială, Germania.
Imprinturile cu acetonă PA (-20 ° C) au fost fixate timp de 8 minute, hidratate cu 10 min într-un borcan Koplin care conține PBS (10x) pH 7,2 . Au fost efectuate diluții (1 / 10,1 / 20 și 1/40) ale serului de control pozitiv și negativ. Apoi, s-au însămânțat 40 UL de diluții ale SERA , 30 de minute a fost incubat la temperatura camerei (t ° A) și într-o cameră umedă pentru a evita uscarea tăieturilor sau a celulelor histologice fixate. Imprinturile au fost spălate cu 10 minute în PBS și agitație continuă. Imprinturile au fost uscate cu hârtie absorbantă și au fost plasați din nou într-o cameră umedă. 25 ul a fost plasat de diluții care urmează să fie evaluate de la conjugatul fluorescent (1/100.1 / 150, 1/200 și 1/300). A fost incubat în întuneric timp de 30 de minute la ° A. După acest timp, a fost efectuată procesul de spălare și uscare descris mai sus. Soluția de montare (12% mowiol, glicerol, 30% glicerol, s-a adăugat tris 20 mmol / l, 0,95 g / l azide de sodiu) și a fost plasată o acoperire pe fiecare diapozitiv pentru a evita uscarea amprentelor. În cele din urmă, au fost citite plăcile microscopului UV cu o creștere de 40x.
Immunofluorescență indirectă (IFI)
Testarea IFI cu celule HEP-2, a fost efectuată conform instrucțiunilor producătorului de kit Comercial (site-ul obligatoriu, Marea Britanie).Pe scurt: s-au efectuat diluții 1/40 și 80 și 1/160 din panourile SERA și de control.
30 de minute au fost incubate la T ° A. Plăcile corespunzătoare au fost spălate timp de 10 minute și uscate, conjugate și incubate în întuneric timp de 30 de minute, apoi amprentele au fost spălate și uscate din nou și mijloacele de montare a fost plasată. Plăcile de microscop UV cu o creștere de 40x.
Pentru realizarea testelor IFI cu celule BHK-21 și tăieturile histologice a fost urmată protocolul descris în titrarea conjugată, cu excepția care a fost utilizată titlul optim al conjugatului pentru fiecare substrat. Cu toate substraturile evaluate, a fost utilizat simultan un control pozitiv și negativ (ORGENTEC). Controlul pozitiv al AMA ar trebui să producă un model citoplasmatic de culoare verde cu intensitate (++) de la 1/40 diluare. Controlul negativ nu ar trebui să emită fluorescență la 1/10 diluție în celulele renale sau 1/40 în liniile celulare. (Site-ul de legare, 2011).
Pentru interpretarea rezultatelor testelor IFI au fost luate în considerare eșantioane negative atunci când a existat absența fluorescenței de mere verde în citoplasmă. O probă a fost considerată pozitivă dacă colorarea citoplasmei a fost mai mare decât controlul negativ. (Fig.1).
În scopul studiului, Kitul ELISA care măsoară anticorpi împotriva mărcii mitocondriale M2 Trinity Biotech a fost considerat un standard de aur, care raportează o sensibilitate 91% și specificitatea lui 100% (AE59E0B5EC „> metcalf, 2008).
Rezultate
Atunci când efectuați analiza anterioară a pacienților care au participat la serviciul de laborator a fost stabilită din toate testele cerute pentru detectarea bolilor autoimune în timpul a două modalități (2008 și 2009), determinarea AMA (ELISA) a fost solicitată de 7% din cazuri, cu 69 de cereri fiind 2008 și 93 în 2009, având un total de 162 cazuri presupuse de ciroză primară biliară în cele două aranjamente. Din cele 162 de eșantioane 49 au fost realizate ca reactive pentru AMA. Sa observat că majoritatea pacienților diagnosticați ca reactivi de dragoste au fost femei (80%). Seria a 20 de femei și 5 bărbați au fost considerați în panoul SERA pozitiv. Vârsta medie a pacienților a căror eșantioane au fost incluse în studiul de față a fost de 46 de ani, cu valori extreme de 22 și 77 de ani.
S-au efectuat diluții: 1/10, 1/20 și 1/40 de controale pozitive și negative. Titlul optim a fost evaluat la care ar putea fi utilizat conjugatul. Diluțiile au fost evaluate 1/100, 1/150, 1/200 și 1/300. Acest experiment a fost realizat în triplicat și, ca rezultat, sa observat că s-a obținut diluția 1/150, adevăratele rezultate pozitive (VP) și adevărate rezultate negative ale serului de control comercial,
iv id = „Evaluarea rezultatelor testului de diagnosticare în cele trei substraturi evaluate
Prin evaluarea sensibilității, specificității, valorilor predictive pozitive și negative și eficienței celor trei substraturi evaluate, sa observat că linia celulară BHK-21 este substratul cel mai puțin eficient, substratul celular HEP-2 a arătat Mai puțină specificitate, sensibilitate redusă și, prin urmare, mai puțină eficiență decât tăieturile histologice ale substratului. Rezultatele arată clar că reducerea histologică a substratului este cea mai eficientă metodă de diagnosticare prin IFI pentru CBP.
Determinarea Concordanțele diferitelor substraturi utilizate pentru rezultatele frontale AMA găsite de ELISA
Testele de concordanță utilizate au fost: Indicele KAPPA și testul MC NEMAR pentru două teste conexe (potrivite). Rezultatele diferitelor teste de concordanță (p < 0,05) pentru substraturile diferite față de metoda ELISA care măsoară anticorpi antigenici anti-mitocondriali (standard de aur). Valoarea critică așteptată în testul MC NEMAR a fost de 3,84 (p < 0,05).
Reducerea histologică a arătat un indice kappa de 0, 84 că, în conformitate cu scala a indicelui corespunde unei concordanțe foarte bune cu rezultatele obținute prin metoda ELISA. Testul MC NEMAR a prezentat un rezultat de 0,25.
LINEBHK-21 celula a prezentat un indice KAPPA de 0,12 (concordanță cu deficit) cu rezultatele obținute prin metoda ELISA. Testul de duș MC NEMAR a arătat o valoare de 1,13.
linia celulară HEP-2 a prezentat un indice KAPPA de 0,6 (concordanță moderată) față de rezultatele obținute prin metoda ELISA. Valoarea MC NEMAR a fost de 12,1.
iv id = „98c6563416”
Deoarece tăieturile histologice au arătat că metoda IFI este mai eficientă pentru diagnosticul CBP Prin IFI, rezultatele au fost comparate cu o metodă comercială IFI pentru AMA.Indicele Kappa găsit a fost de 0,66 (concordanță foarte bună). Testul MC NEMAR a prezentat o valoare de 1.33.
Discuție
Atunci când analizați cazurile pozitive pentru CBP în laboratorul nostru, determinăm că 80% din cazuri afectează femeile, fiind relațiile femeilor / Omul 4: 1 Aceste constatări sunt similare cu cele raportate de: Abarca, Peña Herrera & unde determină etiologia, supraviețuirea, complicațiile și mortalitatea în ciroza hepatică în ceea ce privește evidența Ecuadorului un raport femeie / om de 2,4: 1; De asemenea, cedeño & medina (2008) determină că 90% dintre femei sunt afectate de această boală. Din cele 25 de eșantioane pozitive care au fost utilizate în acest studiu 20 au venit de la femei. Valera, Smok & Poniachik (2007) În studiul efectuat la Spitalul Clinic al Universității din Chile și la clinica Las Condes de Chile la 115 pacienți, au arătat că 110 erau femei Ceea ce era echivalent cu 96% prin găsirea unui raport de implicare a femeii / omului de 9: 1, se știe că factorii hormonali sunt unul dintre factorii care predau bolile autoimune. (Rojas, 2007, p.324).
În studiul de față determinăm că vârsta la care sunt prezentate cazurile CBP sunt de 45 de ani. Date similare au fost raportate de Dávalal, Román & Bustios (2007) într-un studiu al hepatitei autoimune în care au inclus CBP mai mult formele lor clinice și factorii legați de răspunsul la tratament care prezintă rang Abges de afectare de la 48 la 59 de ani, o posibilă explicație a acestui fenomen este că, la această vârstă, timusul și-a pierdut în mare măsură capacitatea de a distruge limfocitele T Auto-reactory prin selecție negativă, care este un factor predispus la boala autoimună.
face un bun diagnostic clinic și laborator pentru acest și alt tip de boli autoimune este vitală, în principal datorită caracterului de invalidare al pacientului sau faptului că acestea pot pune în pericol viața pacientului în alte cazuri. În acest ultim aspect, Jones & Metcalf (2008) a stabilit că pacienții cu CBP în stadiul III / IVDE au o mortalitate mai mare (43,6%) decât populația normală. Prin urmare, în cazul unui diagnostic de laborator al CBP, trebuie să fie disponibil un test de eficiență mai mare. În experiența noastră am observat că folosind substraturi dacă, linii celulare (BHK-21, HEP-2) sau tăieturi de cristal ale țesuturilor (ficat sau rinichi de șoarece) pot fi evidențiate la nivelul citoplasmei celulare, care este direct legat de tipul imunologic al bolilor hepatice, infecții virale sau alte autoimune suplimentare am naturi etc. (Almeida et al., 2008).
Din cele trei substraturi evaluate, determinăm că cele bazate pe liniile celulare au utilitate limitată, în special cele utilizate de linia celulară BHK-21 care au o eficiență de 56% , Sensibilitate de 48% și specificitate de 64%. În timp ce acest substrat este considerat bun pentru a determina anticorpi antinucleari. (Sosa & sánchez, 2007) nu este pentru diagnosticul CBP, deoarece are o concordanță scăzută cu testul de aur standard evaluat (ELISA-AMA). Nu există rapoarte privind bibliografia despre prezența sau absența acestor antigeni mitocondriali pe linia celulară BHK-21.
O constatare interesantă a fost aceea de a afla că cu linia celulară HEP-2 în ciuda faptului că are o concordanță moderată (conform indicelui KAPPA) față de testul ELISA, a arătat că are o specificitate de 100%, este în valoare de faptul că dacă acest substrat nu a fost observat, nici o fluorescență nu a fost observată la nivelul citoplasmului celular, se poate spune că pacientul nu este prezent Boala, dar totuși, este necesar să se utilizeze un test mai eficient pentru a confirma mai sus. În ceea ce privește sensibilitatea acestui substrat, nu se observă nici o diferență semnificativă cu celulele BHK-21.
Reducerile crioșatice de rinichi de șoarece au fost cele mai eficiente, cu o sensibilitate și specificitate de 92%, respectiv de 92%. De asemenea, au arătat rezultate mai largi cu metoda ELISA-AMA (Kappa 0,84). În general, se știe că sensibilitatea și specificitatea metodelor IFI pentru AMA sunt de 95% (Valera, Smok & Ponia-chik, 2007). Aceste rezultate ne arată că metoda IFI optimizată în histocompatibilitatea și laboratorul imunogenetic al Institutului de la Seadis este la fel de bun ca metodele similare oferite de diferite case comerciale.Deși există diferențe la nivelul sensibilității și specificitatea cu metoda ELISA (metoda definitivă pentru diagnosticarea CBP), singurul sau probabil cel mai important avantaj al metodei IFI față de metoda ELISA este că nu este limitat doar la detectarea antigen M-2 mitocondrial, dar poate da rezultate pozitive împotriva antigenelor M1 la M9. Orientarea medicului în acest mod la diagnosticarea bolilor hepatice autoimune, tipul I, II, III sau al altor cazuri autoimune ne-ficat și chiar de infecții virale. (Melendez & Dujarric, 2008). Un alt avantaj nu este mai puțin important este că metoda optimizată face ca testul să fie mai accesibil pacienților, deoarece costul reactivului pe test este BS. 13 Împotriva BS. 45 din kitul de imunofluorescență și BS. 31.50 din setul ELISA Metoda optimizată prezintă, de asemenea, dezavantaje, primul este consumul de timp (sacrifică mouse-ul, extracția și conservarea RI-„, diluțiile seriale ale probelor de control, spălările, citirea în microscopul de fluorescență). Pentru experiența propriei sale, constatăm că este investit o oră la o oră și o jumătate mai procesa de prelucrare a eșantioanelor de către IFI decât de ELISA. De asemenea, este important să se sublinieze că profesioniștii sunt necesari pentru a face citirea și interpretarea modelelor fluorescente. O altă constatare importantă a fost găsită că diferite modele citoplascente fluorescente ar putea fi evidențiate într-un anumit substrat. Cu rezultatele obținute din acest studiu, a fost posibil să se determine că dintre cele trei substraturi evaluate, tăieturile de rinichi histologice sunt cel mai eficient substrat și este substratul care are cea mai bună concordanță cu rezultatele testului ELISA pentru diagnosticul de diagnosticare CBP. Pe de altă parte, sa stabilit că există o concordanță foarte bună cu rezultatele IFI dintr-un kit comercial de caracteristici similare. Testul de diagnostic utilizat ne-a permis să validați testul IFI care utilizează tăieturi histologice ca ecran de testare pentru diagnosticul CBP.
referințe
Eduardo, Z., Villena, J., Navarrete, S., & Figueroa. (2008). Relația clinică clinică și patologică a biliei primare. Boli ale aparatului digestiv 1 (4), 5-8. Repetați de la http://www.cfnavarra.es/salud/anales/textos/vol26/n3/revis2a.html
Bruguera, M. (2009). Diagnostic și tratament. Boli ale conductelor biliare intrahepatice distal la adult: Cholangită și ductopenie.med Clin (Barcelona), 1 07,338 341. recuperat de la http://www.donostiaospitalea.orgcats/cats61.htm
idrovo, C. ( 2007). Cirooza biliară primară. Bogota. Fundația Santa Fe Madrid: Elsevier
Ichiyanagui, c., & Rodriguez ,. (2008). Boli hepatice holestatice. Departamentul de boli ale dispozitivului digestiv. 1 (4). Recuperat de la http://www.cfnavarra.es/salud/anales/textos/vol26/n3/revis2a.html.
Brien, C., Jordan, J., Maha, G., Hans, Q., Dienes, J., & Heathcot, L. (2009 ) Urmărirea termenului de anticorp de anticorp pozitiv Ant Mitchondrial Hepatita Hepatologi 48 (2), 550-556. Recuperat de la
dahnrich, c., C., Blorenc, c., Rosemann, A., Wolfgang, S., & Vergani, D. (2009). Detectarea anticorpilor antimitocondriali specifici ai cirozei primare. Sticker clinic de chimie, 55: 5,978-985, recuperat de la http://www.biomedexperts.com/Profile.bme/1655595/dimitrios_bogdanos
Courous, L., & manchera, L. (2008). Concordanță între ELISA și IFI pentru determinarea anticorpilor de tip IgG împotriva toxoplasmei gondii. Asociația de infectare columbiană. Recuperat de la http://www.aeped.es/protocolos/infectologia/index.htm
(2008). Măsuri de concordanță: Indicele KAPPA Designul și analiza experimentelor clinice Galparsoro 6,169-171. Recuperat de la http://www.fisterra.com/mbe/investiga/kappa/kappa2.pdf remediu, E. (2004). Manual de proceduri de control al calității pentru laboratoarele de serologie ale băncilor de sânge. Washingtog, D.C: Organizația Pan Americană pentru Sănătate.
situs de legare. HEP-2 ANA / Substratul diapozitive. Introducerea kitului comercial.
Trinity Biotech. Inserția Mitocondriilor CaptiatM din kitul comercial. Jones, D., & metcal. (2008). Prognoza prognozată a cirozei biliari primare. Hepatologi 26,1138-1142. Recuperat din http://www.donostiaospitalea.org//cats/cats61.htm
„AE59E0B5EC”> Garnes, c. (2006) . Etiologie, supraviețuire, complicații și mortalitate în ciroza hepatică în Ecuador. Evaluarea retrospectivă de 15 ani în America Latină 1,29-34.
Cedeño, L., & Medina, J. (2008). Ciroza primară biliară. Medisan Recuperat din http://74.125.47.132/search?q=cache:xSGNf_1n07MJ:bvs.sld.cu/revistas/san/vol11_307/san12307.htm ciroză primară biliară la femei.
Valera, J.M., Smok G., & Poniachik, G. (2008). Ciroză primară biliară: treisprezece ani de experiență în două centre de referință.Rev Méd Chile 4,469-474. Recuperat de la http://www.scielo.cl/scielo.php?pid=S003498872006000400010&script=sci_arttext
roșu, W. (2004). Imunologie. 13Aed. Medellin Columbia.Corporation pentru investigații biologice P 324.
Dávalo, M., Román, R., & bustios, c. (2008). Hepatita autoimună: forme clinice și factori legați de răspunsul la tratament. Gastroenterol. 24: 305-313. Recuperat de la http://www.cfnavarra.es/salud/anales/textos/vol26/n3/revis2a.html.
Almeida, J. (2002). Anticorpi antitiribozomi ca markeri de activitate în Les. Analele medicinei interne. Madrid.
PORCEL, J. (2007). Teste de laborator pentru studiul bolilor sistemice autoimune. Clínica-Unr.org, recuperat din http://www.clinica-unr.org/Especiales/20/Especiales%20Laboratorio_Porcel.pdf
Harrison, (2007). Criteriile de diagnosticare a hepatitei autoimune. Manual de. Terapeutică medicală.
Sosa, L.F., & Sanchez, L. (2004). Validarea metodelor serologice care sunt utilizate pentru diagnosticarea bolilor reumatice definite: lupus sistemic eritematos (LES). Biofarbo. 12, 15-19.
Meléndez, M., & Dujarric, M. (2008). Evaluarea imunohistochimiei pentru diagnosticarea bolilor autoimune.Rev Cuban Invest Biomed 23 (3): 133-8 recuperat din http://bvs.sld.cu/revistas/ibi/vol23_3_04/ibi01304.pdf.