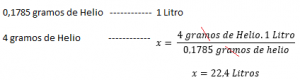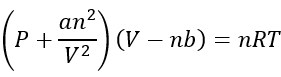Gazele care se abate de la comportamentul ideal sunt cunoscute ca gaze reale, nu respectă ecuația gazelor reale. Ei provin din doi factori:
în timp ce teoria kinetică – face moleculară Un loc excelent care explică gazele, există câteva proprietăți care nu explică despre descrierea gazelor reale. Teoria presupune că coliziunile dintre moleculele de gaz și pereții unui recipient sunt perfect elastice, particulele de gaz nu au nici un volum și nici forțe de repulsie sau de atracție între molecule. Aceste ipoteze se referă la gazele ideale. În timp ce aceste ipoteze sunt, în general, adevărate, există circumstanțe în care gazele se abțin de la comportamentul ideal.
Gazul se comportă într-un mod non-ideal (sau real) la temperaturi scăzute datorită faptului că la temperaturi scăzute, molecule se mișcă L Inițial, permițând forțele de repulsie sau de atracție să intre în vigoare, deturnând de la comportamentul unui gaz ideal. Gazele se comportă, de asemenea, non-ideal la presiuni mari, deoarece la presiuni mari, volumul moleculelor devine un factor.
pentru a ilustra diferențele mici dintre Proprietățile numerice ale gazelor reale și ideale la temperaturi și presiuni normale, luați în considerare următoarea comparație. Vă veți aminti că folosim ecuația de gaze ideală pentru a calcula o valoare pentru volumul molar al unui gaz ideal în condiții normale de presiune și temperatură.
Dacă densitatea unui gaz este cunoscută la o anumită temperatură și o presiune dată , Calculați volumul molar va fi relativ ușor. De exemplu: cu o presiune 1 atm la 273 k, densitatea heliului este de 0,1785 g / l. Aceasta înseamnă că 0,1785 g de heliu ocupă 1 litru în condiții normale de presiune și temperatură (1 atmosferă și 273 k). Apoi, pentru a calcula volumul molar, de exemplu Helium:
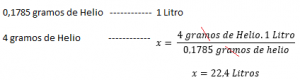
Densități de gaz și volum molar (la condiții de presiune normală și temperatură)
| |
densitate (g / l) |
iv id = „5d5ea31Af6” volum molar (Div id-he el div id = „5d5ea31Af6” 0.1785
22.4 |
iv id = „5d5a31Af6” n2
| 1.2506 |
22.4 |
iv id = „5d5ea31Af6” O2
| 1.4290 |
|
5d5a31AF6 ” CH4
0.717 |
id id = „5d5ea31Af6”> 22.3
| CO2 |
1.977 |
divid id = „5d5ea31Af6”> 22.3
c2h4
| 1.260 |
div id = „5d5ea31Af6” 22.2
NH3 |
0.769 |
div id = „5d5ea31Af6” 22.1
| SO2 |
iv id = „5d5ea31Af6 div id =” 5d5ea31Af6 ” 21.9
Deși pentru calcule simple, folosim valoarea de 22,4 litri pentru toate gazele pot fi văzute că nu este exact adevărat. Chiar și la temperaturi și presiuni normale, gazele reale se pot abate ușor de comportamentul ideal. Abaterea este mult mai mare în condiții mai extreme, deoarece vom vedea mai jos: Factori de compresie
pentru un gaz ideal, PV = NRT. Se îndeplinește că atunci când împărțiți PV / NRT = 1.
pentru gazele reale, acest lucru este posibil numai la presiuni reduse (mai puțin de 5 atmosfere). Analizând graficul se observă că abaterea devine mai pronunțată cu creșterea presiunii. Și creșterea temperaturii gazul are un comportament aproape de ideal.
într-un gaz real, deoarece presiunea crește, coeficientul dintre PV / NRT crește la un număr mai mare decât unul, (PV / NRT > 1) distorsionarea idealității. Același lucru se întâmplă atunci când o temperatură scade, deoarece factorul de compresie crește peste 1 (PV / NRT iv ID = „6B8A834FD9” 1), deoarece temperatura se apropie de un număr mai mic.
un ideal ideal Gazul are un factor de compresibilitate egal cu unul, dar factorul de compresibilitate pentru un gaz real poate varia foarte mult de la acest număr. Grafica de mai jos arată cum acest lucru variază în funcție de azot pe măsură ce schimbați temperatura și presiunea.
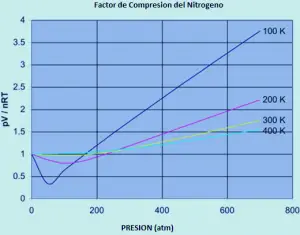
Dacă azotul a fost un gaz ideal în toate condițiile de temperatură și presiune, fiecare dintre aceste curbe ar fi o linie orizontală dreaptă care ar arăta un factor de compresie de 1. (desigur, acest lucru este evident adevărat).
Pentru a fi luate în considerare
la presiuni reduse de aproximativ o atmosferă mai mică de 1 mai mică de 1, factorul de compresie aproximează 1. Abordarea de azot a comportamentului ideal față de presiunile obișnuite.
Comportamentul non-ideal se agravează mai jos temperaturi. Pentru temperaturi de 300 sau 400 K, factorul de compresie se apropie de 1 într-o gamă largă de presiuni. Azotul devine mai ideal într-un interval de presiune mai mare, deoarece temperatura crește.
Comportamentul non-ideal agravează presiuni mai mari. Ar trebui să existe cel puțin un efect care face ca raportul PV / NRRT. Prea scăzut, în special la temperaturi scăzute. Și ar trebui să existe cel puțin un efect care trebuie să crească prea mult ca creșterea presiunii.
este același comportament manifestat cu alte gaze?
Graficul următor arată modul în care factorii de comprimare variază în funcție de presiunea pentru o varietate de gaze la o temperatură fixă de 273k.
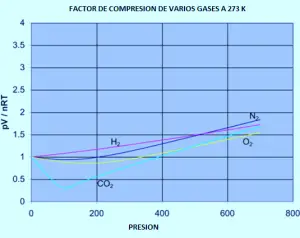
Dacă a trebuit să refaceți setul de grafică originală de azot (la temperaturi variabile) pentru oricare dintre celelalte gaze, ați afla că fiecare dintre ele va produce un set de curbe similare cu cele ale azotului. Ceea ce variază este temperatura la care sunt produse diferite forme grafice. De exemplu, dacă graficul de dioxid de carbon este observat la 273 k (grafic anterior), este similar cu azotul la 100 k al primului set de curbe, deși nu crește atât de pronunțată la presiuni mai mari.
Este ușor de spus că gazele devin mai puțin ideale la temperaturi scăzute, dar ceea ce are o temperatură scăzută variază de la un gaz la altul. Cu cât temperatura este mai aproape de temperatura la care gazul este transformat în lichid (sau, în cazul dioxidului de carbon, într-un solid), cu atât mai mult nu este ideal de gaze.
Ce cauzează comportamentul non-ideal ?
În ipotezele pe care le facem despre gazele ideale, există două afirmații care spun lucruri care nu pot fi adevărate ale unui gaz real, iar acestea au un efect atât asupra presiunii, cât și asupra volumului.
Problema volumului:
Teoria cinetică presupune că, pentru un gaz ideal, volumul ocupat de molecule este complet nesemnificativ în comparație cu volumul containerului. Pentru un adevărat gaz (real), această ipoteză nu este adevărată. Moleculele înșiși ocupă o parte a spațiului din recipient. Spațiul din recipient este disponibil, astfel încât lucrurile să se miște mai puțin decât volumul măsurat al containerului. În imagine, teoria cinetică presupune că este disponibil tot spațiul, astfel încât moleculele să se miște înăuntru. Dar, de fapt, așa cum se vede în imagine (b), numai acea cantitate de spațiu este disponibilă, deoarece restul volumului este ocupată de moleculele în sine.
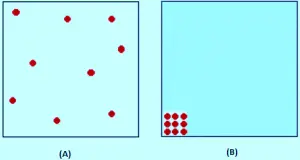
Dacă presiunea este scăzută, volumul ocupat de moleculele reale este nesemnificativ în comparație cu volumul total al recipientului.Dar, pe măsură ce se comprimă gazul, proporția volumului total pe care moleculele ei îl ocupau din ce în ce mai mult. Imaginați-vă că comprimați atât gazul pe care moleculele o ating reciproc. În acel moment, volumul disponibil astfel încât moleculele să se miște este zero.
presupuneți că, la o presiune ridicată, volumul recipientului este de 1000 cm3, dar presupunând că moleculele ocupă până la 100 cm3 din ea.
Ecuația ideală de gaz a fost dezvoltată făcând calcule bazate pe ipoteza teoreticienilor cinetici. Se presupune că V în PV este volumul disponibil, astfel încât moleculele să se poată mișca liber, dar în acest caz ar fi doar 900 cm3, nu doar 1000 cm3
dacă calculează factorul de compresie, PV / NRT, punerea Volumul containerului total în formula, valoarea pe care o vom obține ca rezultat va fi mai mare decât ar trebui să fie (deoarece volumul real ar trebui să fie 900 cm3).
pentru un gaz real, cum ar fi azotul, observați cum Factorul de compresie tinde să crească cu presiune, în timp ce pentru un gaz ideal, factorul de compresie ar fi 1 la orice valoare de presiune.

Valoarea factorului de compresie este prea mare la presiuni mari pentru un gaz real. Motivul pentru aceasta este că volumul măsurat pe care îl folosim în expresia PV / NRT este prea mare (ne amintim cazul anterior) și nu luăm în considerare volumul ocupat de molecule. Această eroare arată mai mult când gazul este comprimat.
Problema de presiune:
O altă ipoteză a teoriei cinetice pentru gazele ideale este că nu există forțe intermoleculare între molecule. Asta e în neregulă, deoarece în gazele reale nu este așa. Dacă nu ar exista forțe intermoleculare, ar fi imposibil să condensați gazul ca lichid. Chiar și heliul, care are cel mai mic dintre forțele intermoleculare, poate deveni un lichid dacă temperatura este suficient de mică.
Ce efect au forțele intermoleculare? Pentru o moleculă de gaz care se află în centrul recipientului, nu va exista niciun efect nu (imaginea A). Moleculele vor atrage până la un punct în care aceste atracții sunt anulate reciproc. Atracțiile exercitate de molecula din spate tind să încetinească și vor fi anulate de atracțiile moleculelor din fața acestuia, tinzând să o accelereze (ambele atracții sunt anulate).
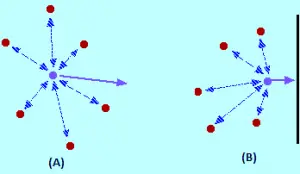
Molecula va continua să se miște în aceeași direcție la aceeași viteză, dar când este prin lovirea containerului, apare următoarele: deoarece nu există Moleculele din fața lui, nu este produsă anularea atracțiilor intermoleculare. Prin urmare, molecula începe să scadă viteza chiar înainte de a lovi cu peretele containerului (imaginea B). În consecință, se va ciocni cu peretele cu o forță mai mică și o presiune mai mică.
Efectul general al acestui lucru este vinovatul că presiunea este mai mică decât ar fi dacă gazul era ideal. Aceasta înseamnă că, dacă presiunea măsurată în expresia PV / NRRT este plasată, valoarea factorului de compresie va fi mai mică decât dacă gazul este ideal. Acesta este motivul pentru care, în anumite condiții, grafica factorilor de compresie este sub valoarea ideală de 1. Să vedem din nou exemplul de azot (dacă știu deja, te-ai obosit de la haha grafică).

Acest efect este mai important la temperaturi scăzute. De ce? La temperaturi scăzute, moleculele se mișcă mai încet. La temperaturi mai ridicate, unde moleculele se deplasează mult mai repede, orice mică înapoiere a moleculei spre centrul gazului va observa abia. La temperaturi ridicate, efectul forțelor intermoleculare este cu siguranță nesemnificativ, deoarece moleculele scapă din interacțiuni.
Există un efect final în ceea ce privește forțele intermoleculare, care este ușor ascuns. Pe măsură ce presiunea crește, moleculele sunt mai bune. Dacă sunt mai aproape, forțele intermoleculare vor fi mai importante.
Care este gazul cel mai ideal?
ar trebui să căutăm un gaz ale căror molecule sunt cele mai mici, și unde forțele intermoleculare sunt foarte scăzute. Că gazul ar fi heliu. O moleculă de heliu are un singur atom care este foarte mic, iar forțele de dispersie Van der Waralals sunt foarte scăzute.
ca heliul, o moleculă de hidrogen are, de asemenea, doi electroni, astfel încât forțele intermoleculare să fie mici (dar nu la fel de mici ca heliu). În molecula de hidrogen, aveți doi atomi pe care puteți distribui încărcăturile.Pe măsură ce moleculele devin mai mari, atunci forțele de dispersie vor crește și puteți obține alte forțe intermoleculare, cum ar fi atracțiile Dipolo-dipol. Gazele din molecule ca acestea vor fi mult mai puțin ideale.
Ecuația van der wauals
Există un număr mare de ecuații care pot descrie modul în care actul real al gazelor, dar pentru a face Este simplu, chimistii aderă la ecuația van der walals, deoarece este cel mai ușor de a descrie modul în care actul de gaze:
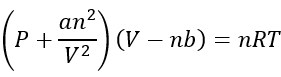
P este presiunea în atmosfere (ATM)
V este volumul în litri (l)
n este numărul de moli (MOL)
A este doar o constantă de proporționalitate
b este, de asemenea, o constantă de proporționalitate
Rețineți că este foarte asemănătoare cu ecuația ideală de gaz, dar corectează unele lucruri.
partea dreaptă a ecuației este exact aceeași că ecuația ideală de gaze. Se schimbă numai în ceea ce privește presiunea și volumul pentru a realiza lucruri în ceea ce privește forțele intermoleculare și volumul moleculelor de gaz.
pe partea stângă explică o presiune mai mică decât cea a unui gaz ideal, deoarece ia în considerare Corecțiile care apar atunci când moleculele au înmuia impactul celorlalte molecule din interacțiunile intermoleculare.