I gas che deviano dal comportamento ideale sono noti come gas reali, non rispettare l’equazione dei gas reali. Origina in due fattori:
- La teoria dice che mentre la pressione aumenta il volume del gas diventa più piccola e si avvicina a zero. Sebbene si avvicina a un piccolo numero, non sarà zero perché le molecole occupano lo spazio (cioè, hanno volume) e non possono essere compressi.
- Ci sono forze intermolecolari nei gas. Queste forze diventano sempre più importanti a basse temperature, dove il movimento traslazionale delle molecole diminuisce, quasi per fermarsi. Tuttavia, ad alte temperature, o anche a temperature normali, le forze intermolecolari sono molto piccole e tendono ad essere considerate insignificanti.
Introduzione
Mentre la teoria cinetica- molecolare fa Un ottimo lavoro che spiega i gas, ci sono alcune proprietà che non spiegano la sua descrizione dei veri gas. La teoria presuppone che le collisioni tra molecole di gas e le pareti di un contenitore siano perfettamente elastiche, le particelle di gas non hanno volume e nessuna repulsione o forze di attrazione tra molecole. Queste ipotesi si riferiscono ai gas ideali. Mentre queste ipotesi sono generalmente vere, ci sono circostanze in cui i gas deviano dal comportamento ideale.
Gas tendono a comportarsi idealmente in due diverse situazioni:
- Idealmente coinvolto Temperature: questo è dovuto al fatto che le molecole sorvolano l’un l’altro a velocità estremamente elevate (dobbiamo ricordare che la temperatura è una misura dell’energia cinetica centrale, che è direttamente proporzionale alla velocità).
- Si comporta idealmente a Pressioni basse: Questo perché a basse pressioni, il volume delle molecole tende ad essere insignificante rispetto al volume totale del gas (ricordare che la legge di Boyle dice che la pressione e il volume sono inversamente proporzionali).
Quando ti comporti in modo non ideale?
Gas si comportano in modo non ideale (o reale) a temperature fredde dovute al fatto che a temperature fredde, le molecole si muovono l Inizialmente, consentendo la repulsione o le forze di attrazione per avere effetto, deviando dal comportamento di un gas ideale. I gas si comportano anche in modo ideale ad alta pressione, perché ad alta pressione, il volume delle molecole diventa un fattore.
gas reali e volume molare
per illustrare le piccole differenze tra il Proprietà numeriche dei gas reali e ideali a temperature e pressioni normali, considerare il seguente confronto. Ricorderai che usiamo l’equazione del gas ideale per calcolare un valore per il volume molare di un gas ideale in normali condizioni di pressione e temperatura.
Se la densità di un gas è nota a una determinata temperatura e pressione , Calcola il tuo volume molare sarà relativamente facile. Ad esempio: con una pressione 1 ATM a 273 K, la densità dell’elio è 0,1785 g / l. Ciò significa che 0.1785 g di elio occupa 1 litro in condizioni di pressione e temperatura normali (1 atmosfera e 273 K). Quindi calcolare il volume molare, ad esempio l’elio:
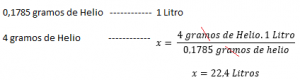
| Densità (g / l) | volume molare (litri) | |
| he | 0.1785 | 22.4 |
| N2 | 1.2506 | 22.4 |
| o2 | 1.4290 | 22.4 |
| CH4 | 0.717 | 22.3 |
| CO2 | 1.977 | 22.3 |
| c2h4 | 1.260 | 22.2 |
| NH3 | 0.769 | 22.1 |
| SO2 | 2.926 | 21.9 |
Sebbene per semplici calcoli utilizziamo il valore 22,4 litri per tutti i gas può essere visto che non è esattamente vero. Anche a temperature e pressioni normali, i gas reali possono deviare leggermente dal comportamento ideale. La deviazione è molto maggiore in condizioni più estreme, poiché vedremo sotto:
fattori di compressione
per un gas ideale, PV = NRT. È soddisfatto che quando si divide PV / NRT = 1.
per i gas reali Questo è possibile solo a basse pressioni (meno di 5 atmosfere). Analizzare il grafico si osserva che la deviazione diventa più pronunciata con l’aumento della pressione. E aumentando la temperatura il gas prende un comportamento vicino all’ideale.
In un gas reale, poiché la pressione aumenta, il quoziente tra PV / NRT aumenta a un numero maggiore di uno, (PV / NRT > 1) distorcendo idealità. Lo stesso succede quando una temperatura diminuisce, poiché il fattore compressivo aumenta sopra 1 (PV / NRT > 1) poiché la temperatura si avvicina a un numero inferiore.
Un ideale Il gas ha un fattore di compressibilità pari a uno, ma il fattore di compressibilità per un gas reale può variare notevolmente da questo numero. La grafica seguente mostra come questo varia per l’azoto mentre si modifica la temperatura e la pressione.
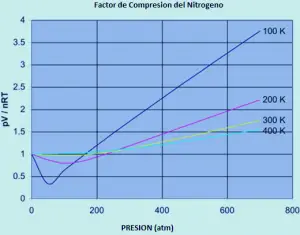
Se l’azoto era un gas ideale in tutte le condizioni di temperatura e pressione, ognuna di queste curve sarebbe una linea retta orizzontale che mostrerebbe un fattore di compressione di 1. (ovviamente questo è ovviamente vero).
da prendere in considerazione
a basse pressioni di circa un po ‘meno di 1 atmosfera, il fattore di compressione si avvicina 1. L’azoto si avvicina al comportamento ideale alle pressioni ordinarie.
Il comportamento non ideale peggiora temperature. Per temperature di 300 o 400 K, il fattore di compressione si avvicina a 1 in una vasta gamma di pressioni. L’azoto diventa più ideale in un intervallo di pressione maggiore come aumenta la temperatura.
Il comportamento non ideale peggiora le pressioni più elevate. Dovrebbe esserci almeno un effetto che rende il rapporto PV / NRT. Troppo basso, specialmente a basse temperature. E ci dovrebbe essere almeno un effetto che deve aumentare troppo come aumenta la pressione.
è lo stesso comportamento manifestato con altri gas?
Il seguente grafico mostra come i fattori di compressione variano con la pressione per una varietà di gas a una temperatura fissa di 273k.
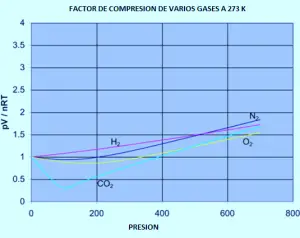
Se dovessi rifare il set della grafica originale dell’azoto (a temperature variabili) per uno di questi altri gas, si scopre che ognuno di essi produrrà un set di curve simili a quelle dell’azoto. Ciò che varia è la temperatura in cui vengono prodotte le diverse forme grafiche. Ad esempio, se il grafico di anidride carbonica è osservato a 273 K (grafico precedente), è simile all’alito a 100 K del primo set di curve, anche se non aumenta così pronunciato a pressioni più elevate.
È facile dire che i gas diventano meno ideali a basse temperature, ma ciò che ha una bassa temperatura varia da un gas all’altro. Più vicino alla temperatura con cui il gas viene convertito in liquido (o, nel caso di anidride carbonica, in un solido), più non è ideale il gas diventa.
Cosa causa il comportamento non ideale ?
Nelle ipotesi realizziamo sui gas ideali, ci sono due affermazioni che dicono cose che non possono essere vere per un gas reale, e questi hanno un effetto su pressione e volume.
Il problema del volume:
La teoria cinetica suppone che, per un gas ideale, il volume occupato dalle molecole stesse è completamente insignificante rispetto al volume del contenitore. Per un gas reale (reale), quell’assunzione non è vero. Le molecole stesse occupano una parte dello spazio nel contenitore. Lo spazio nel contenitore è disponibile in modo che le cose muoversi siano inferiori al volume misurato del contenitore.
Nell’immagine, la teoria cinetica presuppone che tutto questo spazio sia disponibile in modo che le molecole si spostano all’interno. Ma in realtà visto nell’immagine (B), è disponibile solo quella quantità di spazio, perché il resto del volume è occupato dalle molecole stesse.
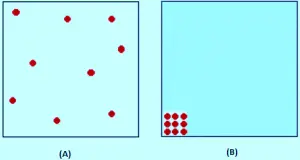
Se la pressione è bassa, il volume occupato dalle molecole effettive è insignificante rispetto al volume totale del contenitore.Ma poiché il gas comprende, la proporzione del volume totale che le molecole stesse occupano aumentate sempre più. Immagina di comprimere sia il gas che le molecole si toccano a vicenda. A quel punto il volume disponibile in modo che le molecole si muovano siano zero.
Supponiamo che ad alta pressione il volume del contenitore sia 1000 cm3, ma supponendo che le molecole occupino fino a 100 cm3 di esso.
L’equazione del gas ideale è stata sviluppata facendo calcoli in base all’ipotesi dei teorici cinetici. Si presume che V in PV sia il volume disponibile in modo che le molecole possano muoversi liberamente, ma in questo caso sarebbero solo 900 cm3, non 1000 cm3.
Se calcolezziamo il fattore di compressione, PV / NRT, mettendo il Contenitore totale del volume Nella formula, il valore che otterremo come risultato sarà superiore a quello che dovrebbe essere (poiché il volume reale dovrebbe essere 900 cm3).
per un gas reale come azoto, nota come Il fattore di compressione tende ad aumentare con la pressione, mentre per un gas ideale, il fattore di compressione sarebbe 1 a qualsiasi valore di pressione.

Il valore del fattore di compressione è troppo alto a pressioni elevate per un gas reale. Il motivo per questo è che il volume misurato che utilizziamo nell’espressione PV / NRT è troppo alto (ricordiamo il caso precedente) e non prendiamo conto del volume occupato dalle molecole. Questo errore mostra più quando il gas è compresso.
Il problema della pressione:
Un’altra ipotesi della teoria cinetica per i gas ideali è che non ci sono forze intermolecolari tra le molecole. È sbagliato, dal momento che nei veri gas non è così. Se non ci fossero forze intermolecolari sarebbe impossibile condensare il gas come liquido. Anche l’elio, che ha il minimo di tutte le forze intermolecolari, può diventare un liquido se la temperatura è abbastanza bassa.
Quale effetto ha le forze intermolecolari? Per una molecola di gas che si trova al centro del contenitore, non ci sarà alcun effetto no (immagine A). Le molecole attiraranno fino a un punto in cui quelle attrazioni vengono cancellate a vicenda. Le attrazioni esercitate dalla molecola posteriore tendono a rallentare e saranno cancellate dalle attrazioni delle molecole di fronte ad essa, tendendo ad accelerarlo (entrambe le attrazioni vengono annullate).
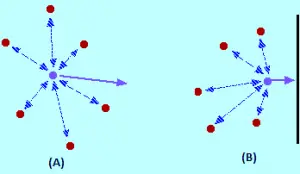
La molecola continuerà a muoversi nella stessa direzione alla stessa velocità, ma quando è colpendo il contenitore, si verifica quanto segue: come non ci sono Molecole di fronte a lui, la cancellazione di attrazioni intermolecolari non è prodotta. Pertanto, la molecola inizia a diminuire la sua velocità poco prima di colpire con il muro del contenitore (immagine B). Di conseguenza, si scontra con il muro con meno forza e meno pressione.
L’effetto complessivo di questo è il colpevole che la pressione è inferiore a quella che sarebbe se il gas era ideale. Ciò significa che se viene posizionata la pressione misurata nell’espressione PV / NRT, il valore del fattore di compressione sarà inferiore a se il gas è ideale. Questo è il motivo per cui, in alcune condizioni, la grafica dei fattori di compressione è inferiore al valore ideale di 1. Vediamo di nuovo l’esempio di azoto (se lo so già, sei stanco dal grafico haha).

Questo effetto è più importante a basse temperature. Perché? A basse temperature, le molecole si muovono più lentamente. A temperature più elevate, dove le molecole si muovono molto più velocemente, qualsiasi piccolo arretratezza della molecola verso il centro del gas noterà a malapena. Alle alte temperature, l’effetto delle forze intermolecolari è certamente insignificante poiché le molecole scappano dalle interazioni.
e c’è un effetto finale per quanto riguarda le forze intermolecolari, che è leggermente nascosta. Mentre la pressione aumenta, le molecole sono più insieme. Se sono più vicini, le forze intermolecolari saranno più importanti.
Qual è il gas più ideale?
dovremmo cercare un gas le cui molecole sono più piccole possibili, e dove le forze intermolecolari sono molto basse. Quel gas sarebbe elio. Una molecola di elio ha un singolo atomo che è molto piccolo, e le forze di dispersione van der waals sono molto basse.
Come l’elio, una molecola di idrogeno ha due elettroni, in modo che le forze intermolecolari siano piccolo (ma non piccolo come elio). Nella molecola di idrogeno, hai due atomi su cui è possibile distribuire i carichi.Poiché le molecole diventano più grandi, allora le forze di dispersione aumentano, e si può ottenere altre forze intermolecolari come le attrazioni dipolo-dipolo. I gas fatti di molecole come questi saranno molto meno ideali.
L’equazione Van der waals
Ci sono un gran numero di equazioni che possono descrivere come recitare i gas reali, ma fare It semplici, i chimici aderiscono all’equazione Van der Waals perché è il più facile descrivere come gestire i gas:
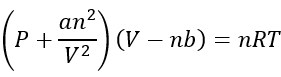
P è la pressione in Atmosfere (ATM)
V è il volume in litri (l)
n è il numero di talpe (mol)
A è solo una costante di proporzionalità
B è anche una costante proporzionalità
Tieni presente che è molto simile all’equazione del gas ideale, ma corregge alcune cose.
Il lato destro dell’equazione è esattamente lo stesso che l’equazione ideale del gas. Cambia solo rispetto alla pressione e al volume per realizzare le cose rispetto alle forze intermolecolari e al volume delle molecole di gas.
sul lato sinistro spiega una pressione inferiore a quella di un gas ideale, poiché tiene conto del correzioni che si verificano quando le molecole ammorbidiscono l’impatto delle altre molecole dalle interazioni intermolecolari.