Os gases que se desvían do comportamento ideal son coñecidos como gases reais, non cumpren coa ecuación dos gases reais. Déixanse en dous factores:
- A teoría di que a medida que a presión aumenta o volume de gas faise máis pequeno e achégase a cero. Aínda que se achega a un pequeno número, non será cero porque as moléculas ocupan espazo (é dicir, teñen volume) e non poden ser comprimidos.
- Hai forzas intermoleculares en gases. Estas forzas fanse cada vez máis importantes a baixas temperaturas, onde o movemento translacional das moléculas diminúe, case parar. Non obstante, a altas temperaturas, ou mesmo a temperaturas normais, as forzas intermoleculares son moi pequenas e tenden a ser consideradas insignificantes.
Introdución
mentres que a teoría cinética- fai molecular Un excelente traballo que explica os gases, hai algunhas propiedades que non explican sobre a súa descrición dos gases reais. A teoría supón que as colisións entre as moléculas de gas e as paredes dun recipiente son perfectamente elásticas, as partículas de gas non teñen volume e sen repulsión ou forza de atracción entre as moléculas. Estas suposicións refírense aos gases ideais. Aínda que estas suposicións son xeralmente verdadeiras, hai circunstancias nas que os gases desvíanse do comportamento ideal.
O gas tenden a comportarse idealmente en dúas situacións diferentes:
- Idealmente implican alto Temperaturas: isto débese ao feito de que as moléculas voan uns a outros a velocidades extremadamente altas (debemos lembrar que a temperatura é unha medida de enerxía cinética media, que é directamente proporcional á velocidade).
- compórtase idealmente en Presións baixas: isto é porque a baixas presións, o volume de moléculas tende a ser insignificante en comparación co volume total de gas (recorda que a lei de Boyle di que a presión eo volume son inversamente proporcionales).
Cando se comportas dun xeito non ideal?
O gas se comporta de forma non ideal (ou real) a temperaturas frías debido ao feito de que a temperaturas frías, as moléculas moven L Inicialmente, permitindo que as forzas de repulsión ou atracción teñan efecto, desviándose do comportamento dun gas ideal. Os gases tamén se comportan de forma ideal a alta presión, porque a altas presións, o volume de moléculas convértese nun factor.
Gases reais e volume molar
para ilustrar as pequenas diferenzas entre a Propiedades numéricas dos gases reais e ideais a temperaturas e presións normais, considere a seguinte comparación. Recordaredes que usamos a ecuación de gas ideal para calcular un valor para o volume molar dun gas ideal baixo condicións normais de presión e temperatura.
Se a densidade dun gas é coñecida a unha determinada temperatura e presión , Calcular o volume molar será relativamente sinxelo. Por exemplo: cunha presión 1 ATM a 273 K, a densidade de helio é de 0.1785 g / l. Isto significa que 0,1785 g de helio ocupa un litro baixo a presión normal e as condicións de temperatura (1 atmosfera e 273 k). A continuación, para calcular o volume molar, por exemplo o helio:
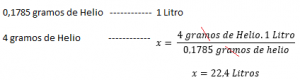
| density (g / l) | volume molar (litros) | |
| he | 0.1785 | 22.4 |
| n2 | 1.2506 | 22.4 |
| O2 | 1.4290 | 22.4 |
| CH4 | 0.717 | 22.3 |
| CO2 | 1.977 | 22.3 |
| c2h4 | 1.260 | 22.2 |
| NH3 | 0.769 | 22.1 |
| SO2 | 2.926 | 21.9 |
Aínda que para cálculos simples usamos o valor de 22,4 litros para todos os gases Pódese ver que non é exactamente certo. Incluso a temperaturas e presións normais, os gases reais poden desviarse lixeiramente do comportamento ideal. A desviación é moito maior en condicións máis extremas, xa que veremos a continuación:
Factores de compresión
Para un gas ideal, PV = NRT. Realízase que ao dividir PV / NRT = 1.
para gases reais só é posible a baixas presións (menos de 5 atmosferas). Analizando o gráfico obsérvase que a desviación faise máis pronunciada co aumento da presión. E aumentando a temperatura que o gas leva un comportamento preto do ideal.
Nun gas real, a medida que aumenta a presión, o cociente entre PV / NRT aumenta a un número maior que un (PV / NRT > 1) Distorsionar idealidade. O mesmo ocorre cando unha temperatura diminúe, xa que o factor de compresión aumenta por riba de 1 (PV / NRT > 1) xa que a temperatura achégase a un número menor.
un ideal O gas ten un factor de compresibilidade igual a un, pero o factor de compresibilidade para un gas real pode variar moito a partir deste número. Os gráficos a continuación mostran como isto varía para o nitróxeno mentres cambia a temperatura e a presión.
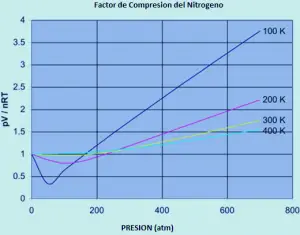
Se o nitróxeno era un gas ideal en todas as condicións de temperatura e presión, cada unha destas curvas sería unha liña recta horizontal que mostraría un factor de compresión de 1. (por suposto que isto é obviamente certo).
que se ter en conta
a baixas presións de aproximadamente un pouco menos de 1 atmosfera, o factor de compresión aproxímase 1. O nitróxeno achégase ao comportamento ideal ás presións ordinarias.
O comportamento non ideal empeora máis baixo temperaturas. Por temperaturas de 300 ou 400 K, o factor de compresión achégase a 1 nunha ampla gama de presións. O nitróxeno faise máis ideal nun rango de presión maior a medida que aumenta a temperatura. E debería haber polo menos un efecto que ten que aumentar demasiado a medida que aumenta a presión.
é o mesmo comportamento que se manifesta con outros gases?
O seguinte gráfico mostra como os factores de compresión varían segundo a presión para unha variedade de gases a unha temperatura fixa de 273k.
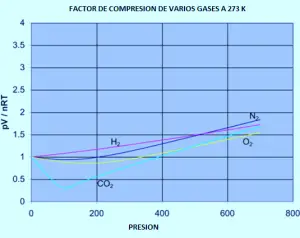
Se tivo que refacer o conxunto dos gráficos de nitróxeno orixinais (a temperaturas variables) para calquera destes outros gases, atoparía que cada un deles producirá un conxunto de curvas similares ás do nitróxeno. O que varía é a temperatura á que se producen as diferentes formas gráficas. Por exemplo, se o gráfico de dióxido de carbono é observado en 273 K (gráfico anterior), é similar ao nitróxeno a 100 K do primeiro conxunto de curvas, aínda que non aumenta tan pronunciado a presións superiores.
É fácil dicir que os gases se fan menos ideais a baixas temperaturas, pero o que ten unha temperatura baixa varía dun gas a outro. Canto máis preto da temperatura na que o gas se converte en líquido (ou, no caso do dióxido de carbono, nun sólido), máis non é ideal o gas convértese.
Que causa o comportamento non ideal ?
Nas suposicións que realizamos sobre os gases ideais, hai dúas afirmacións que din que as cousas que non poden ser verdadeiras dun gas real, e estes teñen un efecto sobre a presión e o volume.
O problema do volume:
A teoría cinética supón que, para un gas ideal, o volume ocupado polas propias moléculas é totalmente insignificante en comparación co volume do recipiente. Para un gas real (real), esa suposición non é verdadeira. As moléculas mesmas ocupan unha parte do espazo no recipiente. O espazo no recipiente está dispoñible para que as cousas se movan son menos que o volume medido do recipiente.
Na imaxe, a teoría cinética supón que todo este espazo está dispoñible para que as moléculas se movan dentro. Pero en realidade como se ve na imaxe (b), só esa cantidade de espazo está dispoñible, porque o resto do volume está ocupado polas propias moléculas.
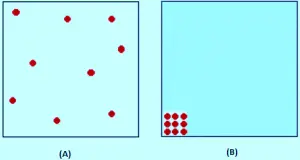
Se a presión é baixa, o volume ocupado polas moléculas reais é insignificante en comparación co volume total do recipiente.Pero a medida que o gas comprime, a proporción do volume total que as moléculas ocupan aumentan cada vez máis. Imaxina que está comprimindo tanto o gas que as moléculas se tocan. Nese punto o volume dispoñible para que as moléculas se mova sexan cero.
Supoñamos que a unha alta presión o volume do recipiente é de 1000 cm3, pero asumindo que as moléculas ocupan ata 100 cm3.
A ecuación ideal de gas foi desenvolvida por facer cálculos baseados na hipótese dos teóricos cinéticos. Suponse que V en PV é o volume dispoñible para que as moléculas poidan moverse libremente, pero neste caso só tería 900 cm3, non 1000 cm3.
Se calculamos o factor de compresión, PV / NRT, poñendo o factor O recipiente total do volume na fórmula, o valor que obteremos como resultado será superior ao que debería ser (xa que o volume real debe ser 900 cm3).
Para un gas real como o nitróxeno, aviso como O factor de compresión tende a aumentar a presión, mentres que para un gas ideal, o factor de compresión sería de 1 a calquera valor de presión.

O valor do factor de compresión é demasiado elevado a altas presións para un gas real. O motivo diso é que o volume medido que usamos na expresión PV / NRT é demasiado alto (recordamos o caso anterior) e non temos en conta o volume ocupado polas moléculas. Ese erro mostra máis cando o gas está comprimido.
O problema de presión:
Outra hipótese da teoría cinética para os gases ideais é que non hai forzas intermoleculares entre as moléculas. Isto é malo, xa que nos gases reais isto non é así. Se non houbese forzas intermoleculares sería imposible condensar o gas como líquido. Incluso o helio, que ten o mínimo de todas as forzas intermoleculares, pode converterse nun líquido se a temperatura é suficiente.
Que efecto ten as forzas intermoleculares? Para unha molécula de gas que está no centro do recipiente, non haberá ningún efecto non (imaxe a). As moléculas atraerán ata un punto onde estas atraccións son canceladas. As atraccións exercidas pola molécula traseira adoitan diminuír e serán canceladas polas atraccións das moléculas diante dela, tendendo a acelerar (ambas as atraccións son canceladas).
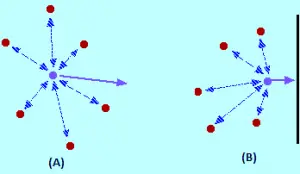
A molécula continuará movéndose na mesma dirección á mesma velocidade, pero cando está golpeando o recipiente, ocorre o seguinte: como non hai moléculas diante del, non se produce a cancelación de atraccións intermoleculares. Polo tanto, a molécula comeza a diminuír a súa velocidade xusto antes de bater coa parede do recipiente (imaxe b). En consecuencia, vai chocar coa parede con menos forza e menos presión.
O efecto xeral disto é o culpable que a presión é menor do que sería se o gas era ideal. Isto significa que se se coloca a presión medida na expresión PV / NRT, o valor do factor de compresión será menor que o gas é ideal. Esta é a razón pola que, baixo algunhas condicións, os gráficos dos factores de compresión están por baixo do valor ideal de 1. Vexamos de novo o exemplo de nitróxeno (se xa o sei, cansado do gráfico HAHA).

Este efecto é máis importante a baixas temperaturas. Por que? A baixas temperaturas, as moléculas móvense máis lentamente. A temperaturas máis altas, onde as moléculas móvense moito máis rápido, calquera pequeno atraso da molécula cara ao centro do gas apenas notará. A altas temperaturas, o efecto das forzas intermoleculares é certamente insignificante xa que as moléculas escapan das interaccións.
e hai un efecto final sobre as forzas intermoleculares, que está un pouco escondido. A medida que a presión aumenta, as moléculas están máis xuntas. Se están máis preto, as forzas intermoleculares serán máis importantes.
Cal é o gas máis ideal?
Debemos buscar un gas cuxas moléculas son as máis pequenas posibles, E onde as forzas intermoleculares son moi baixas. Que o gas sería helio. Unha molécula de helio ten un único átomo que é moi pequeno e as forzas de dispersión van der Waals son moi baixas.
como helio, unha molécula de hidróxeno tamén ten dous electróns, de xeito que as forzas intermoleculares van ser pequeno (pero non tan pequeno como helio). Na molécula de hidróxeno, ten dous átomos nos que pode distribuír as cargas.A medida que as moléculas se fan máis grandes, as forzas de dispersión aumentarán e pode obter outras forzas intermoleculares como as atraccións dipolo-dipolo. Os gases feitos de moléculas como estes serán moito menos ideais.
A ecuación van der waals
Hai unha gran cantidade de ecuacións que poden describir como actúan os gases reais, pero para facer lo simple, químicos unirse á furgoneta ecuación der Waals, porque é o máis doado de describir como gases actuar:
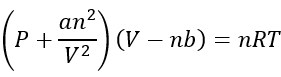
p é a presión en atmosferas (ATM)
V é o volume de litros (L)
n é o número de moles (mol)
a é só unha constante de proporcionalidade
b tamén é unha constante de proporcionalidade
Ten en conta que é moi similar á ecuación ideal de gas, pero corrixe algunhas cousas.
O lado dereito da ecuación é exactamente o mesmo que a ecuación de gas ideal. Só cambia con respecto á presión e ao volume para realizar cousas con respecto ás forzas intermoleculares e ao volume de moléculas de gas.
O lado esquerdo explica unha menor presión que a dun gas ideal, xa que ten en conta o correccións que ocorren cando as moléculas suaven o impacto das outras moléculas das interaccións intermoleculares.