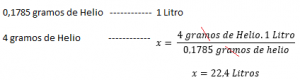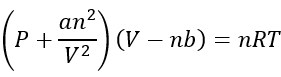« 228ec36312 »>
Bien que pour des calculs simples, nous utilisons la valeur 22,4 litres pour tous les gaz On peut voir que ce n’est pas exactement vrai. Même à des températures et de pressions normales, de vrais gaz peuvent s’écarter légèrement du comportement idéal. La déviation est beaucoup plus grande dans des conditions plus extrêmes, comme nous le verrons ci-dessous:
Facteurs de compression
pour un gaz idéal, PV = NRT. Il est rempli que lors de la division de PV / NRT = 1.
Pour des gaz réels, cela n’est possible que dans de basses pressions (moins de 5 atmosphères). L’analyse du graphique est observée que la déviation devient plus prononcée avec l’augmentation de la pression. Et augmenter la température que le gaz prend un comportement proche de l’idéal.
dans un gaz réel, car la pression augmente, le quotient entre PV / NRT augmente à un nombre supérieur à un, (PV / NRT > 1) déformer l’idéalité. Il en va de même lorsqu’une température diminue, car le facteur de compression augmente au-dessus de 1 (PV / NRT > 1) car la température approche un nombre plus petit.
Un idéal Le gaz a un facteur de compression égal à un, mais le facteur de compressibilité pour un gaz réel peut varier considérablement de ce nombre. Les graphismes ci-dessous montrent comment cela varie pour l’azote lorsque vous modifiez la température et la pression.
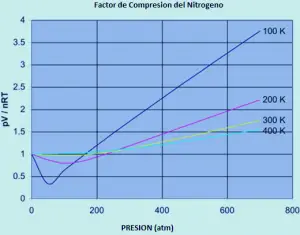
Si l’azote était un gaz idéal dans toutes les conditions de température et de pression, chacune de ces courbes serait une ligne droite horizontale qui montrerait un facteur de compression de 1. (Bien sûr, cela est évidemment vrai).
à prendre en compte
à faible pression d’environ 1 peu moins d’une atmosphère, le facteur de compression approche 1. L’azote s’approche du comportement idéal aux pressions ordinaires.
Le comportement non idéal aggrave plus bas températures. Pour des températures de 300 ou 400 K, le facteur de compression approche 1 dans une large gamme de pressions. L’azote devient plus idéal dans une plage de pression supérieure à mesure que la température augmente.
Le comportement non idéal aggrave des pressions plus élevées. Il devrait y avoir au moins un effet qui fait du rapport PV / NRT. Trop bas, surtout à basses températures. Et il devrait y avoir au moins un effet qui doit augmenter trop que la pression augmente.
est le même comportement manifesté avec d’autres gaz?
Le graphique suivant montre comment les facteurs de compression varient en fonction de la pression pour une variété de gaz à une température fixe de 273K.
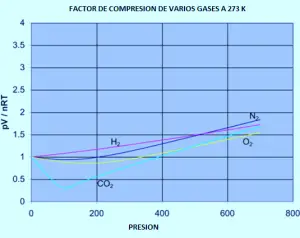
Si vous deviez refaire l’ensemble des graphiques d’azote d’origine (à des températures variables) pour l’un de ces autres gaz, vous constaterez que chacun d’entre eux produira un ensemble des courbes semblables à celles de l’azote. Ce qui varie en fonction de la température à laquelle les différentes formes graphiques sont produites. Par exemple, si le graphique de dioxyde de carbone est observé à 273 k (graphique précédent), il est similaire à celui de l’azote à 100 k du premier ensemble de courbes, bien qu’il n’augmente pas si prononcé à des pressions plus élevées.
Il est facile de dire que les gaz deviennent moins idéaux à basse température, mais ce qui a une température basse varie d’un gaz à l’autre. Plus près de la température à laquelle le gaz est converti en liquide (ou dans le cas du dioxyde de carbone, dans un solide), plus le gaz ne devient pas idéal.
Qu’est-ce qui cause le comportement non idéal ?
Dans les hypothèses que nous faisons sur les gaz idéaux, il y a deux affirmations qui disent que des choses qui ne peuvent pas être vraies d’un gaz réel, et ceux-ci ont un effet sur la pression et le volume.
Le problème du volume:
La théorie cinétique suppose que, pour un gaz idéal, le volume occupé par les molécules elles-mêmes est entièrement insignifiant par rapport au volume du conteneur. Pour un véritable gaz (réel), cette hypothèse n’est pas vraie. Les molécules elles-mêmes occupent une partie de l’espace dans le conteneur. L’espace dans le conteneur est disponible pour que les choses se déplacent moins que le volume mesuré du conteneur.
Dans l’image, la théorie cinétique suppose que tout cet espace est disponible pour que les molécules se déplacent à l’intérieur. Mais en fait, comme on le voit dans l’image (B), seule cette quantité d’espace est disponible, car le reste du volume est occupé par les molécules elles-mêmes.
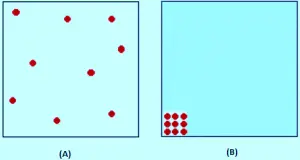
Si la pression est faible, le volume occupé par les molécules réelles est insignifiant par rapport au volume total du conteneur.Mais lorsque le gaz comprime, la proportion du volume total que les molécules occupent elles-mêmes augmentaient de plus en plus. Imaginez que vous comprimiez à la fois le gaz que les molécules se touchent. À ce point, le volume disponible de sorte que les molécules se déplacent sont zéro.
Supposons qu’à une pression élevée, le volume du conteneur est de 1000 cm3, mais supposant que les molécules occupent jusqu’à 100 cm3.
L’équation de gaz idéale a été développée en effectuant des calculs basés sur l’hypothèse des théoriciens cinétiques. Il est supposé que V en PV est le volume disponible de sorte que les molécules puissent se déplacer librement, mais dans ce cas, il ne serait que 900 cm3, pas 1000 cm3.
Si nous calculons le facteur de compression, PV / NRT, Mettre le Volume Total Conteneur dans la formule, la valeur que nous obtiendrai en conséquence sera supérieure à celle qu’il ne devrait être (car le volume réel doit être de 900 cm3).
Pour un gaz réel tel que l’azote, notifiera comment Le facteur de compression a tendance à augmenter avec la pression, tandis que pour un gaz idéal, le facteur de compression serait de 1 à toute valeur de pression.

La valeur du facteur de compression est trop élevée à des pressions élevées pour un gaz réel. La raison en est que le volume mesuré que nous utilisons dans l’expression PV / NRT est trop élevé (nous nous souvenons du cas précédent) et nous ne prenons pas en compte le volume occupé par les molécules. Cette erreur montre plus lorsque le gaz est comprimé.
Le problème de pression:
Une autre hypothèse de la théorie cinétique pour les gaz idéaux est qu’il n’y a pas de forces intermoléculaires entre les molécules. C’est faux, car dans les vrais gaz, ce n’est pas comme ça. S’il n’y avait pas de forces intermoléculaires, il serait impossible de condenser le gaz comme un liquide. Même l’hélium, qui a le moins de toutes les forces intermoléculaires, peut devenir un liquide si la température est suffisamment basse.
Quel effet les forces intermoléculaires ont-elles? Pour une molécule de gaz qui est au centre du conteneur, il n’y aura aucun effet non (image a). Les molécules attireront jusqu’à un point où ces attractions sont annulées. Les attractions exercées par la molécule au dos ont tendance à ralentir et seront annulées par les attractions des molécules devant elle, tendant à l’accélérer (les deux attractions sont annulées).
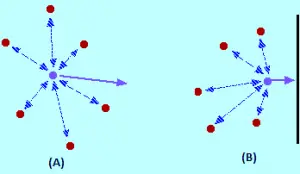
La molécule continuera de bouger dans la même direction à la même vitesse, mais lorsqu’il est en train de frapper le conteneur, les éléments suivants se produisent: comme il n’y a pas de Les molécules devant lui, l’annulation d’attractions intermoléculaires n’est pas produite. Par conséquent, la molécule commence à diminuer sa vitesse juste avant de frapper avec la paroi du conteneur (image B). Par conséquent, il entrera en collision avec le mur avec moins de force et moins de pression.
L’effet global de ceci est le coupable que la pression est inférieure à ce qu’elle serait si le gaz était idéal. Cela signifie que si la pression mesurée dans l’expression PV / NRT est placée, la valeur du facteur de compression sera inférieure à si le gaz est idéal. C’est la raison pour laquelle, dans certaines conditions, les graphiques des facteurs de compression sont inférieurs à la valeur idéale de 1. Voyons à nouveau l’exemple de l’azote (si je le sais déjà, vous êtes fatigué du graphique haha).

Cet effet est plus important à basses températures. Parce que? À des températures basses, les molécules se déplacent plus lentement. À des températures plus élevées, où les molécules se déplacent beaucoup plus rapidement, toute petite archette de la molécule vers le centre du gaz remarquera à peine. À des températures élevées, l’effet des forces intermoléculaires est certainement insignifiant car les molécules s’échappent des interactions.
et il y a un effet final concernant les forces intermoléculaires, qui est légèrement cachée. À mesure que la pression augmente, les molécules sont plus ensemble. S’ils sont plus proches, les forces intermoléculaires seront plus importantes.
Quel est le gaz le plus idéal?
Nous devrions rechercher un gaz dont les molécules sont le plus petit possible, et où les forces intermoléculaires sont très faibles. Que le gaz serait hélium. Une molécule d’hélium a un seul atome très petit et les forces de dispersion des forces de la dispersion des waals sont très basses.
Comme hélium, une molécule d’hydrogène a également deux électrons, de sorte que les forces intermoléculaires vont être petit (mais pas aussi petit que l’hélium). Dans la molécule d’hydrogène, vous avez deux atomes sur lesquels vous pouvez distribuer les charges.Comme les molécules deviennent plus grandes, les forces de dispersion augmenteront et vous pouvez obtenir d’autres forces intermoléculaires telles que les attractions dipolo-dipolaires. Les gaz faits de molécules comme ceux-là seront beaucoup moins idéaux.
L’équation Van der Waals
Il existe un grand nombre d’équations qui peuvent décrire la manière de la réalité des gaz, mais de faire Il est simple, les chimistes adhérent à l’équation van der Waals car il est le plus facile de décrire la manière dont les gaz agissent:
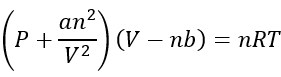
p est la pression dans les atmosphères (ATM) V est le volume en litres (L) n est le nombre de moles (mol)
A est juste une constante de proportionnalité
B est également une constante de proportionnalité
garder à l’esprit qu’il est très similaire à l’équation de gaz idéale, mais elle corrige certaines choses.
Le côté droit de l’équation est exactement la même chose que l’équation de gaz idéale. Il ne change que par rapport à la pression et au volume pour réaliser des choses en ce qui concerne les forces intermoléculaires et le volume de molécules de gaz.
sur le côté gauche explique une pression inférieure à celle d’un gaz idéal, puisqu’il prend en compte la corrections qui se produisent lorsque les molécules adoucissent l’impact des autres molécules des interactions intermoléculaires.