Présentation de l’affaire
Institut Supérieur de médecine militaire « Dr. Luis Díaz Soto »
Tumeur intracrânienne dans une femme enceinte
My. Armando Felipe Morán, 1 chap. Orlando Cruz González, 2 m et. Teresita de Jesús Montero González 3 et TTE. Maïs Leonor Pérez Riveiro4
Abstrait
Un patient est présenté pendant sa grossesse, la présence d’une tumeur cérébrale est détectée. Les caractéristiques cliniques présentées par des maux de tête, des vomissements et des crises focales sur le bras gauche avec une généralisation ultérieure, accompagnée d’une perte de force musculaire et d’un papiledema. La conduite suivie était chirurgicale avec la radiothérapie ultérieure et le cartilac par lavement. Le type histologique de la lésion Un glioblastome multiforme et l’évolution postopératoire étaient satisfaisants au démarrage, avec une période de survie d’environ 8 mois.
Descripteurs DEC: néoplasmes cérébraux; Glioblastome; Complications néoplasmiques de la grossesse.
Les tumeurs intracrâniennes constituent un chapitre aride, mais d’une importance vitale en médecine neurologique. Ils sont considérés comme l’une des conditions les plus redoutées dans le domaine de la médecine, qui par son emplacement et ses caractéristiques mènent presque toujours le patient à mort. Ces lésions intracrâniennes comprennent des néoplasmes bénins et malins, qui peuvent être développés dans le cerveau, les méninges ou le crâne.1 et cérébral tumeurs sont de 0,2 à 2,6% des admissions de l’hôpital et 10% de toutes les tumeurs de l’organisme. Ils correspondaient de 1 à 2% du défunt22 se produisent à tout âge, mais ils sont rares dans les six premiers mois de la vie; Ils sont fréquents chez les nourrissons et les enfants de moins de 10 ans un, rares chez les jeunes adultes, augmentent leur fréquence avec l’âge et son incidence maximale se manifeste dans les cinquième et sixième décennies de la vie, pour être rare à nouveau de 70 A.3-5
Le glioblastome multiforme (GM) constitue entre 12 et 15% de toutes les tumeurs intracérébrales. La gamme d’âge dans laquelle son incidence est supérieure entre 51 et 60 ans, des patients de plus de 45 ans et moins de 65 ans et extrêmement rare l’existence de cette tumeur sous des patients sous 30 A ans âgés de 30 A.6-8
La présentation de GM pendant la grossesse est une rareté, il n’y a aucun signe publié à ce sujet et dans la littérature révisée des 10%. Il n’existe aucune preuve que celles-ci se produisent par cet État, bien qu’elle ait été liée à la croissance accélérée de la méningiome et des cellules gliales malignes à ce stade avec les changements hormonaux qui se produisent. 9-11
la présence d’une grossesse avec GM constitue la base de ce rapport.
Cas clinique
Gestant 24 Une vieille et 35 semaines de grossesse, envoyée au centre 1er. Avril 1999, en présentant progressivement progressivement dans l’intensité, les maux de tête sous la forme d’une subvention rebelle au traitement et saisies analgésiques. Les crises focales sur le bras gauche au début, sont devenues largement répandues et accompagnées de la vessie et de la relaxation sphincter anal. Il avait également un « engourdissement » du bras et de la jambe gauche, avec une perte de force musculaire et de déviation de la commissure labiale vers le côté non affecté et des vomissements occasionnels non liés à l’ingestion alimentaire.
Entre l’arrière-plan, la présence de crises focales est collectée à 12 semaines de gestation sur le bras gauche chez un patient avec un fond de santé, qui n’étaient pas étudiés et disparaissent avec le traitement de la carbamazépine.
L’examen physique est la présence d’une hémiparesie directe modérée, totale et directe avec une prédominance du bras gauche, sans signe de babinski ou de participation sensible. Pour ces raisons, le patient n’a pas tenu debout et regarda au lit. Dans le fond des yeux, un papiledema a été observé sans exsudates ni hémorréges.
Les études complémentaires suivantes ont été effectuées:
- Tomographie informatique simple et contrastée (TC): 5,5 ou 5,6 cm de diamètre de diamètre a été observé dans un front arrière droit Région accompagnée de signes marqués d’œdème cérébral et de déplacement de la ligne moyenne de 1,3 cm, avec capture de contraste modérée et centre hypodense sans définition des bords ou de la capsule (Figs 1 et 2).
- rayons X de la crâne dans l’anteropostéorateur et vues latérales: Normal.
- Electroencéphalogramme (EEG): Signes d’irritation FOCAL Frontoparietys Droits.
- Ultrasons gynécologique: Présentation céphalique, DBP 85, FEMUR 65, Fluide amniotique normal, Treate de coeur actuel Présent, placenta précédent sans signes de maturité.
- Élimination: 60 mm.
- Autres études Avec des résultats dans les limites normales: hémogramme avec différentielle, glycémie, créatinine, acide urique, urée, protéines totale, ionogramme, gasométrie, osmolarité de plasma, coagulogramme, sérologie, VIH, tests fonctionnels hépatiques, électrocardiogramme et radiographie de la poitrine.

Fig. 1. Offre de tumeur hypodense entourée d’œdème cérébral.
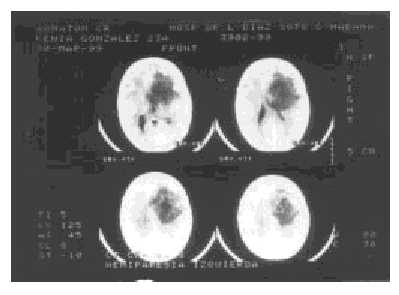
Fig. 2. Coupes tomographiques à différents niveaux du cerveau où l’ampleur de la blessure est appréciée.
est évalué entre les services de la neurochirurgie, de la gynécologie et de l’anesthésie, il est décidé Pour imposer un traitement immédiatement avec le betnazole avec les objectifs de réduction de l’œdème cérébral et induisant la maturité pulmonaire du fœtus.
La conclusion est conclue de l’exécution d’interventions chirurgicales à 2 reprises, c’est-à-dire d’abord soumettre le patient au césarien et a une fois récupéré le patient de cette procédure le soumettre à une intervention crânienne. De plus, la dose d’anticonvulsivants a été augmentée et 20% de mannitol a été ajouté.
Au cinquième jour du début de l’utilisation de stéroïdes, une section césarienne a été réalisée. Le patient s’est poursuivi sous surveillance étroite pour agir immédiatement en cas de décompensation neurologique.
Lorsque vous quittez la pièce, il est maintenu avec un traitement de mannitol, dilantin, furosémide, betnazole, pénicilline cristalline, amikacine et ergonovina.
Le patient évolue favorablement les 5 premiers D, à la sixième table fébrile, associée à la contamination possible du centre, il est donc éliminé et canalisé du côté opposé. Le septième jour, le patient se lève avec désorientation et grada prend conscience. L’anisocorie apparaît au milieu de la midriose droite, il a donc été conduit à une urgence à la salle d’opération.
La cranotomie frontale droite est effectuée, après l’ouverture du Duramadeur, il s’agit d’électrocoagula croûte au niveau de la partie ultérieure du second circonvolution frontal et lorsque la ponctuation d’un liquide est évacuée dans la direction de la lésion beige dans environ 5 cc. Par corticotomie à ce niveau, la blessure grise est atteinte, non bien délimitée, avec des portions plus solides et d’autres friables plus aspirables et avec certaines zones de nécrose. Résection sous-total d’environ 80%. Diagnostic histologique: glioblastome multiforme.
Après intervention, le patient passe à une thérapie intensive et reste intubée 24 h; En évoluant le traitement anti-diadema cérébral favorablement, on diminue progressivement et se retire au septième jour, à l’exception des stéroïdes qui ont été maintenus pendant 2 semaines.
Le patient reçoit un traitement avec une radiothérapie photon de 6 000 rads accompagnés de cartilac par lavement. Pendant la radiothérapie, il restait des stéroïdes.
est resté asymptomatique pendant environ 7 mois, lorsqu’il recommence avec des crises, une perte de force dans l’hémiturus gauche et une cèvey frontalopoparie intense. L’examen physique est atteint une hémiparesie gauche totale et directe, avec une prédominance brachiale et une papiledema bilatérale de qualité I. Dans TC, la présence d’une image avec caractéristique similaire à celle du précédent est détectée à nouveau, à l’exception de la présence d’images croisées profondément effrayantes avec extension des lobes. temporaire et pariétal avec un œdème marqué.
Il est intervenu chirurgicalement avec l’ouverture de la craniotomie antérieure, l’évacuation des lésions kystiques et une vaste résection de la lésion tumorale d’environ 90%.
Le patient est donné jusqu’au dixième jour de son intervention sans maux de tête, ni saisies, mais avec le défaut de moteur initial, avec le traitement de la carbamazépine et du dexamétazone.
retourne au centre à 24 D de fonctionnement en présentant à nouveau des convulsions, oppresseur oppressant intense Cefalea, accompagnée de vomissements. Dans l’étude évolutive de TC, l’extension de la blessure à presque tous l’hémisphère droit est observée. La famille n’est pas d’accord avec une nouvelle intervention chirurgicale, de sorte qu’il ne se soumet pas.
Le patient meurt 2 semaines plus tard.
Dans l’autopsie a été trouvé de manière macroscopique, grise et infiltrante, mal délimitée qui s’étend à l’hémisphère cérébral droit droit, avec des zones rigides et blanchâtres et allumées et jaunâtres (figures 3 et 4).Microscopiquement, il y avait une densité cellulaire élevée avec du pléomorphisme, de la nécrose et de la prolifération vasculaire, de cellules qui procèdent à une lumière vasculaire pour constituer des corps gloméruloïdes. La nécrose était comme une serpentine et des cellules tumorales atypiques regroupées le long des régions nécrotiques avec un aspect pseudoppalisé.
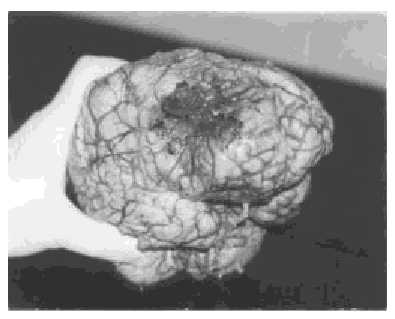
fig.3. Remarque Zone chirurgicale et infiltration de la tumeur.
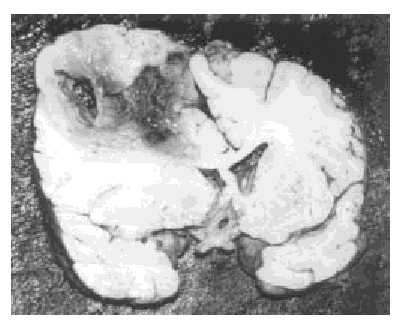
Le temps total de l’évolution était:
- depuis son apparition à 12 semaines de gestation: 426 D, 14 mois.
- Depuis sa première opération neurochirurgicale jusqu’à sa mort: 253 D, quelque chose de plus de 8 mois.
Commentaires
La présence de tumeur cérébrale pendant la grossesse est un fait dramatique. Quand décider de l’intervention chirurgicale et de quel type d’intervention à exécuter est une question non encore résolue, car les tentatives ont été apportées, 11 rapports sont des cas isolés et des révisions de nombreuses années, le nombre de patients est faible et l’histologie des tumeurs équilibrées varie. .11-15
Le patient a été présenté avec une durée du fœtus, la décision n’était donc pas difficile. Il a fallu du temps pour induire une maturité pulmonaire du fœtus et la bonne condition du patient le permettait. La décision de faire la section césarienne puis de l’intervention neurochirurgicale a été prise fondamentalement en raison de 4 facteurs:
- bonne condition générale du patient.
- de la magnitude des deux interventions chirurgicales.
- L’intervention anesthésique neurochirurgicale devrait être basée sur une induction et une maintenance lentes et ultérieures, tandis que la césarienne demande une induction rapide avec une utilisation minimale d’anesthésiques.
- changements hormonaux qui se produisent plus tard que le Parto o Cearing, que chez le patient entraverait son évolution postopératoire, au cas où il sera soumis aux deux interventions simultanément.
GMS sont présentés plus fréquemment chez les hommes, âgés de 45 à 65 ans, mais ils sont également plus fréquents dans l’hémisphère gauche, les résultats qui ne coïncident pas avec la présence de la blessure du patient.6-8 La présentation clinique initiale du patient n’est pas la plus fréquente rapportée dans la littérature mondiale. Lorsque les pourcentages les plus élevés concernaient des maux de tête (73%), une hémiparéèse (70%), un papiledema (60%) et des troubles mentaux (57%). 16,17
du point de vue technique des patients atteints d’exercice total de macroscopie Signaler chirurgical Une période de vie plus longue et viennent vivre entre 6 mois à 2 A par rapport à ceux qui n’étaient appliqués que par la biopsie, mais il n’est pas moins vrai que des dommages secondaires plus élevés peuvent survenir par rapport aux procédures moins invasives.6 Certains auteurs tels que Kreth et autres18 recommandent la biopsie suivie d’une radiothérapie, sans prendre en compte la résection chirurgicale. Il a été décidé chez le patient d’effectuer une résection aussi large que possible, mais sans endommager la zone de moteur compromise, afin de proposer une vie postopératoire aussi complète que possible et de suivre son traitement ultérieur avec une radiothérapie et un cartilac.
Au moment de la survie des malades avec ces lésions, les résultats sont décrits entre 6 mois et 12 A, lorsque la résection chirurgicale et la radiothérapie, étant moins que d’autres types de combinaisons thérapeutiques.6-8, 19 la Le cas présenté a reçu ce type de traitement et trouvé dans la plage de temps indiquée.
La fille du patient grandit et se développe dans des limites normales pour son âge et sans présenter aucun type de troubles.
Résumé
Cet article présente au patient qui a été détecté la tumeur pendant sa grossesse. Les caractéristiques cliniques étaient des maux de tête, des vomissements, des crises focales dans son bras gauche, avec une généralisation supplémentaire, accompagnée d’une perte de force musculaire et de papier. Procédures chirurgicales, suivies d’autres radiothérés et administration de Cartilac par lavement. Le type histologique de lésion était au glioblastome multiforme et à la récupération de postulerie était satisfaisant au début, avec une période de survie de huit mois d’approbation.
Rubriques sur le sujet: néoplasmes cérébraux; Glioblastome; Complications de grossesse, néoplastique.
Références bibliographiques
- Lieberman A, JJ Ransohoff J. Traitement des tumeurs cérébrales primaires. Acta Neurol 1982; 6: 47-9.
- Casanova P. Diagnostic par image. Dans: Compendium de radiologie clinique.Mexique, DF: interaméricains; 1980: 686-702.
- Morris JH, Phil D. Le système nerveux central: tumeurs. Dans: Robbins. Pathologie structurelle et fonctionnelle. 4 Ed. Madrid: Interaméricain, Mc Graw Hill; 1990: 1486-95.
- Fishman Ra. Tumeurs intracrâniennes et états qui augmentent la pression intracrânienne. Dans: Cecil nous. Traité de médecine interne. 15 ed La Havane: Les éditoriaux et l’éducation; 1984: 1033-44.
- PEDRO PONS A. Pathologie et cliniques médicales. Barcelone: Salvat; 1969: 663-775.
- TATTERS SB, WILLSON CB, Harshiv GR. Tumeurs neuroépithéliales du cerveau adulte. Dans: Julian. Ry. Chirurgie neurologique. 4 Ed. WB Saunders; 1996: 2612-84.
- Weiss RG. Tumeurs du système nerveux central. Dans: Geoffrey RW. Oncologie clinique 2 Ed. Mexique DF; Le manuel moderne; 1977: 541-610.
- Obwegeser A. Ortler M, Seiwald M, Ulmen H, Kostron H. Thérapie du glioblastome multiforme: Expérience cumulative de 10 ans. ACTA NEUROCIRC (Wien) 1995; 137: 29-33.
- Carroll Rs, Zhang JM, Dashner KB, SAR M, Noir PMCL. Activation des récepteurs de la progestérone et des glucocorticoïdes chez les méningiomes. Neurochirurgie 1995; 37: 92-7.
- Carroll Rs, Zhang JM, Dashner KB, SAR M, Noir PMCL. Récepteurs hormonaux stéroïdes dans les néoplasmes astrocytiques. Neurochirurgie 1995; 37: 37: 496-504.
- Island A, Álvarez F, González A, García Ga, Pérez am, García Bm. Tumeur cérébrale et grossesse. Obétte Gynecol 1977; 89 (1): 19-22.
- Zukiel R, Jankowski R, Nowak S. Neoplasmes cérébraux pendant la grossesse. Deux histoires de cas. Ginekol Pol 1994; 65 (3): 153-6.
- Sneed Pk, Albright Nw, Wara Wm, MD Meadows, Wilson CB. Dose fœtale estime à la radiothérapie des tumeurs cérébrales pendant la grossesse. Int J Radiat Oncol Biol Phys, 1995; 32 (3): 823-30.
- Juarez AA, Villareal PC, Dorian GI, Chen FJ, Magaña CG. Méningiome pendant la grossesse. Rapport d’une affaire et d’examen de la littérature. Gynecol Obette Mex 1995; 63: 349-51.
- Korula g, farfal P. Gestion anesthésique pour une section césarienne combinée et craniectomie de Fossa arrière. J Neurosurg anesthésiol 1998; 10 (1): 30-3.
- McKenan Ro, Romas DG, EDS. L’étude clinique des gliomes. Brian Tumeurs: Bons scientifiques, recherche clinique et thérapie actuelle. Boston: Butherworth; 1980; 194-230.
- Pigoh TJD, Lowe JS, Palmer J. Modélisation statistique dans l’analyse du glioblastome multiforme. Une étude de la variable clinique et de l’immunoréactif K1-67. BR J Neurosurg 1991; 5: 61-6.
- Kreth FW, Warnke PC, SCHEREMENT R. RÉSECTION CHIRURÉ ET THÉRIOGIE DE LA RADIATION VERSUS DE BIOPSIE ET DE LA RADIATION DANS LE TRAITEMENT DE GLIOBLASTONOM MULTIFORME. J Neurosurg 1993; 78: 762-6.
- Obweespez A, Ortler M, Seiwald M, Ulmen H, Kostron H. Thérapie du glioblastome multiforme: expérience cumulative de 10 ans. ACTA Neurocirc (Wien) 1995; 137: 29-33.
reçu: 26 mai 2000. Approuvé: le 30 juin 2000.
My. Armando Felipe Morán. Institut Supérieur de médecine militaire « Dr. Luis Díaz Soto ». Monumental Avenue, Havane del Este, CP 11700, Ville de La Havane, Cuba.
1 spécialiste de I grade en neurochirurgie. Enseignant assistant.
2 Spécialiste de I grade en neurochirurgie.
3 Spécialiste de I grade en anatomie pathologique. Enseignant assistant.
4 Spécialiste de I GRADE EN GYNECOOBSTÉTRICHES. Enseignant assistant.