Introducere
Scleroza laterală amiotrofică (ELA) are ca o caracteristică principală pierderea selectivă a neuronilor motori în creier, trunchi cerebral și măduva spinării1. Majoritatea cazurilor ELA sunt sporadice, dar aproximativ 10% dintre pacienți au un istoric familial2, iar acești pacienți, 20% au mutații în dezmutatase1 (SOD1) 3 CU2 + / ZN2 + Superoxid1 (SOD1) 3. În plus, TDP-43 și proteina / TL-urile figurilor ar putea fi asociate la pacienții cu o familie de familie și sporadică, iar cel mai mare procent de cazuri a fost legat de o expansiune intronatată a unei repetări GGGGCC de hexanucleotidă în gena C9ORF726 .
Mecanismul prin care neuronii motorului devin selectiv vulnerabili și mor la pacienții cu Ela este încă necunoscut. Modelul progresiei clinice găsite în șoarecii transgenici mutanți ar putea indica faptul că boala se răspândește centrifugal de la o regiune afectată într-o zonă adiacentă; Prin urmare, s-ar putea specula că produsele toxice generate într-o zonă difuzează leziunea, afectată de neuroni adiacenți și astfel răspândind boala și o posibilitate este ca acești factori să poată fi vehicule prin lichidul cefalorahidian (LCR) 7. Această ipoteză a determinat mai mulți cercetători pentru a dezvolta experimente pentru a investiga dacă incubarea in vitro în culturile neuronale și liniile celulare neuronale cu CSF de pacienți cu ELA (ELA-LCR) ar putea provoca daune celulare, care a fost confirmată la majoritatea studiilor7-22 ca revizuire , deși nu la toate23. Grupul nostru a stabilit că ELA-LCR afectează viabilitatea neuronilor motorului cortical al creierului de șobolan menținute în culturile primare; Cu toate acestea, acest efect pare a fi mediat de un mecanism de glutamat independent, deși ELA-LCR a cauzat o înălțime a concentrației de bază a citozei CA2 + () a neuronilor motorului24,25. Aceste date susțin prezența factorului (factorii) toxici în ELA-LC (i) responsabilă pentru a provoca deteriorarea neuronilor motori în experimente in vitro, dar este posibil ca nu la toți pacienții sau în toate fazele bolii26. Întrebarea este dacă ELA-LCR ar putea provoca, de asemenea, deteriorarea creierului in vivo. De fapt, injecția acută intratecală sau intracerebroventriculară a ELA-LCR produce modificări ale activității neuronale, în exprimarea receptorilor de glutamat și a canalelor de ioni, în fosforilarea proteinei după numai a 2-a după injecție27-29 o induce modificări mitocondriale, stres oxidativ sau disfuncție lizozomală30.
Aceste experimente produse cu injecții punctuale nu imită cursul temporar al ELA și, prin urmare, nu îl reproduce. Prin urmare, părea adecvat să se efectueze experimentele pe care le vom descrie aici: examinarea schimbărilor histopatologice și funcționale ale creierului care apar după perfuzia continuă a ELA-LCR timp de 20 sau 43dias, obținută prin utilizarea unui minibump conectat la Ventricul cerebral de șobolan printr-o canulă, pentru a determina consecințele celei mai prelungite expuneri ale citotoxicului ELA. Deși nu găsim schimbări funcționale asemănătoare cu ELA, găsim o expresie mai rapidă a moleculelor de semnalizare neuroprotector, o reacție anticipată de neuroinflamatorie însoțită de microglia activată și astrogliză, precum și o supraexprimare a proteinelor citoplasmatice legate de ELA ca TDP-43, Cystatinac și Transferină extras între 1,5 și 3cc de fiecare pacient, centrifugată la 1.500rpm în timpul 10minului și împărțită în 4 până la 5 alicote în scopuri de studiu. A fost obținut un consimțământ informat al fiecărui pacient. Șaisprezece pacienți au fost femei; Vârsta medie a seriei a fost de 59 de ani în momentul extracției LCR. Patru pacienți aveau familia și restul au fost sporadice; 11 cazuri au fost prezentate ca o formă de aspect bulbar, 20 de cazuri au suferit tipul coloanei vertebrale, iar un pacient prezintă simptome în ambele locuri. Dintre pacienții cu ELA, doar 4 mutații prezentate în gena SOD1 și unul a fost asimptomatic, ceea ce înseamnă că CSF-ul pacienților cu un mecanism de genetica SOD1 a avut o prezență foarte scăzută în grupul ELA-LCR.Douăzeci de probe (68,7%) au arătat o citotoxicitate semnificativă (CELA-LCR) utilizând metoda descrisă mai jos. Probele LCR utilizate ca martori (NO-ELA LCR) au fost obținute de la pacienții care suferă de cefalee sau de convulsii și perforarea lombară necesară în timpul unei examinări de rutină. A fost obținut și un consimțământ informat al controalelor. Probele LCR au rămas înghețate la -80 ° C până când au fost utilizate.
Pentru a demonstra citotoxicitatea, culturile celulare neuronale in vitro, așa cum a fost descris anterior24. Pentru aceste experimente, neuronii au fost obținuți din motocicleta creierului embrionilor de șobolani vechi de 20 de zile. Celulele obținute au fost însămânțate la o densitate de 105 tocuri / ml în plăci de 48 de godeuri conținând 0,25 ml de mediu neurobazal suplimentat cu B-27 și cultivate timp de 8-10 zile. După acest timp, culturile au fost incubate timp de 24 ore, cu 10% ELA-LCR și viabilitatea neuronilor a fost măsurată cu teste MTT32. ELA-LCR a reușit animalele a fost preparat prin împărțirea flacoanelor LCR care au prezentat efecte citotoxice in vitro (cel puțin 20% pierderea neuronilor motori) și cele mai multe CSF incluse în acest grup au fost luate de pacienți cu ELO sporadice. Probele de control LCR pentru netoxic de 3 pacienți au fost luate în considerare înainte de administrare ICV.
Animalele
Animalele au fost manipulate în conformitate cu principiile îngrijirii animalelor de laborator publicate de Comitetul de etică spaniolă (RD 1201/2005) și Directiva Europeană 86/609 / CEE; Procedura a fost aprobată de Comitetul de etică pentru îngrijirea și utilizarea animalelor de cercetare la Spitalul Clinic San Carlos de Madrid, Spania. Cei 28 de șobolani Wistar Albinas au fost obținuți de la Laboratoarele River Charles. Toate animalele au fost adăpostite sub un ciclu de 12 ore / întuneric, cu acces liber la alimente și apă. Acestea au fost întemeiate individual în condiții de colonii standard la spitalul clinic al spitalului din zonă San Carlos. Grupul LCR a fost administrat șobolanilor în 4 perioade. În prima perioadă, au fost injectate 14 șobolani între 1 și 5 luni (media de 3,25me) și în a doua perioadă, 12 șobolani între 2,5 și 5 luni (media de 4,1 luni) cu LCR descris mai sus. Intervalul dintre cele 4 perioade a fost de aproximativ 3 luni.
Grupuri experimentale
Trei grupuri experimentale au fost proiectate pentru acest studiu. Grupul1 a inclus 9 șobolani la care au fost implementate minibumps ICV plini de pacienți non-Ela (NO-ELA-LCR). Grupul2 a fost compus din 15 șobolani implantați ICV cu minibumps citotoxic Ela-LCR (CELA-LCR). În cele din urmă, 4 șobolani implantați ICV cu minibumps plini de salină fiziologică au format grupul 3 (grupul de tratament simulat sau SHAM).
Administrarea intrarecestrică a CELA-LCR sau NO-ELA-LCR
șobolanii au fost anesteziați cu tribrometanol și Un minibump osmotic (0,15 l / h, Alzet 2006, Alzet Palo Alto, CA, SUA) a fost implementat prin subcutanat. Introduceți scapulele. Înainte de implant, minibumpurile osmotice au fost umplute cu preparatul corespunzător pentru fiecare grup experimental. Minibumps-ul au fost atașați la o canulă de perfuzie a creierului (Alzet) printr-un tub de polietilenă și sunt preparate prin imersie în soluție salină normală la 37 ° C timp de 24 ore. Aceste proceduri au fost efectuate în condiții sterile. Canulula a fost implantată în ventriculul cerebral lateral drept (-0,5mm anteroposteror, -1.4mm lateral și -3.3mm dorsoventral (coordonate bazate pe ATLAS Paxinos) 33 și au fost fixate pe craniu cu ciment dentar.
P > Volumul rezervorului pompelor asigură pomparea cel puțin în timpul a 42 de zile. LCR a fost injectat intrathec la o viteză de 0,15 l / h pentru o perioadă de 43, cu excepția șobolanilor sacrificați până la data de 20. Animalele rămase în studiul care au rămas Până în ziua 82 au fost implantate cu un tub de polietilenă sigilat mecanic pentru a preveni iritarea locală datorită atracției continue a apei la pompă.
Evaluări clinice
Animalele au fost testate clinic la mai puțin o zi pe săptămână de la o săptămână după operație. Toate testele au fost efectuate cu examinatorii orbi către grupul experimental la care aparțineau fiecare șobolan. Evaluările studiului au inclus măsurarea greutății corporale, răspunsul la testul de plan înclinat și la scala motorului Matsumoto34. Pentru a măsura greutatea corporală, animalele au fost cântărite la fiecare sezon cu o scară digitală.Pentru testul planului înclinat, 20 de șobolani au fost plasați lateral pe arborele lung al planului înclinat pentru a măsura unghiul maxim în care își putea menține poziția în plan pentru 5S. Pentru a evalua puterea ambelor extremități, animalele au fost așezate pe planul înclinat cu partea dreaptă a corpului împotriva părții descendente a suprafeței înclinate, apoi cu partea stângă a corpului care merge în jos. Un scor mai mic de 70? În testul avion înclinat, se corelează bine cu apariția slăbiciunii musculare în șoarecii transgenici SOD1-G93A34. Pentru a determina scala motorului Matsumoto34, capacitatea animalelor de la îndreptarea lor a fost testată în cei 30 de ani de a fi manipulați pe ambele părți (reflexia îndreptării). Șobolanii care erau capabili de îndreptare de pe ambele părți au fost examinate pentru capacitatea lor de a rămâne în cutia de locuințe spontan în timpul a 1 min. Dacă au arătat puțină mișcare în cuștile lor, s-au mutat într-o altă cușcă pentru a activa motivația de explorare. Dacă șobolanii nu au arătat anomalii conform acestor evaluări, au fost examinate cu atenție pentru a vedea dacă au avut deficite funcționale observabile, cum ar fi paralizia extremităților sau simptomelor de slăbiciune musculară generală în câmpul deschis. Un scor de 5 înseamnă că animalul este normal și un scor de 0 este un șobolan complet paralizat. Schema motorului lui Matsumoto sa dovedit a fi corelată cu pierderea neuronilor motor spinali într-un model de șoarece transgenic mutant de SOD1-G93A34
examen electromiografic
o electromiogramă a șobolanilor CLA-LCR și a șobolanilor non-Ela efectuate pe zi 82 de către un neurolog expert în această tehnică. Acul a fost introdus în extremitățile din față și din spate și în mușchii paravertebrali pentru a încerca să găsească semne de deervăție ca activitate de inserție spontană (valuri pozitive, fibrilații sau fasciculințe). Șobolanii au fost sedați cu izofluran la 1,5% în oxigen 0,7L / min în timpul procedurii.
sacrificiul animalelor
la 20, 45 sau 82 de zile după operație Șobolanii fiecărui grup au fost profund anesteziați cu o doză de pentobarbital (60 mg / kg) și fentanil (0,3 mg / kg). În primul rând, 10 pl de vopsea albastră Evans au fost injectați printr-un cateter ventricular pentru a confirma locația corectă. Animalele au fost sacrificate prin perfuzie intradiacică cu soluție salină 0,9% urmată de paraformaldehidă la 4% tampon (tampon fosfat de 0,1 M). După perfuzie, creierul și măduva spinării au fost disecate, spălate cu 0,1 m Pb și crioproted prin imersie la zaharoză 30% și compus octombrie. Materialul a fost păstrat la -80 ° C până la utilizare. Au fost tăiate crisoscione (50μm) ale cortexului motorului și segmentele de col uterin și lombare ale măduvei spinării (C5-C6 și L3-L5); Cuturile au fost plasate într-o soluție de crioprotecție conținând etilenglicol și dimetilsulfoxid și este utilizat pentru conservarea țesuturilor cerebrale. Dintre cei 9 șobolani din grupul non-Ela-LCR, unul a fost sacrificat până la 20, 7 până la 45 de zile și o zi 82. Din cei 15 șobolani din grupul CELA-LCR, 4 au fost sacrificați până la 20, 7 a Ziua 45 și 6 pe zi 82 după implantare. În cele din urmă, a celor 4 șobolani din grupul de tratament simulat, unul a fost sacrificat pe 20, 2 până la cele 45 de zile și unul la 82 de zile.
Analiza histochimiei și a imunofluorescenței
4 tăieturi de imunofluorescență a fost spălate cu PBS, permeabilizat cu 0,1% Triton X-100 și blocat cu ser de capră normal de 10%. Următorii anticorpi primari au fost apoi aplicați peste noapte la 4 ° C: anti-periferină (1: 200, millipor, ab 9282); anti-S100B (1: 200, millipor, 04-1054); Anti-caspase-3 (1: 200, Millipore, 04-1090); Acid fibrilar anti-proteine (GFAP) (1: 500, dakociatomatie, z0334); Anti-GTL1 (1: 200, millipor, AB 1783); Anti-Gfap (1: 600, Millipore, MAB360); Anti-TARDBP (1: 200, ABCAM, AB42474); Anti-ubiquitin (1: 100, ABCAM AB7780); Anti-Transferrin-R (1: 200, ABCAM, AB22391); Anti-colin acetiltransferază (1: 100, ABCAM, AB68779); Anti-metallothioneină (1: 100, ABCAM, AB12228); Anti-stefin (1: 100, ABCAM, AB68290); Anti-MHC II (1: 500, ABCAM, AB6403); Anti-IbA-I (1: 1.000, WAKO, de la 019-19741); Anti Panakt (semnalizare celulară 2920S) și anti Fosfoakt (semnalizare celulară 4060). Diapozitivele au fost spălate în PBS 3veces, iar anticorpii primari au fost testați cu CY3 (1: 1.000, Jackson) sau cu anticorpi secundari conjugați Alexa 488, 555 sau 647 (1: 500, Invitrogen). Secțiunile 3VECES au fost spălate în PBS, în contrast cu DAPI și montate cu reactivul Fluorsave (Calbiochem).
Cuantificarea datelor imunohistochimice
Imaginile fluorescente au fost achiziționate cu un microscop confocal Olympus AF1000.Un studiu imunohistochimic descriptiv a fost realizat în cele 3 perioade de timp stabilite, o analiză a modificărilor observate în markerii imunohistochimici în timp și compararea între grupurile de control și Ela-LCR. Analizele histologice au examinat zonele strâns legate de ELA, în special cortexul motor, bulbul spinal și segmentele spinării C5-C6 și L3-L5.
GFAP, IBA1, CASPASE-3 ȘI MHC-II
Imaginile confocale au fost achiziționate cu aceeași configurație și distribuție a fluorescenței utilizând software-ul Olympus Confocal (Olympus FlooView FV1000). Analiza cantitativă a fost efectuată utilizând versiunea 1.42q din software-ul de analiză ImageJ (SUA). Numărul de celule imunohistochimice pozitive a fost numărat prin administrarea aleatorie a fiecărei zone analizate de la 3 la 4 secțiuni diferite ale creierului coronal.
periferină, s100b, panakt, fosfoakt și măsurarea metalotionein
pentru măsurarea s100b, panakt , Fosfoakt, Metalotionein și Periferina, a fost urmată o versiune modificată a metodei fizice disector descrisă de Reed, folosind principiul cărămizii imparțiale a disectorului 3D35. Analiza a fost efectuată prin măsurători ale densității optice (procesarea imaginii binare a alb-negru), obținând procentajul zonei câmpului analizat. 8 zone pe animale aleatorii au fost selectate de un experimentator orb utilizând software-ul ImageJ 1.42 (NIH).
Analiza statistică
Datele au fost procesate utilizând software-ul GraphPad Prism 5. Acestea au fost raportate ca valori medii ± standard eroare de media (SEM). Grafica rezultatelor au fost efectuate utilizând același program. Criteriul de semnificație statistică a fost p
0,05. Toate animalele au supraviețuit implantului ICV din minibumpul osmotic și nici unul dintre ele nu a prezentat semne de infecție (abces, edem sau descărcare purulentă în implant); Nimeni nu a suferit convulsii, agresiuni, piloerecție sau prospect. Infuzia a fost făcută în timpul a 20 sau 43 dediții, iar durata temporară a efectelor LCR sau perfuzia de soluție salină a fost evaluată la 20, 45 și 82 de zile după implantarea pompei mini-emotice. Evaluări clinice și electromiografice
Nu s-au găsit diferențe semnificative între șobolanii grupului CELA-LCR și celelalte grupuri din oricare dintre evaluările clinice, inclusiv greutatea corporală, comportamentul în timpul testului planului înclinat și scalelor matsumoto, care erau normale. În ceea ce privește electromagramele, undele acute au fost găsite pozitive la extremitățile din spate, la extremitățile frontale și la mușchii paravertebrali fără fibrilație sau fasciculare potențială la 6 șobolani ai grupării CELA-LCR la 82DIAS după implant, care nu a apărut în Controale, deși nu a fost observat un model de deranjare.
activarea microglială și exprimarea GFAP, S100B, GLT1 și Caspase-3
a fost evidentă lucioasă, activarea microglială și expresia caspazei-3 în coaja motorului cele 3 grupuri experimentale până la 20 de zile după implantare. Aceste constatări ar putea fi atribuite unui răspuns inflamator secundar intervenției chirurgicale. Cu toate acestea, 45 de zile după intervenție chirurgicală, a existat o creștere semnificativă a reactivității gliale și a răspunsului microglial în toate regiunile din grupul CELA-LCR (figurile 1 și 2). În segmentele măduvei spinării animalelor care au primit CELA-LCR, sa observat că unii motorionuroni au fost înfășurați de celulele microgliale. Cuantificarea imunohistochimică a markerului IB-1 a evidențiat modificări ale morfologiei microgliilor, trecând dintr-o stare de odihnă caracterizată de un microglial SOM cu procese fine și ramificate la un microglia activat cu ramificații limitate. Corpurile celulare alungite au fost observate cu procese lungi și mai groase până la 20 de ani după implant, în timp ce celulele amooid au fost găsite cu corpuri rotunde cu procese scurte, groase și robuste la 45 și 82 de zile, indicând o activare a celulelor fagocitare în apropierea motorului neuroni. Aceste celule exprimă MHC-II, care marchează fazele inflamatorii. În grupurile de tratament simulate și non-Ela-LCR, expresia MHC-II a fost de 3 ori mai mică decât cea observată în grupul CELA-LCR (Figura 3). Un punct interesant a fost expresia puternică a astrocitelor și descoperirea astrochinelor hipertrofice care au supraexprimat GFAP în vecinătatea neuronilor motorului cortical și a măduvei spinării. Au fost observate modificări mai pronunțate la 45 de zile după operație. A existat și o expresie a MHC-II, dar la niveluri mai scăzute, în cele 82 de zile (figura 3). Contrar datelor observate în grupul CELA-LCR, se constată o scădere a expresiei GFAP și Caspazei-3 în celelalte 4 grupe, inclusiv cele 82 de zile după intervenția chirurgicală.De asemenea, a fost observată o ușoară creștere a expresiei transportorului GTL1 glutamat, care a fost legată de ELA, iar expresia sa este modificată de ELA-LCR36. GTL1 a fost găsit în vecinătatea neuronilor motorici spinali ai grupului CELA-LCR care se corelează cu expresia GFAP ca marker de activare a astrocitelor. Supraexpresia S100B a apărut la 45 și 82 de zile în grupul CELA-LCR numai.
div>
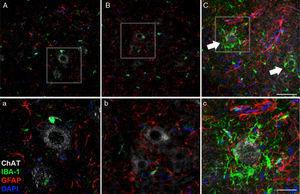
45 zile după intervenția chirurgicală, Reactivitatea crescută a glialului și răspunsul microglial în grupul CELA-LCR în toate Regiunile creierului studiate, a fost evident. De exemplu, în cornul anterior (segmentul lombar) al șobolanilor CLA-LCR, găsim o expresie mai mare a GFAP cu astrocite hipertrofice abundente (panoul C, C); În plus, a fost identificată o densitate mai mare a celulelor pozitive IB-1 cu procese mărită, adesea în imediata apropiere a neuronilor motori sau chiar în jurul acestor neuroni (săgeți în panoul C, săgețile și detaliile panoului C). Aceste modificări nu au fost observate în grupurile SHAM și non-LCR, în care celulele microglia izolate au observat ocazional în apropierea neuronilor motorului. Scară: A-C: 60μm; Detalii AC: 30μm.
(0.4MB).
Figura 2.
Imaginea de microscopie confocală a cortexului motor, exemplificând datele prezentate în tabele (momente diferite ale studiu) Creșterea celulelor IB-1 și GFAP pozitive la animalele din grupul CELA-LCR (C) este evidentă, comparativ cu grupul SHAM (A) și grupul NOLA-LCR (B). Stratul de coajă de motor 4-6, 45DIAS după operație. Scala barului: 50μm.
(0.4b).
div>
AC) Analiza cantitativă a expresiei MHC-II în diferite regiuni ale creierului și măduva spinării, în cele 3 perioade de timp studiate. Grupul CELA-LCR a arătat o creștere semnificativă a numărului de celule microgliale, care reprezintă o dovadă clară a unei etape neuroinflamatoare. D) imagine reprezentativă a celulelor pozitive pentru MHC-II în regiunea lombară. Aceste celule au fost observate, de asemenea, în vecinătatea neuronilor motori. Scară: 50 m; * p0.05; Datele sunt afișate ca medie.
(0.28MB).
Expresia lui Panakt și Fosfoakt
pentru a înțelege dacă creșterea numărului de caspaza-3 a fost însoțită de o creștere a expresiei proteinelor strâns legate de rezistența de supraviețuire și apoptoză, Cum ar fi Fosfoakt și Panakt, a fost efectuată cuantificarea sa. Practic, grupul de tratament simulat și grupul NO-ELA-LCR au arătat schimbări semnificative în cadrul studiului (20, 45 și 82 de zile).Cu toate acestea, în grupul CELA-LCR, creșteri semnificative ale lui Panakt și Fosfoakt au fost găsite la 45 de zile, cu o expresie imunohistochimică care a fost de 3 ori mai mare decât nivelurile observate în celelalte grupuri, dar la 82 de zile după intervenția chirurgicală aceste date au fost similare la grupul de tratament simulat (fig.4).

Panakt Expression (Aktpan) și Fosfoakt (Aktfosfo) în diferite regiuni ale sistemului nervos central al 3 grupe de șobolani. A) Imagini de microscopie confocală ale expresiei lui Panakt, Fosfoakt și Periferină (peririp). B) Analiza Fosfoakt și Panakt de cuantificare a densităților optice. Au fost observate expresii mai mari ale Aktpan și Fosfoakt la 45 de zile în grupul CELA-LCR (A și B). Un fenomen interesant în grupul CELA-LCR a fost creșterea expresiei periferice, fosfoakt și panakt în neuroni (A). În ziua 82 după intervenția chirurgicală, concentrațiile de AKT (PAN și FOSFO) au fost similare cu cele ale grupărilor înșelătoare și nu cu ELA-LCR, expresia sa întors la niveluri similare cu cele observate în celelalte grupuri la 82 de zile de post ( B) Chirurgie. Scară: 50μm.
div> (0.63MB).
Expresia periferină
periferina joacă un rol important în transportul axonal în neuronii motorului spinal. Recent, periferalina a fost, de asemenea, asociată cu unele neuropatologii care caracterizează ELO sporadic, deoarece se găsește în Beroway37. Prin urmare, am considerat relevante pentru a analiza perifericele din neuronii motorii, deoarece expresia sa este legată de elams sporadic. Toate secțiunile din grupul CELA-LCR au arătat neuroni motori cu expresie periferică pozitivă (Figurile 5 și 6), dar în animalele sacrificate la 45 de zile, nivelurile de 4 ori mai mari decât cele ale celorlalte grupuri și punctele de timp analizate (Fig . 6). Pe de altă parte, celulele cu cea mai mare imunoreactivitate a periferiei au fost, de asemenea, exprimate cu Panakt și Fosfoakt. Aceste celule au arătat markerul periferic cu un model filamentar, care este observat și în condiții normale; Cu toate acestea, în grupul CELA-LCR, celulele care conțin markerul periferic în incluziunile citoplasmatice, care pot fi observate, de asemenea,, care ar putea declanșa, eventual, formarea precipitaților sau incluziunilor de proteine (fig.5).
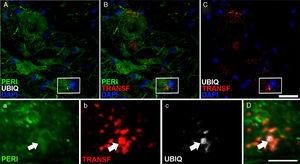
Expresia periferină (peri), ubiquitin (UBIQ) și transferină după perfuzarea CELA- LCR. La 45 și 82 de zile după intervenția chirurgicală cu tratament de încetare-LCR au arătat incluziuni în citoplasmă și au avut etichetarea pozitivă a ubiquitinului în neuroni. Includerile ubiquitin (săgeți) au fost plasate cu periferic și, ocazional, cu transferină. A-C scară: 20μm; AC și D: 2μm.
div>
(0.27MB).
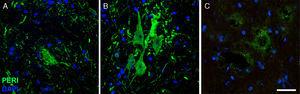
Imagini de imunofluorescență care arată expresia periferice (peri) pe parcursul studiului din grupul CELA-LCR (A: 20DIAS, B: 45 zile, C: 82 zile). O creștere temporară a perifericului a fost observată în neuronii motorului în ziua 45, care s-au întors în condiții bazale pe zi 82. Creșterea expresiei periferice a fost asociată cu evenimente de leziune coloane, în timp ce expresia este scăzută în condiții normale Scala: 40μm.
Div> co-exprimarea cystatinului C, transferină, ubiquitină și TDP-43
în grupul CELA-LCR, la 45 și 82 de zile după ce celulele chirurgicale au fost observate cu o expresie mai mare a ubiquitinului , Transferin (Fig.5) și Cistatinac. Aceste date sunt strâns legate de formele sporadice ale ELA38. Pe de altă parte, sa observat că a existat o translocație a TDP-43 în citoplasma neuronilor motorului (figura 7). Interesant, analiza imunohistochimică prin microscopie confocală a evidențiat incluziunile TDP-43, ubiquitin și cystatinac, iar aceste proteine au fost plasate în citoplasma neuronilor motorului. Creșterea acestor incluziuni la 82 de zile a fost însoțită de o scădere a expresiei periferice (figura 6).
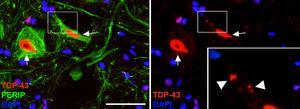
Imagini în care se observă că animalele tratate cu CELA-LCR au arătat incluziuni citoplasmatice ale TDP-43 În neuronii măduvei spinării (săgeți). În detaliu, sunt observate incluziuni (capete săgeată). Scară: 40μm.
(0.16mb).
Metalotioneii
Așa cum au sugerat că homeostazia cuprului și zincului ar putea contribui la patogeneza ELA, a fost studiată expresia metaloteionelor39.40. Expresia metalotioneinelor a fost legată de cursul temporar al schimbărilor după intervenția chirurgicală (45 și 82 de zile) și a apărut numai în grupul CELA-LCR, în care sa observat în neuronii motorului care au exprimat ubiquitin și transferină. Creșterea S100B măsurată la 45 și 85 de zile după intervenția chirurgicală a fost strâns legată de creșterea periferice în vecinătatea neuronilor motori. Celulele care exprimă S100B corespund fenotipului astrocitelor (GFAP +) de neutrofile adiacente neuronului motor. Astrocitele care exprimă S100B sunt strâns legate de echilibrul de calciu, zinc și cupru. S100B este o proteină de legare a calciului exprimată exclusiv de celulele gliale.
Discuție
Studiul de față își propune să determine consecințele administrației susținute ELA-LCR la șobolani pentru a înțelege efectele care ar putea apărea la pacienții care prezintă citotoxicitate în CSF. Acest lucru arată că perfuzia cu ICV susținută a CELA-LCR la șobolani produce schimbări cithistochimice în creier și măduvele spinării care seamănă cu cele găsite la pacienții cu Sporadic ELA. Aceste modificări nu au fost observate la șobolanii infuzați cu soluție salină sau la animalele infuzate cu NO-Ela-LCR. Infuzia a fost efectuată în 20 sau 43 de zile și țesuturile au fost analizate la 20, 45 și 82 de zile după implantarea canulei. Animalele studiului care au fost sacrificate în cele 82 de zile au primit perfuzia numai în primele 43 de zile.
Modificările relevante ale celulelor la 45 de zile au fost o activare microglială urmată de astroglioză. Activarea și proliferarea microgliilor înainte de apariția semnelor clinice sunt, de asemenea, produse la pacienții cu ELA41, precum și șoareci transgenici SOD1-G93A42. În plus, la șoareci transgenici ELA Microglia activată apare înainte de apariția pierderii neuronale43. Acest lucru este menținut în conformitate cu observația că expresia redusă a SOD1-G93A în celulele microgliale încetinește progresia bolii și prelungește supraviețuirea44. Dimpotrivă, celulele microgliale care exprimă SOD1-G93A prezintă o creștere a neurotoxicității și creșterea producției de citokine, NO și MCP-1 după activarea in vitro45. Aceste constatări susțin ideea că activarea microglia poate juca un rol relevant în dezvoltarea ELA46.47. La cei 45 de ani după implant (43 de zile de perfuzare cu ELA-LCR) găsim celulele Microglia în apropiere cu neuronii măduvei spinării.Aceste celule au arătat morfologia tipică a activării concomitente cu o expresie crescută a MHC-II, care este considerată a fi un marker al răspunsului inflamator dependent de complement4.49. Astroglioza este prezentă în mod clar, chiar dacă implicarea sa în patogeneza ELA este încă necunoscută și dacă apare înainte sau după activarea microglială. O altă descoperire notabilă a fost supraexprimarea S100B în astrocite la 45 și 82 de zile. Această proteină a fost corelată cu supraviețuirea la ELA50.51 și este reglementată în astrocite și neuroni motor ai măduvei spinării la pacienții52, precum și la șobolani infuzați în timpul lui Ela-LCR53. Astrocitele cu incluziuni sunt, de asemenea, prezente în șoareci mutanți SOD154. De asemenea, sa observat că astroglioza și supraexprimarea GFAP au apărut după activarea microglia. Acest lucru ar putea susține ideea unui mecanism de neuroinflamație ca un eveniment timpuriu în patogeneza bolii.
În ultimii ani, accentul a fost pus pe translocația citoplasmatică a TDP-43, o proteină codificată de către Gena a cărei mutații de TARDBP au fost asociate cu ELA4. Am observat că TDP-43 se găsește în incluziunile ubiquitin în ELO sporadic, dar nu în cazurile SOD1 mutate. Prezența citosolică a TDP-43, plasată cu ubiquitin, la 45 și 82 de zile în grupul CELA-LCR susține ideea că aceste schimbări sunt legate de sporadicul ELA. Acest lucru este întărit de constatările noastre că primele modificări ale neuronilor motorii au inclus supraexprimarea proteinelor cisttatinac, a transferinei și periferice, 3 care sunt strâns legate de corpurile Buni din ELA37.55.56 sporadice. De fapt, mutațiile periferice au fost deja asociate cu SPORADIC ELA57.
O altă variabilă care a fost evaluată a fost calea de semnalizare PI3K / AKT legată de supraviețuirea celulară58. Am găsit o creștere a expresiei lui Panakt și Fosfoakt pe zi 45 la șobolanii tratați cu CELA-LCR. Aceasta a fost o descoperire interesantă, având în vedere că periferina este, de asemenea, un substrat PI3K. Este demn de remarcat faptul că creșterea expresiei PI3K, dar nu akt, a fost găsită în măduva spinării la pacienții cu ELA59. Cu toate acestea, creșterea Fosfoakt a fost observată în corzile spinării de șoareci SOD1-G93A în faza de asimptomatică60. Pe de altă parte, studiile in vitro indică faptul că PI3K / AKT este modificat în celule de la șobolanii mutații SOD1-G93A61. Prin urmare, căile periferice și PI3K / AKT ar putea crește ca răspuns la stresul celular cauzat de CELA-LCR. Creșterea caspazei-3 ca semn de apoptoză la acești șobolani este compatibilă cu acest punct de vedere și cu descoperirea neuronilor motori apoptotici la ELA62-64.
ultima constatare care ar trebui menționată este Creșterea expresiei metalotioneinei la șobolani infuzați cu CELA-LCR. Acest lucru este în conformitate cu niveluri mai ridicate de niveluri mai ridicate de metalooneni în șoareci mutații SOD165-67; O creștere similară a ARNm a fost, de asemenea, descrisă în acești șoareci68. În concordanță cu aceasta, observația că la șoarecii provin din trecerea rozătoarelor cu ELA și deficitar de metalotioneină, progresia bolii68 este accelerată și că cea mai mare expresie reprezintă una mai bună. În schimb, expresia metalotioneinei și a ARNm-ului său este scăzută în ELA70. Metalotioneinele sunt proteine de legare cu CU / ZN care reduc produsele reactive de oxigen și contracara toxicitatea metalică. În acest context, căutarea unei expresii mai mari de metalotioneină ar putea însemna că o reacție neuroprotectivă este dezvoltată ca răspuns la perfuzia cronică a CELA-LCR la șobolan; Acest lucru este menținut în conformitate cu descoperirea, expresia crescută a metaloteiinului în neuronii motorului măduvei spinării de șoareci mutanți cu ELA, care încearcă să evite pierderea neuronilor și inhibă progresia bolii71.
Constatările histopatologice descrise sunt compatibile cu ipoteza pe care citotoxicitatea CSF la șobolani, au indus săptămâni de perfuzie ICV prelungită a CELA-LCR, produce schimbări într-un măduvă spinării și măduvei spinării similare cu cele ale formelor sporadice ELA. Studiul nostru arată câteva limitări. În primul rând, simptomele clinice sunt absente în cele 3 perioade studiate (20, 45 și 82 de zile). În șoarecii SOD1-G93A-ELA, primele simptome clinice apar la vârsta de 90-100 de zile72, dar rozătoarele cu alte mutații pot începe să prezinte simptome clinice38. Au fost observate anomalii timpurii, cum ar fi fragmentarea Golgi până la vârsta de vârstă 73; De asemenea, este posibil ca schimbările subtile să apară înainte de acea vârstă74. La șoareci cu mutații SOD1, primele modificări apar în măduva spinării cervicale38.Au fost observate, de asemenea, modificările în măduva spinării cervicale și lombare similare celor observate în cortexul motorului creierului, ceea ce indică faptul că efectul nociv al CELA-LCR infuzat în ventriculul cerebral sa răspândit distal la măduva spinării. Această observație este compatibilă cu ipoteza că progresia bolii ar putea fi mediată în parte prin CSF. În al doilea rând, mai mulți markeri de proteine au fost încă detectați care sunt supraexprimate la 45DIAS, deși în concentrații minore, la 82 de zile (adică periferic, GFAP, Panakt și Fosfoakt); În altele este supraexprimată în mod egal la 45 și 82 dediții (adică cisttatină, transferină, ubiquitină și translocație TDP-43), deși cu limitarea dimensiunilor eșantionului grupurilor de studiu nu au fost similare, iar numărul șobolanilor grupurilor de control a fost scăzut . Cu toate acestea, expresia anormală a acestor proteine din grupul CELA-LCR este clară și diferitele rezultate din grupurile de control confirmă faptul că modificările nu se datorează artefactelor metodei. În al treilea rând, CELA-LCR a fost infuzată de ICV pentru 43DIAS, ceea ce a fost termenul maxim pentru volumul de minibump. În ciuda faptului că CELA-LCC nu a fost administrat între ziua 43 și ziua 82, neuronii motorului apoptotic au fost observați numai la animalele examinate în ziua82. Acest lucru sugerează că procesul dăunător ar putea rămâne activ după ziua 43 și, prin urmare, este posibil ca extinderea perfuziei CELA-LCR dincolo de 43dias și / sau următorul curs temporar al bolii după 85 de zile să poată dezvălui manifestările clinice ale unui a Motor Neuron similar cu cele ale formelor sporadice ale ELA.
În concluzie, acest studiu prezintă primele consecințe ale citotoxicității LCR-Ela după săptămâni de perfuzie ICV susținută cu CSF de pacienți cu ELA, care a fost anterior dovedite că au arătat efecte citotoxice într-o cultură primară a neuronilor motorii. La 45 și 82 de zile de la începutul perfuziei, cortexul motorului, mormântul colo-lombar-lombar a arătat mai multe modificări ale markerilor tipice bolii ELA umane. Aceste constatări pot îmbunătăți înțelegerea noastră a patogenezei și a evoluției ELA și ajută la găsirea unor noi obiective terapeutice utile pentru dezvoltarea de noi compuși care întârzie sau chiar arestarea progresiei bolii.
Finanțare
Acest studiu a fost susținut Prin patru granturi acordate JMG de Mutua Madrileña, Spania, în 2008 și 2009. A fost, de asemenea, susținut de următoarele subvenții acordate companiei AGG de către instituțiile spaniole: 1) NDE07 / 09, Agenția Laín Entralgo, Comunitatea Madrid; 2) Eugenio Rodríguez Fundación Pascal; 3) Fundația Cien, Institutul de Sănătate Carlosii; 4) Renevas-retice-RD06-026, Instituto Carlosiii; 5) SAF 2010 la 21795, Ministerul Economiei și Competitivității, Spania și 6) MAT2011-28791-C03.
Conflictul de interese
Autorii declară că nu există conflicte de interese.
Mulțumiri
Autorii doresc să mulțumească colaborarea lui Pablo González și M. Cruz Rodríguez pentru coordonarea procedurilor de îngrijire a animalelor și Fundația Teófilo Hernando pentru sprijinul său continuu.