Rezumat: Trei elemente ale lanțului inflamator specific al pacienților au fost evaluate în hemodializă: LBP; IL-6 și PCR, cum ar fi markerii de inflamație și prognoză. IL-6 este un risc independent de risc de deces la pacienții cu HD, mai puternic decât PCR. Acest cel mai bun profil ca un marcator de moarte ar trebui să fie parțial, la variabilitatea sa mai mică și, în parte, să se adauge la evaluarea riscului de deces cardiovascular, PCR propriu, evaluarea riscului de deces prin infecții, asociate cu malnutriția. În clinică, PCR ar trebui să continue să fie utilizat ca marker de inflamație, deoarece este mai ușor măsurarea, dar în activitatea de cercetare, trebuie utilizate nivelurile IL-6. LBP poate servi la detectarea expunerii pacienților la endotoxine. Este încă de văzut dacă este un marker de risc de moarte.
Pacienții cu insuficiență renală cronică prezintă modificări în răspunsul imun, Atât hemodializa specifică, cât și nespecifică poate fi considerată ca imunodeficient 1. Hemodializa nu rezolvă majoritatea acestor tulburări și chiar adaugă noi, prin creșterea expunerii pacientului la materiale bioincoplatbile, endotoxine și substanțe cum ar fi dializa acetat lichid. Această situație este însoțită de o predominanță a citokinelor proinflamatorii asupra medicamentelor antiinflamatorii 1,2, astfel încât unii dintre acești pacienți mențin o reacție de fază acută „cronică”. Reactantele pozitive de fază acută, cum ar fi proteina C reactivă și fibrinogen, sunt adesea crescute în ser și negative, cum ar fi albumina și prealbumina, au scăzut. Aceste reactanți de fază acută sunt capabili să prezică riscul de deces la acești pacienți, chiar și după ce au ajustat mortalitatea altor factori, cum ar fi vârsta, sexul, diabetul etc. 3-7.
Mortalitatea pacienților cu dializă este de mai multe ori mai mare decât cea a restului populației, corectată pentru vârstă și sex. La acești pacienți, cauzele morții cardiovasculare sunt cele mai frecvente. Această predominanță a morții cauzei cardiovasculare este mult mai pronunțată în Europa de Nord și în Statele Unite ale Americii decât în sudul Europei. În registrul spaniol al tratamentului renal de înlocuire din 2002, vizibil la www.senfro.org, rata mortalității datorată cauzelor infecțioase reprezintă o cantitate similară cu cardiovascularul. Mortalitatea infecțioasă este legată de deficitul imunologic și de starea nutrițională a acestor pacienți. Un bun factor predictiv de risc de deces în hemodializă ar trebui, prin urmare, să evalueze nu numai riscul cardiovascular, ci și nutriția și cantitatea și calitatea dializei. Acești factori de risc cardiovascular sunt imbricați în sindromul descris la pacienții din hemodializă 8. Prevenirea acestuia trebuie să fie obiectivul principal de reducere a mortalității ridicate a pacienților în hemodializă.
Substratul morții cardiovasculare este Arterioscleroza, care la acești pacienți este evaluată 9.10. Uremia, de la sine, este capabilă să crească plăcile ateromului 10. În evoluția plăcilor ateromice, stresului oxidativ, angiotensinei II și citokine proinflamatorii, cum ar fi influența IL-6. Radicalii de oxigen activează și împiedică inhibarea factorului nuclear nuclear NF-K-b. Toate aceste mecanisme aterogene sunt modificate la pacienții cu Dialysis Uremie. Pe de altă parte, plăcile de aterom de pacienți uremici prezintă particularități, deoarece acestea sunt cele mai frecvent calcificate. Cea mai mare tendință la calcificările extraosus ale pacienților cu dializă este legată de acest proces, fiind hiperfosfatemia unul dintre principalii săi factori de condiționare 3,10-15.
Pacienții cu dializă au factori de risc pentru a suferi evenimente cardiovasculare comune la general Populația: hipertensiune arterială; Dislipia; fumat; Obezitate, sedentar. Toate acestea trebuie prevenite și tratate, luând în considerare particularitățile acestor pacienți. În plus, pacienții cu dializă uriară prezintă factori de risc specifici, dependenți de uremie și alții din tehnica de dializă. Am menționat dezechilibrele existente între agenții oxidanți și antioxidanți, citokinele proinflamatorii și citokinele antiinflamatorii, angiotensina II, expunerea la substanțe toxice, cum ar fi cloramine sau expunere, în concentrații ridicate, substanțe cum ar fi acetic în hemodializă și glucoză în dializă peritoneală . Expunerea mai mare la substanțele pirogenice, capabile să stimuleze celulele de prezentare a antigenului, printre care endotoxinele se remarcă, merită un comentariu separat.Aceste substanțe nu pot proveni numai din dializa fluidului 16,17, ci și de infecții clinice și subclinice sau trece de la intestin printr-o barieră intestinală modificată. Capacitatea sa de a stimula monocitele și de a provoca inflamația este enormă, mai presus de toate, când există și alți stimuli sau adjuvanți. Retenția substanțelor ureene este dificil de eliminat prin dializă convențională, cum ar fi DMA asimetrică (dimetil-l-arginină) sau factorul D al complementului, este un alt factor care trebuie luat în considerare 18.19. Toți acești factori specifici trebuie tratați sau eliminați. Nu există o singură soluție deoarece nu este recuperarea funcției de integrum renale.
Printre declanșatoarele specifice de inflamație la pacienții cu hemodializă evidențiază membrana dializelor și capacitatea acestuia de a stimula direct sau prin activarea complementului monocitelor, a crescut producția de citokine. Comportamentul membranelor de hemodializă în acest aspect este foarte variabil. Unele sunt în mod clar mai biocompatibile decât altele. Pe de altă parte, prezența substanțelor pirogenice și acetat în LD sunt alți doi stimuli ai monocitelor 20-22. Prezența concomitentă a celor trei este cel mai mare stimul pentru inflamația specifică a hemodializei.
dializă lichid ca un inductor de inflamație:
dializă lichid (LD) este unul din elementele fundamentale ale tratamentului cu hemodializă. Probleme cum ar fi amiloidoza dializolată care sa crezut fundamental legată de membrana dializei au fost, de asemenea, depind de puritatea aceluiași 23,24. Astfel, unitățile de hemodializă (HD) care au îmbunătățit problema contaminării bacteriene a LD și nivelul său de endotoxine (ET) reușesc să reducă radical incidența sindromului tunelului carpian 23,24. Malnutriția și arterioscleroza sunt alte aspecte legate de puritatea LD 3.25. Sindromul „MIA”, malnutriția, inflamația și arterioscleroza ar fi mediat de citokinele (CQ) și moleculele de adeziune și ar avea în endotoxemia unul dintre principalele sale declanșatoare.
Fluidul de dializă (LD) este la fel de important ca și monitorul HD. În plus, aceste trei elemente interacționează între ele. De exemplu, este inutil să utilizați un dializer cu o membrană foarte biocompatibilă și o permeabilitate ridicată dacă avem o LD contaminată, cu un număr mare de pirogen. Dialyzerul și mașina sunt garantate de casele comerciale, care sunt responsabile pentru calitatea acestora și de a respecta normele în acest sens. Dimpotrivă, LD este fabricată în unitatea de dializă, fără posibilitatea de a controla calitatea înainte de utilizarea lor și, fără îndoială, sub responsabilitatea medicului de tratare. Pentru toate cele de mai sus, cred că calitatea LD este în prezent una dintre cele mai importante și dificile subiecte pentru personalul de sănătate al unei unități de dializă.
endotoxine în dializă lichid (substanțe inductive ale producției de citokine prin monocite)
Pacientul uremic în tratamentul cu hemodializă este supus unui stat inflamator cronic 4 -6 Această situație este legată de unii dintre factorii care condiționează mortalitatea ridicată și calitatea slabă a vieții și printre care includ arterioscleroza accelerată, malnutriția, anemia, stresul oxidativ și amiloidoza dializată 2-6, 23-30. De fapt, în prezent, arterioscleroza, malnutriția și inflamația ar trebui concepute ca trei expresii ale aceluiași proces.
Procesul inflamator este mediată de citokinele produse de stimulul celulei monocigite 4-6. La pacienții din HD, această stimulare este multifactorială, endotoxine și alte substanțe bacteriene 31. Originea acestei endotoxnemie este multiplă. Pe de o parte, infecțiile repetate intervin, unele cronici, care sunt supuse acestor pacienți, cum ar fi cei dependenți de accesul vascular sau de calea urinară. Pe de altă parte, de acum câțiva ani, rolul endotoxinelor care se adresează sângelui din lichid de dializă și care sunt produse de contaminarea bacteriană a componentelor sale.
Suntem continuu expuși la ETS și de când ne-am născut, fiecare proces infecțios pe care îl suferim este o nouă expunere. De fapt, dacă în populația normală, anticorpii IgG și IgM anti-ET ar fi observați cum nivelurile lor cresc de la naștere pentru a stabiliza aproximativ 16 ani. Concentrându-se pe pacienții din hemodializă, sa arătat că ETS poate intra în sânge prin dialyzer.Acest pas depinde nu numai de cantitatea de ET, ci și de calitatea acestuia și deși transportul este realizat în principal de către Retribilter 20, cele de greutate moleculară mică pot merge, de asemenea, cu backhip. ETS poate trece prin orice tip de membrană de hemodializă, deși sa arătat că cu membrane de permeabilitate ridicată, retrofilarea este mai frecventă și reacțiile de pirogen sunt mai frecvente decât cu minime. Există membrane de dializă cu capacitate de adsorber, cum ar fi polisulfonă și poliamidă, care pot scădea pasajul său 17.
O dată în sânge, ETS sunt capabili să activeze monocite și să inducă antrenamentul CQ. Această activare monocite nu este liniară și diferiți factori care pot crește sau micșora producția de CQ sunt implicați. Este un proces multifactorial, în care cantitatea și tipul de toxină influențează tipul membranei, diferiți factori plasmatici și acțiunea concomitentă a altor sisteme de activare și inactivare monocite 21. Se știe că prezența proteinelor sau a sângelui întreg este Factorul consolidat al acestui proces de activare și în prezent, cel puțin două proteine, un transportor (LBP, proteină de legare a lipolisacaridos) și altul cu capacitate de permeabilitate (BPI), sunt necesare pentru ca acest proces să fie efectuat 32. Prezența concomitentă a altui stimulent sau semnalele sunt foarte importante, cum ar fi activarea complementului și, în final, pentru a complica în continuare acest fenomen, unele CQ vor intra în joc, cum ar fi IL-10 33. Cele de mai sus justifică importanța atât a statutului de nutriție cât și a sistemului imunitar au în acest domeniu.
În plus față de endotoxine, există și alți agenți capabili să stimuleze monocitele. Acestea sunt acele elemente bioincoplatbile ale sistemului de dializă și între cei care evidențiază membrana dialyzerului. Contactul sângelui cu aceasta produce o serie de reacții care afectează majoritatea celulelor și proteinelor din sânge. În acest proces, efectul activării complementului indus în diferite grade prin membranele de dializă este foarte important. Pe de altă parte, nu trebuie să uităm că unele membrane sunt capabile de endotoxine de adsorbare și mediatori care diminuează efectul bioincompatibil.
monocitele, ca celulă efectoare, integrează diferitele stimuli și produce o eliberare cronică de citokine. Cunoașterea receptorilor membranei acestor celule a ajuns să confirme modul în care endotoxinele sunt stimulul lor principal, receptorii CD14 20, dar ar fi nevoie de alte stimuli concomitent, cum ar fi complementul CD16, astfel încât CQ să fie secretate 34.
CQ și IL-6 fundamental sunt capabili să declanșeze o reacție de fază acută, a cărei expresie principală este schimbarea sintezei proteinelor prin ficat. Unele dintre proteine, cum ar fi albumina și prealbumina, încep să se sintetizeze într-o cantitate mai mică, iar altele, pe de altă parte, își sporesc producția, ca și în cazul proteinei C-reactive (PCR) și substanța de amiloid serică (ASA) . Se pare că PCR nu ar fi doar un marker de fază acută, ci ar avea un rol de mediator al inflamației și leziunilor vasculare. Nivelurile PCR la mulți pacienți cu hemodializă sunt crescute cronic și se referă la anumiți factori ai pacientului, cum ar fi: mortalitatea, arterioscleroza, statutul nutrițional și unele comorbidități care implică inflamație-infecție. Nivelurile PCR cu caracteristici ale tehnicii de hemodializă, cum ar fi: retriltrarea, endotoxinele LD și îndepărtarea acestuia prin filtre 6,20.
Pentru a evita această situație inflamatorie, trebuie să acționăm la diferite niveluri: prevenim și tratăm contaminările bacteriene ale LD; Scoateți LD ETS prin filtre adecvate în circuitul hidraulic al mașinilor HD; Evitați sau tratați infecțiile cronice ale pacienților din HD; Utilizați materiale biocompatibile pentru a evita stimulii concomitent de monocite și elimină acetat, chiar și la niveluri scăzute ale LD. Menținerea stării nutriționale bune la pacienții noștri din HD poate influența un răspuns imun mai bun. Acțiunea asupra LBP sau a IBP sau a beneficiarilor monocitelor sau a CQ este încă în faze de studii preliminare.
O serie de lucrări efectuate în unitățile de dializă ale zonei 1 din Madrid Unele dintre ele în colaborare cu unitățile de dializă italiană coordonate de Dr. Panichi 20. Există trei elemente fundamentale din cascada proinflamatorică specifică a pacienților din hemodializă: proteină C-reactivă (PCR); IL-6 și proteina de legare a lipopolizacharică (LBP).Obiectivul acestor studii a fost acela de a relaționa acești trei mediatori cu factori clinici și biochimici și chiar și cu mortalitatea acestor pacienți
proteina C reactivă ca marker de mortalitate în HD.
Acest studiu vizează relaționarea PCR cu alți factori HD și, la rândul său, cu prognosticul pacienților.
La 84 de pacienți HD nu au fost selectați, a unității noastre spitalicești, a fost efectuată o măsură bazală, la trei luni Și anual de PCR și IL6, au fost urmăriți timp de patru ani. PCR a fost determinat de un test imunoreactiv mare, 0.001 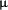 ml, (tehnica de nefelometrie laser, diagnosticarea Behring), cu normal Valori între 0,1 și 4 mg / l.
ml, (tehnica de nefelometrie laser, diagnosticarea Behring), cu normal Valori între 0,1 și 4 mg / l.
PCR a fost ridicat în raport cu comenzile, mai mare de 5 mg / l, la 47 din cei 84 de pacienți și mai mare de 20 mg / l în 17 ani (n = 84, 15,2 ± 18,9 mg / l). A existat o bună corelare a PCR cu IL6, N = 84, R = 0,65, pigibil, corelat cu alte reactante de fază acută: prealbumină, r = -0,47; Vgs, r = 0,32 și albumină r = -0,27. La 15 pacienți, elevația sa ar putea fi datorată suferinței bolilor de intercanare care condiționează inflamația. La 25 de pacienți a existat patologia vasculară, iar PCR a fost, de asemenea, mai mare decât cea a pacienților fără boli de intercounter, diferențele de pexiste în PCR conform membranei de dializă și dializei utilizate, dar nu au atins semnificația statistică.
Diferența medie dintre cele două determinări PCR a fost de 5 mg / l, mult mai mică la pacienții cu valori normale, 1,2 mg / l.
PCR nu a fost comportat ca o variabilă de distribuție normală. Nici nu sa comportat în conformitate cu alte standarde de distribuție. Numai atunci când transformarea sa logaritmică a avut o distribuție Gaussiană. Corelația dintre două valori consecutive din fiecare pacient a fost r = 0,95, corelația pesta a fost menținută timp de doi ani pierduți mai târziu.
al celor 84 de pacienți 38 au decedat în timpul celor 4 ani de urmărire. Supraviețuirea pacienților cu niveluri inițiale ridicate de PCR a fost: 79%, 60%, 44% și 35% pe an, al doilea, 3 și 4 ani. La pacienții care au avut niveluri normale, a fost: 95%, 87%, 76% și 64%. (Rang de jurnal p = 0,0032). Diferența dintre cele două curbe de supraviețuire a fost înființată în primii doi ani, 29%, pentru a rămâne în acel interval până la 4 ani. Studiul longitudinal pentru evaluarea efectului variației temporare a PCR asupra supraviețuirii a demonstrat, în cohorta studiată, scăderea progresivă a valorii sale predictive. Analiza COX a dat ca cofactori predictivi de deces, PCR, P = 0,0001, vârstă p = 0,0011 și creatinină p = 0,026.
În acest studiu a fost încheiat că PCR este un factor predictiv independent de moarte. Își menține valoarea predictivă în primii doi ani după determinarea sa. La mulți pacienți, reacția de fază acută este intermitentă și nu continuă.
IL-6 ca marker de mortalitate în HD.
IL-6 stimulează sinteza PCR în ficatul. La pacienții din hemodializă, s-a arătat că atât PCR, cât și IL-6 au o valoare predictivă puternică a decesului 35,36. Ceea ce nu este cunoscut este dacă valoarea predictivă a IL-6 reflectă pur și simplu ceea ce PCR, fiind mai ușor de măsurat. Obiectivul acestui studiu a fost de a ști dacă IL-6 oferă informații mai mult sau diferite de prognostice decât PCR.
O cohorta de 218 de pacienți din hemodializă a fost urmată în timpul unei median de 3,5 ani. Vârsta medie a fost de 59,5 ani, 63% bărbați și 18% diabetici. În timpul urmăririi, 75 au murit, 41 de cauze cardiovasculare. IL-6 (Sistemul EIM, Sistemul RD), PCR (metoda modificată de nefehelometrie de înaltă sensibilitate, diagnosticarea Berhing, GmbH, Rarburg), a fost determinată albumină serică, hematocrit, lipide serice și ipth. O analiză a regresiei COX a fost utilizată pentru a examina relația de IL-6 și PCR și mortalitate.
Rezultate: quartile minore (13,5 pg / ml pentru IL-6 și > 14,0 mg / l pentru PCR) a fost de 4,52 (interval de încredere 95%: 2.26-9.05) pentru IL6 și 2.41 (1.33-4.37) pentru PCR. Când ambele variabile au fost incluse în același model, estimarea a fost de 4,01 (1.69-9,50) pentru IL-6 și 1,08 (0,51-2,59) pentru PCR. Ca variabile continue, relația dintre ambele și mortalitatea devine liniară după transformarea logaritmică a variabilelor. Pentru o unitate a deviației tipice a jurnalului (variabilei), RR a fost 2,07 (1,50-2,85) pentru IL-6 și 1,65 (1,20-2,56) pentru PCR.
Când este inclusă în același model, estimarea a fost de 1,90 (1.28-2.81) pentru IL-6 și 1,15 (0,80-1,66) pentru PCR Aceste rezultate nu s-au schimbat substanțial atunci când a fost examinată numai mortalitatea cardiovasculară. Fenomenul a fost și mai pronunțat după ajustarea tuturor factorilor potențiali de confuzie.
CONCLUZII: IL-6 are o valoare predictivă mai mare decât PCR pentru toate cauzele mortalității și cardiovasculare. Se pare că oferă informații independente și mai convenabile de pre-furnizare decât PCR. Sunt necesare mai multe studii pentru a determina dacă rezultatele depind de cea mai mică eroare de măsurare a IL-6 sau de variabilitatea mai mică sau dacă reflectă un adevărat fenomen biologic.
o ipoteză pentru a explica aceste rezultate, ar fi : IL-6 are efecte asupra nutriției și imunității, două condiționări importante a evoluției infecțiilor, fiind în Spania, o cauză a mortalității la fel de importantă ca și cardiovascularul.
Proteina de legare a lipopolizaharidei (LBP) ca marker de inflamație în HD.
LBP este o proteină de 60 kD sintetizată în hepatocyte. Nivelurile plasmatice cresc în situațiile cu expunere la endotoxine (ET). Se alătură ETS și le transferă la receptorul lor monocitar, CD14, îmbunătățind răspunsul acestuia. Datorită apariției sale timpurii în cadrul lanțului inflamator, ar putea fi un marker util în diagnosticul și prognosticul pacientului cu complicații legate de expunerea la bacterii și endotoxine. În această lucrare, LBP a fost studiată la pacienții din HD și relația lor cu alți factori considerați implicați în sindromul de răspuns inflamator sistemic.
Pacienții și metodele: LBP (imunoteste specifice, a fost determinată. IMULITE®) , în 220 nu au fost selectați pacienți în HD. Simultan IL-6, PCR, albumină, prealbumină, fibrinogen, hemoglobină (HB), IST și doza de EPO au fost măsurate. Au fost colectate caracteristicile clinice ale pacienților și hemodializei. Vârsta medie a fost de 62,2 ± 14,9 ani. 121 au fost bărbați și 99 de femei. Timpul mediu în HD a fost de 70 ± 67 luni.
Rezultate: Nivelul mediu al LBP a fost de 14,9 ± 8,8 ug / ml, valorile normale fiind cu procesul inflamator cronic sau acut ( N = 69, p = 0,000), episoade de avva (n = 33, p = 0,034), vasculopatie periferică (n = 60, p = 0,04), a avut boală cronică non-ischemică (n = 111, p = 0,001)) niveluri de LBP mai mari decât cei care nu. Nu au existat diferențe în ceea ce privește nivelurile plasmatice ale LBP în funcție de sex, existența (n = 42) sau nu de fistule antice, că FAV a fost autologe (102) sau o grefă, care a avut (n = 67) sau nu o cronică Hepatopatie sau că a fost un purtător (n = 18) sau nu dintr-un neoplasm activ
și nu au existat diferențe în funcție de mașină (n = 66) sau nu filtru de ET. LBP a fost corelat semnificativ cu PCR (P = 0,000), fibrinogen (p = 0,000), feritină (p = 0,033), IL-6 (p = 0,002) și IRE (p = 0,001) direct și invers cu albumină (p = 0,000), prealbumina (p = 0,000), hematocrit (p = 0,019) și hemoglobină (p = 0,041). Coeficientul de corelație al PCR cu IL-6 (p = 0,07) a fost mai mic decât cu LBP. În analiza factorială prin etape, LBP a fost inclusă în componentele RFA, dar și în cele ale anemiei și nutriției.
Concluzie: LBP este legată de RFA, cu o semnificație mai mare IL-6. De asemenea, este legată de parametrii clinici implicați în Sris și, prin urmare, este un marker de inflamație la pacienții din HD. Este necesar să continuăm urmărirea acestor pacienți timp de mai mulți ani pentru a evalua dacă este un bun marker de risc de deces în hemodializă.
evoluția nivelului LBP în funcție de utilizarea unui filtru pentru endotoxine în circuitul hidraulic al mașinilor HD.
În această lucrare, schimbarea la nivelurile LBP ale pacienților din Hemodializă după punerea filtrelor ET în monitoare.
Pacienți și metode: coincide cu plasarea filtrului ET la 56 de pacienți monitoare în HD, poliehersulfonă (PES) în 17 și polisulfone (PS) în 34, LBP bazal a fost determinată (înainte de punerea filtrului) și la 3 luni de plasare (imunoteste specifice, imulite®). Grupul de control, au fost formați 34 de pacienți, rămase fără un filtru. În același timp, au fost măsurate simultan, IL-6, PCR, albumină, prealbumină, fibrinogen, hemoglobină, feritină și doze EPO și EPO. Au fost colectate caracteristicile clinice ale pacienților și hemodializei. Evul Mediu a fost de 64 ± 13 ani, 44 au fost bărbați și 46 de femei și timp în HD de 69 ± 61 luni.
rezultate: În timpul urmăririi pacienților din studiu, Nivelul ET în pre-ultrafilterul LD a crescut de la niveluri mai mici de 0,5 UE / ml la ora bazală, la niveluri între 0,5-1 UE / ml la 3 luni de plasare ultrafilter.
LBP între ambele determinări a crescut semnificativ la pacienții fără filtru Et (n = 34, p = 0,03) și au rămas neschimbată în care a fost plasată.Nu au existat diferențe în ceea ce privește nivelul LBP de bază dintre grupul care a început cu filtrul PES și PS, dar LBP la trei luni a fost mai mare la cei care aveau filtru PES (p = 0,018). La pacienții cu filtre PS, LBP scade la trei luni de plasare (n = 39, p = 0,025), această scădere fiind în detrimentul subgrupului cu dializante cu permeabilitate scăzută (n = 28, p = 0,049). Atunci când creșterea LBP este analizată în grupul de control (fără filtru) în funcție de permeabilitatea membranei, este obiectivă că este semnificativă numai în subgrupul pacienților cu dializatori de coeficienți UF mai mare de 15 ml / oră / mmHg ( N = 28; p = 0,049).
La cei 56 de pacienți în care ultrafiltrul, IL-6 scade semnificativ, p = 0,001, în timp ce în grupul de control nu este modificat.
Concluzie: LBP crește atunci când există expunerea la ET și, prin urmare, este un marker util pentru monitorizarea gradului de expunere la ET și alți contaminanți bacterieni ai LD. Filtrele ET sunt capabile să contracareze parțial acest efect.
Referințe:
1.- GIMDT M, Sector M, Sector U, Kaul H, Kohler H. Aspecte moleculare ale funcției celulelor T și B În uremia. Rinichiul INT 2001, 78: S206-11.
2.- Goicoeheea M, Martin J, De Derque P, Quiroga Ja, Ortiz A, Carreño v, Caramel C rol de citokine în răspunsul la eritropietină Pacienți cu hemodializă. Rinichiul INT 1998 54: 1337-1343.
3.- Zimmermann J, Herrlinger S, METZGER T, Wanner C: Atingerea riscului cardiovascular și mortalitatea în hemodialismis. Rinichi Int 1999: 55: 648-658.
4.- Brány P., Divin JC., Bergström J.: Proteina C-reactivă ridicată este predictorul puternic al rezistenței la eritropietină la pacienții hemodializi. Am J Kid Dis 1997; 29: 565-568.
5.- Haverkate F, Thompson Sg, Pype SDM, Gallimore JR, Pepys MB: Producția de proteină C-reactivă și crescută de evenimente coronare în angină stabilă și instabilă. Lancet 1997; 349: 462-466.
6.- Bergström J, Heimbürger O, Lindholm B, Qureshi Ar: C-reactive Proteina ca predictor pentru albumina serică și mortalitatea în hemodialiysis. Gen am Soc Neprol 1995; 6: 573-577.
7.- Yeu Jy, Levine Ra, Mantadilok V, Kaysen GA. Proteina C-Reactive prezice All-Causa și mortalitatea cardiovasculară la pacienții cu hemodializă. Am J. Rinichi Dis 2000; 35: 469-476.
8.- Stenvinkel P, Heimburger O, Paultre F și colab. O puternică asociere între malnutriție, inflamon și aterosceleros în insuficiență renală cronică. Rinichi int 1999; 55: 1899-1911.
9. – Lindner A, Charra B, Sherrard DJ, Scribner Bh. Ateroscenoza accelerată în menținerea prelungită a întreținerii. N Engl J Med 1974; 290: 697-701
10. Kerstin Amann, Christina Ritz, Marcin Adamczak, Eberhard Ritz. De ce este boala coronariană a patantelor uraemice atât de frecvente și atât de devastatoare? Transplant de apel de nefrol (2003) 18: 631-640.
11.- Oh J, Wunsch R, Turzer M și colab. Arteriopatie coronariană avansată și carotidă la adulții tineri cu insuficiență renală cronică cronică din copilărie. Circulația 2002; 106: 100-105
12. – De la Francisco Alm, Pérez García R. Ultrapure Diarate și Efectul Site asupra rezultatelor pacienților. Saudi J rinichi dis Transplant 2001; 12 (3): 406-412.
13.- Block GA, Hulbert-Shear Te, Levin NW, Port Fk. Asociația Fosforului seric și a produsului de calciufosfat cu risc de mortalitate la pacienții cu hemodializă cronică: un studiu național. Am J rinichi dis 1998; 31: 607-617
14.- frate, Bentzon JF, Falk E, Nielsen LB, Olgaard K. insuficiența renală cronică Îmbunătățește ATIC ATHEROSCCELEROS la șoarecii apolipoprotein-e cu deficit de șoareci. NEPHROL Transplant de apelare 2002; 17: 46A
15.- shoji t, emo m, tabata t și colab. Ateroscleroza avansată la pacienții cu predispoziție cu insuficiență renală cronică. Rinichi int 2002; 61: 2187-2192.
16.- Pérez-García R, Rodríguez Benítez P. De ce și cum să monitorizeze contaminarea bacteriană a diassatei? Transplant de cadran de nefrol 15: 760-764, 2000.
17.- Pérez-García R., Anaya F., Chisvert J., Valderábano F. Asociația Dializei de înaltă Flux și contaminarea bacteriană a DIRIATULUI indusă Eliberarea cronică a citokinelor la pacienții cu hemodizioză. Transplant de apelare de nefrol 11: 2.164-2.166, 1.995.
18.- Deppisch RM, Beck W, Goehl H, Ritz E. Completați componentele ca toxine uremice și rolul lor potențial ca mediatori de microinflamm. Rinichi int furnizat 2001; 78: S271-S277
19.- Kielstein JT, Boger Rh, Bode-Boger SM și colab. Creșterea marcată a dimetilargininei asimetrice la pacienții cu boală renală cronică primară incipientă. J AM SOC NEPHROL 2002; 13: 170-176.
20.- Panichi V, Migliori M, de Pietro S, Metelli Mr, Taccola D, Pérez García R, Palla R, Rindi P, Cristofani R, Tetta C. Plasma c – Proteină acactivă în hemodiadisisisisa: un studiu clinic încrucișat, longitudinal. Blood Purif 2000; 18: 30-36.
21.- G. Lonnemann: Calitatea bacteriologică dializată și permeabilitatea membranelor de dializolare la pirogeni.Rinichi int 1993; 43, furnizat. 41: 195-200.
22.- Amore A, COPPO R. acetat intoleranță și sinteza oxidului nitric de către celulele endoteliale. JOM SOC NEPHROL 1997, 8: 1431-1436.
23.- Baz M, Durand C, Ragon A, Jaber K, Andrieu D, Merzouk T, Purgus R, Olmer M, Reynier JP, Berland Y: Utilizarea apei Ultrapure în hemodializă întârzie sindromul tunelului carpal. Int J ARTIF Organe.1991: 14: 681-685.
24.- Schwalbe S, Holzhauer M, Schaeffer J, Galanski M, Khoch Km, Floege J: beta2 Microglobulin asociat asociat: o complicație de dispariție a Hemodializă pe termen lung? Rinichi int 1997; 52: 1077-1083.
25.- Kaizu y, Kimura M, Hibi I, Kumagai H: Interleukin-6 pot media malnutriția la pacienții cu hemodializă cronică.Am J Rinichi Dis 1998 ; 31: 93-100.
26.- Kleophas W, Hasstert B, Backus G, Hilgers P, Westhoff A, Van Endert G Experiență pe termen lung cu un fluid de dializă individuală ultrapură cu o mașină de tip de baie NEPHROL Dial Transplant 1998; 13: 3118-3125.
27.- Gunnell J, Yeun Jy, Depner Ta, Kaysen GA. Răspunsul acut-faze prezice rezistența la eritropoietină la pacienții cu hemodializă și dializă peritoneală. AM J rinichi dis 1999; 33: 63-72.
28.-sitter t, bergner a, Schiffl H: Inducerea citokinei legată de dializa și răspunsul la eritropoietinul uman recombinant la pacienții cu hemodializă. Neutrofilele expuse la neutrofilele expuse la lipopolizaharidei bacteriene Upregulează ansamblul NADPH Oxidaza: J Clin Invest 1998; 101: 455-463.
30.- Morena M, Cristol JP, Canaud B. De ce pacienții hemodializați se află într-o stare prooxidantă? Ce s-ar putea face pentru a corecta dezechilibrul Pro / Antioxidant. Blood Purif 2000; 18: 191-199. . Transplant de apelare NEPHROL 1995; 10: 328-333.
32.- Sundaram S, rege AJ, Pereira Bj. Proteina de legare a lipopolizaharidelor și factor de creștere a bactericidă / permeability în timpul hemodializei: determinanți clinici și rolul membranelor diferite. J AM SOC NEPHROL 1997; 8: 463-470.
33.- Girdt M, Köhler H, Schiethelm-Weick E, Schiak JF, Büschenfelde KHM, Fleischer B. Producția de interleukină-6, Factorul Necroză Tumora A și Interleukin-10 In vitro se corelează cu defectul imun clinic al pacienților cu hemodializă cronică. Rinichi int 1995; 47: 559-565.
34.- Scherberich Je, Nockher WA: Fenotipurile de monocite din sânge și receptorul de endotoxină solubil CD14 în bolile inflamatorii sistemice și pacienții cu insuficiență renală cronică. NEPHROL Transplant de apelare 2000; 15: 574-577.
35.- PeCoits-Filho R, Bárány P, Lindholm B, Heimbürger O, Stenvinkel P. Interleukin-6 este un predictor independent al mortalității la pacienții care au început tratamentul cu Diálisis. NEPHROL Transplant de apelare 2002; 17: 1684-1688.
36.- Bologa Rm, Levine Dm, Parker Ts, Cheigh Js, Serur D, Stenzel Kh, Rubin Al. Interleukina-6 prezice hipoalbuminemie, hipocolesterolemie și mortalitate la pacienții hemodializuali. Am J rinichi dis 1998; 32: 117-114.