mediat de canalele de potasiu dependente de ATP.
dr. Fernando Zeledón SA, Dr. Orlando Morales Ma, Dr. Edgar Méndez JB, dr Eduardo Induni LC, Dr. Oswaldo Gutiérrez SD.
Rezumat
Mitocondriile joacă un rol central în menținerea metabolismului cardiomicitului în timpul fenomenului ischemiei și reperfuziei. Această „cardioprotecție” pare a fi legată de deschiderea canalelor de potasiu dependente de ATP în membrana mitocondrială, care evită deschiderea porilor de permeabilitate tranzitorie (MPTP), supraîncărcarea calciului și pierderea volumului spațiului intermimbral mitocondrial, prevenirea morții celulare prin necroză sau apoptoză .
Diferite studii clinice susțin utilizarea promițătoare a medicamentelor care deschid aceste canale de potasiu și care ar putea fi o nouă armă terapeutică împotriva bolii ischemice și consecințele acesteia.
Cuvinte cheie: precondiționarea ischemică; Canalele de potasiu mitocondriale și sarcolemice; Supraîncărcare de calciu; stres oxidativ; apoptoza, pororii de permeabilitate tranzitorie.
canalele de potasiu sensibile la Mitochondrial Joacă un rol important care împiedică moartea celulelor necrotice și apoptsis în timpul fenomenelor ischamice / reperfuziei prin intermediul prevenirii porilor de tranziție a permeabilității mitocondriale (MPTP), suprasarcină intracelulară de calciu și pierderea spațiului intermimbral mitocondrial.
Există dovezi clinice de efecte benefice ale unui grup de băuturi numite deschizători de canale de potasiu pe care Colud să fie un nou instrument terapeutic împotriva bolii cardiace ischimice și Constarea sa.
Canalele de potasiu ischemice precondiționate și mitocondrial, supraîncărcarea calciului, stresul oxidativ, apoptoza, pororii de tranziție la permeabilitate mitocondrială.
Introducere
până în prezent , tratamentul bolii cardiace de origine ischemică sa concentrat pe prevenirea daunelor ischemice, creșterea contribuției de oxigen la zona miocardică în pericol sau Scăderea consumului de oxigen a miocitelor cardiace.
De asemenea, de mulți ani se știe că expunerea miocitelor la scurt evenimente ischemice în mod repetat, produce protecție împotriva evenimentelor ischemie post-durabile, procesul numit Precondiționare ischemică ischemică (1 ).
Interesul științific este concentrat în căutarea mecanismelor celulare implicate în cardioprotecție împotriva evenimentelor ischemiei / reperfuziei, printre care canalele de potasiu sensibile la ATP (KTP) par să aibă un rol central (1– 3).
În acest articol, conceptele de fiziologie celulară și moleculară legată de rolul ATP K sunt revizuite în apărarea ischemică miocardă.
Structura și funcția canalelor de potasiu cardiac .
potasiu (K +) este a doua cea mai abundentă cationie a organismului. Un adult de 70 kg conține aproximativ 4200 meq de potasiu sau aproximativ 50 meq / kg la bărbat și 40 meq / kg la femeie, luând în considerare ajustarea prin adipocity și masa corporală. Conținutul K + al organismului scade cu vârsta la aproximativ 2 meq / kg pentru fiecare 10 ani prin scăderea masei musculare.
aproximativ, 98% din K + este în lichid intracelular, cu o concentrație de 150 Meq / l, în timp ce în afara celulelor este de 4 meq / l, cu o gamă normală îngustă între 3,5 până la 5,5 meq / l.
Cantitatea ingerată K + din țările occidentale este de aproape 50 până la 100 meq / zi sau mai mult sau mai puțin de 0,7 până la 1,3 Meq / kg de greutate corporală pe zi. De exemplu, într-o persoană care consumă 80 de meq într-o zi, rinichiul va fi responsabil pentru excreția de 70 meq, tractul gastrointestinal 9 Meq și pielea în jurul valorii de 1 Meq.
Potasiu se află într-un echilibru îngust al corpului , o parte din care se datorează unei redistribuții între diferitele compartimente celulare, fie că acel ion este tradus de la mediul intracelular la extracelular sau invers (4). Pentru ca un astfel de fenomen să apară, celula utilizează proteine transmembranare care funcționează ca canale.
canalele de ioni au trei proprietăți esențiale:
1) un tunel central sau un porți prin care curge din ioni cu privire la gradientul lor electrochimic.
2) Un filtru de selectivitate, care dictează care ion va fi lăsat să treacă prin porți, numit regiune P
3) o structură care exercită funcția de poartă prin controlul probabilității conformaționale de deschidere și închidere a canalului și, prin urmare, permeabilitatea proteinei (4,5,6,7).
canalele de potasiu sunt compuse din alfa și subunitățile beta. Responsabil pentru conducerea ionilor prin lipidul Bilayer este subunitatea Alpha.În funcție de topologia sa și de numărul de regiuni P (selectivitatea porilor), a fost stabilită o clasificare a canalelor de potasiu (4,7,8).
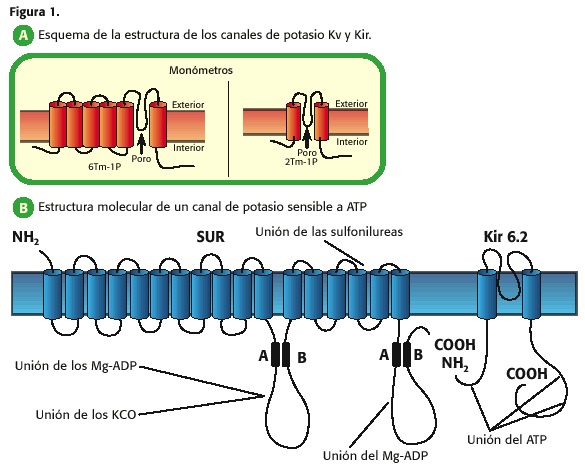
Astfel, de exemplu, canalele de potasiu care crește o scădere permeabilitatea lor în funcție de tensiunea transmembranară, ele au șase segmente transmembranare (TM) și un porți (1 P) și se numesc canale K + dependent de tensiune (KV, Figura 1, A); Cei care prezintă 2 TM-1P sunt canale care permit trecerea de potasiu spre intracelulare atunci când membrana plasmatică este la o tensiune mai negativă decât potențialul balanței sale și sunt închise la potențial mai pozitiv, astfel încât acestea sunt numite, redresoare canalelor de potasiu în interior (KIR , K Rectifert) (7,9,10,11,12,13).
DIV id = „bcf9cbdab4”>
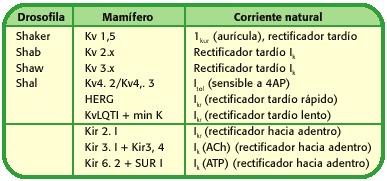
Fiecare dintre aceste familii de canale de potasiu poate, la rândul său, subfamilii, în funcție de electrofiziologia canalului sau a ligandului care mediază deschiderea unor astfel de proteine, tabelul 1.
Tabelul 1. Nomenclatura și structura canalelor de potasiu (14).
div Id = „bcf9cbdab4”>
în cadrul canalelor de redresor în interior sunt două subfamilieri importante în fiziologia cardiacă: 1) canalele K reglementate de proteina G, care sunt activate de R. Eceptoarele muscariniene M3 (KACH) și 2) Canale sensibile la ATP (KATP), acest ultim obiect central al revizuirii (7,9,10,13).
Funcția ATP K este cea mai bună Cunoscută în celulele pancreatice beta, în cazul în care modificările cuplarea în excitabilitatea electrică a membranei plasmatice și eliberarea de insulină, în raport cu concentrația de glucoză din sânge. Cu toate acestea, acestea au fost, de asemenea, implicate în protecția neuronală în evenimente ischemice și în reglarea epilepsiei, a tonului pulmonar și sistemic), recuperarea glucozei în mușchiul scheletic și protecția împotriva ischemiei din miocitele cardiace, subiectul acestei revizuiri (10).
Aceste proprietăți derivă din capacitatea canalelor KATP pentru a cupla metabolismul celular la activitatea electrică, detectarea modificărilor în citozolul nivelului ATP și difosfatul de adenozină (MG-ADP), care operează ATP ca blocant de canale și mg- ADP ca activator sau promotor al deschiderii sale (10,11).
Punerea canalelor de potasiu este un tetramer și deoarece KIR sunt 2 TM-1P, patru dintre aceste unități sunt unite pentru a forma Pore, denominat la nivelul cardiac Kir 6.2 și KIR 6.1. În plus, există o altă proteină numită receptor de sulfoniluree (receptori de sud, sulfoniluree, figura 1, b (15))
care reglează deschiderea sau închiderea pororii Kir 6.2 sau KIR 6.1: ATP inhibă Canalul deja că se alătură subunității KIR6, în timp ce MG-ADP o activează prin interacțiunea cu subunitatea sudică (10,11,12,13,14).
Funcția centrală a mitocondrii în cardioprotectie
mitocondriile se găsesc în aproape toate celulele, cu excepția hematisului, iar numărul acestora variază în funcție de tipul de celule; De exemplu, fiecare hepatocit are 1.022 până la 2.000 mitocondriile, care măsoară o lungime de 3 pm.
mitocondriile posedă două membrane, un extern și altul intern, ceea ce are ca rezultat compartimentele intermimbrane și matricea mitocondrială. În matricea mitocondrială și în membrana internă este locul în care sunt dezvoltate cele mai multe activități legate de lanțul respirator (16). În mitocondriile există mai multe proteine care joacă anumite funcții, indiferent dacă promovează cardioprotecția sau în detrimentul funcției cardiace; și ele sunt interdependente de KATP de diferite mecanisme.
în cele mai importante sunt:
1) POR PORMABILITATEA TRANSITIONALĂ (MPTP, pororii de tranziție a permeabilității mitocondriale) care este compusă din:
canal anion dependent de tensiune (VDAC, canal de anion dependent de tensiune), care este situat în membrana mitocondrială exterioară (MME)
– transportorul de nucleotide de adenină (furnică, Adenină translocator nucleotidic), amplasat în membrana internă (MMI)
– creatina kinază (CK), în spațiul intermambran (EIM)
2) contra-transportoare Na + / H +, Na + / Ca ++, K + / H +, H + / Pyruvat, CA ++ Cotransportor și proteinele bine-cunoscute ale lanțului respirator, ciclul de beta-oxidare și Krebs (17,18) Figura 2).
divid id = „bcf9cbdab4”
Evenimente mai importante implicate în geneza ischemiei / repecției sunt:
1. Modificări ale volumului matricei mitocondriale
2. Starea EIM
3. Permeabilitatea MMI
4. Ruperea MME și
5. Supraîncărcarea intramitocondrială de calciu-sodiu.
Fiziologia mitocondrială a manipulării calciului.
Calciu joacă un rol fundamental în fiziologia mitocondrială, ale cărei concentrații sunt în intervale înguste. Calciul poate fi recapturat spre matricea mitocondrie prin MMI prin trei mecanisme:
1) o pompă de calciu, cunoscută sub numele de UNI-Calciu sau UP,
2) un canal care permite Intrarea rapidă a calciului, cunoscută sub numele de proteină de transport rapid de calciu sau RAM (absorbție rapidă CA ++) și
3) o râu sau Ryr (receptor de ryanodină).
pe cealaltă Mână, ieșirea de calciu a matricei mitocondriale se datorează:
1) contra-transportor Na + / Ca ++, în condiții fiziologice
2) MPTP, În condiții patologice (figura 3)
Funcția primară a calciului la nivelul de Mitocondria este stimularea lanțului respirator la niveluri multiple, determinând o creștere a producției de ATP și exportul acesteia în citosol pentru a satisface cererea metabolică de miocit.
știe, de asemenea, că procesul de fosforilare oxidativă generează un PE. Cantitatea radicalilor liberi ca produs al complexelor I, coenzima Q și complexul III și atât de departe de a fi dăunătoare, mai degrabă sunt necesare pentru transducția semnalului de căi metabolice intramitocondriale (19).
mecanisme care promovează suprasarcină de calciu intramitocondrial. În timpul ischemiei miocardice, creșterea glicolizei determină o acumulare progresivă de acid lactic, scăderea pH-ului mitocondrial și care va exercita feedback negativ care în cele din urmă
va inhiba glicoliza și producția ATP. Activarea anticipării anti-Go + / H + care extrudează hidrogenicii mitocondriilor caută normalizarea pH-ului intramatricial, dar în proces se va încuraja o supraîncărcare de sodiu, care nu poate fi pompată din celulă, deoarece Pagina de Na + / K + este inhibată de pierderea ATP (19). În consecință, activitatea contra-transportor Na + / Ca ++, care de obicei exportă calciu din mitocondriile și celula, este scăzută sau chiar acționând invers (deoarece acesta este un mecanism secundar de transport activ), astfel încât în compartimentele celulare diferite inițiază un feedback pozitiv care promovează foarte mult o supraîncărcare a calciului. În acest moment, homeostazia ionică nu poate fi menținută, concentrațiile intracelulare de sodiu și calciu crește progresiv, cu nucleotidele scăzute ale adeninei și fosfatul crescut.
În plus, creșterea mitocondrială de calciu promovează formarea radicală liberă în mitocondriile Prin următoarele mecanisme:
1) Suprasarcina mitocondrială de calciu promovează o creștere a fluxului de electroni în lanțul respirator
2) stimulează, de asemenea, sintetaza azotată de oxid, formând oxid nitric (nr)
3) este cunoscut faptul că nu inhibă lanțul respirator la nivelul complex IV Ce
4) crește formarea de radicali liberi (ROS, specii reactive de oxigen) prin ciclul q
5) Complexele I și II ale lanțului respirator pot fi, de asemenea, inhibate de creșterea calciului și nu, contribuind și mai mult la formarea ROS
6) de calciu, de asemenea, disociază citocromul c de proteină cardiolipină în MMI și în cele din urmă MO
7) Creșterea calciului promovează deschiderea MPTP-ului, permițând eliberarea citocromului, prin MME (19).
În ciuda tuturor celor de mai sus, în timpul ischemiei mitocondriale PH (PHMI) rămâne scăzut și acest fenomen, așa cum va fi discutat în secțiunile următoare, este suficient de puternic pentru a menține MPTP-ul închis, atâta timp cât evenimentul ischemiei nu prelungește sau nu depășește reperfuzia temut.
Portabilul permeabilității tranzitorii (MPTP)
MPTP a fost descris de Haworth și Hunter cu mai mult de 25 de ani în urmă, totuși, este până acum câțiva ani că funcția sa a avut o importanță deosebită în statele ischemiei- Reperfuzia (20,21,22). Într-o stare de starea constantă sau mitocondrială, MPTP este închis, distanța
între MME și MMI este optimă și, prin urmare, există o cuplare între VDAC-CK-ANT, care permite mecanismul principal de energie al Mitochondria este sistemul creatin-fosfocreatine și, în al doilea rând, de ATP / ADP (Figura 4) (23). În plus, permeabilitatea Ant-VDAC este scăzută în această stare, iar canalele de potasiu dependente de ATP sunt închise (18,23,24).
iv id = „2bed5cd6f1”
Pe de altă parte, antipersporter K + / H + ia potasiu de la Matricea în schimbul unui hidrogenión și are, de asemenea, un cinetic scăzut în condiții staționare, pentru a asigura menținerea fosforilării oxidative, a volumului matricei adecvate și a unui potențial negativ al membranei mitocondriale, deoarece este cunoscut, potențialul hidrogenilor dintre EIM și Matricea mitocondrială este menținută la impermeabilitatea MMI la diferiții ioni, ceea ce permite generarea ATP prin complexul V situat în MMI.
în concluzie, dintr-un punct de vedere fiziologic, regulament a volumului matricei mitocondriale are consecințe importante pentru metabolismul energetic miocus și starea impermeabilă a porilor contribuie la pagina de homeostazie (17,24,25).
Pore permeabilitate tranzitorie în timpul ischemiei și în timpul repecuției . În condițiile ischemiei miocardice, MPTP se deschide pe o cantitate mai mică, permițând MMI să fie permeabil la orice moleculă < 1,5 kDa. Două consecințe importante apar atunci. În primul rând, proteinele intramitocondriale nu pot trece prin pori și pot exercita presiune coloidozmotică în umflarea matricei. MMI din cauza consistenței sale nu suferă de liză, totuși, un astfel de fenomen apare în MME, cu eliberarea proteinei la EIM, cum ar fi citocromul C și factorul de inductor al apoptozei care joacă un rol critic în moartea celulelor prin acest mecanism . În al doilea rând, MMM-ul devine permeabil la protoni, care decuplate lanțul respirator, a scăzut producția de ATP și a treia, funcționarea inversă a sintetei ATP este promovată, adică, în loc să sintetizeze ATP este promovat hidroliza acestui lucru din motive de întreținere un gradient al H + și un potențial negativ cu membrană mitocondrială (18,26,27,28,29).
Cu toate acestea, la o astfel de situație, concentrațiile ATP declin rapid, conducerea la o modificare ionică a homeostaziei metabolice și activarea enzimelor care promovează degradarea, cum ar fi fosfolipazele, nucleazele și proteazele. Cu excepția cazului în care apare închiderea MPTP, aceste modificări cauzează deteriorarea celulară ireversibilă, rezultând necroză celulară.
Un factor cheie în deschiderea MPTP este supraîncărcarea de calciu intralatarică, în special atunci când este însoțită de stres oxidativ, epuizarea Nucleotide de adenozină, concentrații ridicate de fosfat ionic și depolarizarea MMI, micromediul care este prezentat în ischemie. Prin urmare, deschiderea MPTP este un pas critic în tranziția de la deteriorarea celulelor reversibile la ireversibil (18,23).
După cum sa menționat mai sus, MPTP este format de Ant-VDAC și pe cealaltă proteina, care se numește ciclofilină-D (CYP-D), care trebuie să se alăture furnicii de a provoca deschiderea, uniunea care este promovată de creșterea concentrației de calciu, prin epuizarea rezervelor de nucleotide a adenozinei, prin creșterea PHMI și a modificărilor de volum de matrice. Cu toate acestea, un inhibitor puternic de deschidere a porilor este reducerea PHMI, un fenomen care apare în timpul ischemiei, stabilind un echilibru între factori care favorizează deschiderea sa (supraîncărcarea mitocondrială a calciului, epuizarea ATP, creșterea stresului oxidativ) și cei care îl păstrează închis ( Sub PHMI), Figura 5.
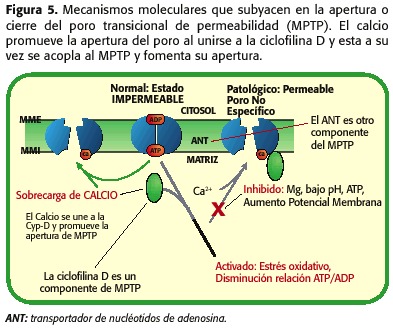
atât în timpul ischemiei, MPTP Se deschide, dar la cantitate scăzută, deoarece micro-națiunea celulară nu este optimă pentru ca un astfel de fenomen să apară. Pe de altă parte, în timpul reperfuziei există o serie de fenomene intramitocondriale care promovează deschiderea MPTP-ului chiar mai mult decât în timpul ischemiei. Când apare reperfuzia, mitocondria este din nou capabilă să respire și să genereze un potențial de membrană care permite sinteza ATP, cu creșterea producției de radicali liberi, cum ar fi produsele lanțului respirator, PHMI începe să crească și să persiste încă Supraîncărcarea calciului și deformarea ATP. Prin urmare, în acest moment se promovează deschiderea MPTP (30,31,32,33,34,35) (Figura 6). În funcție de proporția porilor deschisi și de timpul rămas într-o astfel de stare, necroza sau apoptoza (18,23,24) va fi promovată (Figura 7).
id id = = „D10729162E”>
În acest mod, mitocondriile devine un obiectiv terapeutic, fie promovând inhibarea directă a MPTP sau indirect, prin împiedicarea fenomenelor care promovează deschiderea sa, cum ar fi
1) supraîncărcarea calciului care poate fi realizată cu propofolul36 sau cu creșterea concentrațiilor de Mg ++ care inhibă contor-transportor Na + / Ca ++ și canalele de calciu tip L (37)
2) Îmbunătățirea bioenergeticii mitocondriale sau a volumului matricei, ambele fenomene propate cu medicamente care deschid canale de potasiu (KCO, Openers canal de potasiu) văd sub
3) menținând un pH scăzut în timpul reperfuziei, De exemplu, prin inhibarea antipersportadorului Na + / H + cu medicamente cum ar fi amilorida sau adăugarea piruvării (38) la mitocondriile care încurajează creșterea acidului lactic.
Totul pentru a Nterta deschide o ușă imensă în cercetarea științelor de bază și în terapeutică pentru pacienții care suferă de ischemie miocardă sau consecințele sale.
Canalele de potasiu sensibile la ATP: Funcția sa în prevenirea deschiderii MptP Mitocondrial și În membrana sarcoplasmatică
în timpul situațiilor de stres miocardic, în care ATP-ul este Reft, canalele K + își sporesc starea lor de deschidere cu consecințe benefice pentru micromediul Myocit (39,40, 41).
Deschiderea ATP Mitocondrial K provoacă o creștere modestă a influenței K + față de interiorul matricei, ceea ce determină două efecte diferite în funcție de starea bioenergetică a cardiomiocitelor. În primul rând, când celula este în repaus, potențialul membranei mitocondriale este ridicat, iar intrarea ionilor de potasiu promovează broască țestoasă mitocondrială și alcalinizarea matricei, care încurajează o ușoară creștere a producției de radicali liberi. În al doilea rând, în cazul în care celula se află în starea ischemiei, mitocondria este detașată (potențial scăzut), care promovează ieșirea K +, un fenomen care este contracarat de canalele lui K ATP și, prin urmare, contracția volumului MotrIx care ar fi în caz contrar (42).
Venitul de potasiu la matricea mitocondrială generează o ușoară producție de radicali liberi (ROS) și, după cum se demonstrează, acestea joacă un rol important ca al doilea mesager într-o varietate de semnale intracelulare (39). Această producție RO într-o celulă de odihnă promovează, de asemenea, recaptarea K + în schimbul unui H + (antitransporter K + / H +), ceea ce creează gradientul pentru schimbul unui fosfat (PI) de către electronsporterul PI / H + . PI RECAPTURE este mult mai mic decât cel al K +, deoarece PI este prezent într-o concentrație mult mai mică decât K +. Din acest motiv, pH-ul matricei este întotdeauna crescut atunci când volumul matricei crește, de asemenea, fenomenele promovate de PI și K + Recupture (23).
Când canalele nu au intrat încă În funcție de KATP în timpul evenimentelor ischemice, matricea mitocondrială suferă o contracție și crește EIM, cu disansul VDacului furnicii de către CK, ceea ce crește conductivitatea schimbătorului de nucleotide de VDAC și furnică, spre deosebire de ceea ce este se întâmplă în repaus, contribuind astfel la deformarea matricei și a ATP citosolic (Figura 3). Prin urmare, deschiderea KATP în timpul ischemiei, de exemplu promovată de diazoxid, menține volumul EIM, reduce rata de pierdere ATP, reduce rata de degradare a nucleotidelor de adenină în așa fel încât să existe rezerve ADP pentru ulterior Fosforilarea în timpul reperfuziei și, în final, reduce schimbările în potențialul membranei mitocondriale și acumularea de CA ++, împiedicând supraîncărcarea calciului, deoarece ATP rămâne în concentrații adecvate pentru funcționarea minimă de Na + / K + ATPasa și alte pompe.
Aceste efecte păstrează funcția mitocondrială și, în acest fel, se poate confrunta cu reperfuzie cu rezultate mai bune fiziopatologice. În timpul reperfuziei, deschiderea ulterioară a canalelor KATP permite compartimentarea nucleotidelor de adenină, ceea ce înseamnă că prima sursă de energie este fosfat din fosfocreatină și nu ATP (conducătoare scăzută a VDAC (23), Figura 3).
Prin urmare, activarea canalelor ATP mitocondriale în timpul ischemiei-reperfuzia previne formarea porilor permeabilității tranzitorii prin inhibarea stresului oxidativ, declanșată de venitul CA ++ (18,23,24).
Vanden Hoek și colab. Ei au arătat că creșterea radicalilor liberi în mitocondriile în timpul precondiției ischemice a fost necesară pentru a proteja miocusul împotriva unui stres oxidativ ulterior în timpul reperfuziei.Acesta este modul în care a fost ipoteza că există două etape în eliberarea radicalilor liberi, prima care contribuie la deschiderea canalelor de potasiu sensibile la ATP și ulterior în timpul repecuției, care este dăunător și declanșează apoptoza și apoptoza cardiacă ( 42). În membrana sarcoscică a miocitelor cardiace și a mușchiului neted, deschiderea canalelor de potasiu, promovează, de asemenea, efecte de protecție.
Hiperpolarizarea celulară care împiedică supraîncărcarea ca ++ intracelulară, scăzând durata potențialului de acțiune, limitarea celulară daune și conservarea rezervelor de energie celulară și, prin urmare, supraviețuirea miocității. În plus, această secvență poate fi atât acută, cât și cea cronică (8,42,44). La nivel vascular, deschiderea acestor canale promovează vasodilatarea, datorită hiperpolarizării celulare și reducerii intrării de CA ++, cu o creștere coronariană crescută și scăderea încărcării.
Perspective clinice
Datorită proprietăților combinate ale cardioprotecției și vasodilatizării, medicamentele care permit deschiderea canalelor de potasiu (KCO) ar putea fi luate în considerare pentru anumite condiții cardiace (Tabelul 2). Acestea includ protecția miocardică sub circulație extracorporeală, conservarea cardiacă a donatorului în transplantul cardiac, tratamentul bolii ischemice cardiace, hipertensiune arterială sistemică și pulmonară, boli vasculare periferice și aritmii legate de repolarizarea anormală (41-50).
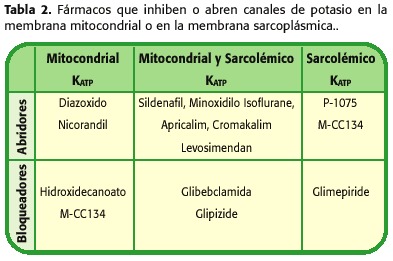
În chirurgie cardiacă, KCO ar putea juca un rol important Soluții Cardioplegia. În mai multe modele de chirurgie cardiacă cu circulație extracorporală, mai multe Koc, incluzând Nicorandil, Aprikalim și Pinacidil, au promovat o mai mare cardioprotecție decât cu cardioplexia convențională (51,52).
la pacienții care au fost efectuați Chirurgie Poduri (bypass) coronar Timpul necesar pentru a atinge arestul cardiac, modificările în segmentul ST după strângerea aortice, nivelurile plasmatice ale CPK-MB și doza de agenți inotropi, au fost minore decât grupul tratat cu Nicorandil comparativ cu comenzile tratate cu terapie convențională ( 53).
Utilizarea soluțiilor cardiopolice cu KCO, cum ar fi diazoxidul, minoxidilul (54), propofolul (care inhibă supraîncărcarea calciului ++ (36)), magneziu (care inhibă supraîncărcarea calciului37), digitalienii (care încurajați cardioprotecția prin căile de semnalizare celulară care converg cu cele ale KCO (23,55)), piruvat (care încurajează acidoza intracelulară și Standardizarea gradului de pH prin închiderea MPTP (38)), inhibitorii contra-transportor Na + / H ++ cum ar fi amilorida (care evită, de asemenea, pierderea efectului scăzut de protecție a scăzutului), adenozina (care este, de asemenea, un KCO , acționând prin proteinele G, previne supraîncărcarea calciului, deoarece cardioplegia hiperpoimică promovează (52,56)), pot fi obiective puternice pentru conservarea funcției cardiace în intervenții chirurgicale cu risc ridicat și poate evita complicațiile potențial muritori, cum ar fi sindromul de cheltuieli post-pompă și multe altele, cu reducerea costurilor economice prin reducerea șederii spitalului.
Pe de altă parte, utilizarea antioxidanților par a fi benefică numai în anumite circumstanțe, deja că utilizarea sa în studiile de laborator a blocat pre-acoperirea ischemică , deoarece radicalii liberi sunt eliberați în cantitate mai mică (23,25).
în sindromul coronarian acut, valoare Din KCO este mai bine documentată clinic cu Nicorandil, care sa dovedit a fi benefic cu efecte adverse minime asupra manipulării anginei stabile și instabile (57). Într-un studiu multicentric care implică mai mult de 5.000 de pacienți cu un angor stabil, utilizarea pe termen lung a lui Nicorandil a fost asociată cu reducerea evenimentelor cardiovasculare, cum ar fi moartea cardiacă, infarctul miocardic și spitalizarea datorită durerii toracice (58,59).
in Pacienții cu furie instabilă, Nicorandilul adăugat la un tratament agresiv anti-ischemic a redus episoadele ischemiei miocardice / necrozei și aritmii în comparație cu pacienții tratați cu terapie convențională. La pacienții supuși angioplastiei coronariene, Nicorandil a predominat inima, hemodinamica coronariană îmbunătățită și a conservat viabilitatea miocardică înainte de reperfuzie (60,61,62).
Nicorandil scade, de asemenea, preîncărcarea și încărcătura, crește eliberarea nitrică Oxidul de către celulele endoteliale și, spre deosebire de nitroglicerină, nu dezvoltă toleranță față de efectele sale antiaginești (63).
În angina vasospastală, Nicorandil este un vasodilator puternic și sa demonstrat că scade episoadele de variante de angină, scade modificările segmentului ST și îmbunătățește perfuzia coronariană. KOC au demonstrat, de asemenea, rezultate mai bune în chirurgia by-pass coronariană folosind grefele arteriale (artere toracice interne, gastroepilice, radiale), deoarece evită vasospasmul ulterior (64,65,66)). Experiența și datele științifice sunt necesare cu ajutorul KCO în aceste situații clinice.
Activarea KATP SARCOLEMIC este responsabilă pentru curentul electric care subliniază înălțimea segmentului ST, indicatorul clasic electrocardiografic al deteriorării ischemice transmurate miocardice ( 41). Pacienții cu diabet zaharat tratați cu sulfoniluree și care sunt infarctul acut la miocard, prezintă o magnitudine atenuată în altitudinea ST, ceea ce face dificilă diagnosticarea inițială, deoarece sulfonilureele sunt inhibitori ai canalelor KATP dependente (41).
Concluzie
Ca practic toate bolile umane, terapeutica bolii ischemice cardiace se bazează pe noi cunoștințe în fiziologia și fiziopatologia celulară. Modularea canalelor KATP este un proces critic în homeostazia metabolică a celulei și în conformitate cu cercetarea biomedicală diluează noi concepte despre structura, funcția, reglementarea și selectivitatea țesutului acestor canale, noii agenți terapeutici pot fi dezvoltați cu avantaje uriașe pentru populație la risc.
referințe
1. Ardehali H, O’Rourke. Mitocondrial Katp canale în supraviețuirea și moartea celulelor. J Mol Cell Cardiol 2005; 39: 7-16.
2. Kloner RA, Bolli R, Marban E, Reinilib L, Braunwald E. Implicații medicale și celulare ale uimitorului, hibernațiilor și precondiționării: un atelier NHLBI. Circulație 1998; 97: 18: 48-67.
3. Murray Ce, Jennings Rb, Reiner Ka. Preconcondiționarea cu ischemia: o întârziere a rănirii celulelor letale în miocardul ischemic. Circulația 1986; 74: 11: 24-36.
4. Cogan mg. Lichide și electroliți: fiziologie și fiziopatologie. Manual modern. Mexic, 1993; 145-168.
5. Sansom MSP, Shrivastava ih E la. Canale de potasiu: structuri, modele, simulări. BIOCHIMICA ET BIOPHYSICA ACTA 2002, 1565: 294-307.
6. Biggin PC, ROOSILD T, CHOE S. Structura canalului de potasiu: domeniu după domeniu. Avizul curentă Biologie structurală 2000, 10: 456-461.
7. Giblin JP, LEANEY JL și TINKER A. Ansamblul molecular al canalelor de potasiu sensibile la ATP: determinanți pe subunitatea de formare pare a. J Biol Chem 1999, 274: 22652-22659.
8. CHOE S. Structurile canalului de potasiu. NAT REV Neuroscience 2002, 3: 115-121.
9. Lousouarn g, Rose T, Nichols CG. Baza structurală de rectificare continuă a canalului de potasiu. Tendințe Cardiovasc Med 2002; 12: 253-258
10. Nishida M, Mackinnon R. Baza structurală a rectificării interioare: Pore citoplasmatică a redresorului GIRK1 GIRK1 în interiorul proteinei G la 1.8 la rezoluție. Celula 2002; 111: 957-965.
11. Yamada M, Inanobe A, Kurachi Y. G Reglementarea proteică a canalelor de ioni de potasiu. Recenzii farmacologice 1998; 50: 724-747.
12. Bichet D, Hass F, Yeh Jan L. fuzionarea studiilor funcționale cu structuri de redresor de interior K + canale. Nature Comentarii 2003; 4: 957-67.
13. Aguilar-Bryan L, Clement IV J, González G, Kunjilwar K, Babenko A, Bryan J. spre înțelegerea asamblării și structurii canalelor KATP. Recenzii fiziologice 1998; 78: 227-242.
14. ELIZARI M, Chiale P. Aritmii cardiace: fundamente, diagnostic și tratament celular și molecular. Panamericana, Buenos Aires, 2003; 31-40.
15. Campbell JD, Sanson MSP, Ashcroft F. Reglementarea canalului de potasiu. Nature Comentarii 2003; 11: 1038-1042.
16. Méndez Je, Zedón Sf, Zamora JF, Cortés VA. O abordare a kineticului oxigenului Partea 1. Rev Costarr Carridiol 2004; 6: 27-32.
17. Suleiman M, Haletrap AP, Griffiths E.J. Mitocondriile: o țintă pentru protecția miocardului. Farmacologie și terapeutică 2001; 89: 29-46.
18. Haletrap AP, Clarke J, Sabzali A, Javadov A. Transformarea permeabilității mitocondriale Păzduială deschiderea în timpul reperfuziei miocardice: o țintă pentru cardioprotecție. Cardiovasc 2004; 61: 372-385.
19. Brookes P, Yoon și, Robotham J și colab. Calciu, ATP și ROS: un triunghi de dragoste mitocondrial-ură. AM J Physiol Cell Physiol 2004; 287: C817-C833.
20. Hunter Dr și Haworth Ra. Tranziția membranei indusă de CA ++ în mitocondriile I. Mecanismele de protecție. Arc Biochem Biofys 1979; 195: 453-459.
21. Hunter Dr și Haworth Ra. Tranziția membranei indusă de CA ++ în Mitocondria II. Natura site-ului declanșator CA ++. Arc Biochem Biofys 1979; 195: 460-67.
22. Hunter Dr și Haworth Ra. Tranziția membranei indusă de CA ++ în Mitocondriile III.CA ++ de tranziție relase. Arc Biochem Biofys 1979; 195: 468-77.
23. Garlid KD, Dos Santos P, Xie ZJ, Costa A, Piutik P. Transport de potasiu mitocondrial: rolul canalului K + sensibil la Mitocondrial în funcția cardiacă și cardioprotectie. Biochem Biophys ACTA 2003; 1606: 1-21.
24. Macfallas E, Liem d și colab. Funcția mitocondrială: inima conservării miocardice. J Lablin Clin Med 2003; 142: 141-9.
25. Facundo H, Fornazari M, Kowaltowski A. Protecția țesutului mediat de canale K + Mitocondrial K +. Biochem Biophys ACTA 2005; 1701: 1-11.
26. Halestrap ap. Tranziția permeabilității mitocondriale: mecanismul său molecular și rolul în leziuni de reperfuzie. In: Brown GC, Nicholls DG, COOPER CE, editori. Mitocondriile și moartea celulelor. Simpozia Societății Biochimice. Londra: Presa Portland; 1999, voi. 66, p 181- 203.
27. Halestrap AP, Mcstay GP, Clarke SJ. Complexul de pornire de permeabilitate: o altă vizualizare. Biochimie 2002; 84: 153-66.
28. Halestrap AP, Kerr PM, Javadov S, Woodfield Ky. Elucidarea mecanismului molecular al porilor de tranziție permeabilității și rolul său în leziunea de reperfuzie a inimii. Biochim Biophys ACTA 1998; 1366: 79-94.
29. HaleStrap AP, Brenner C. Translucaza de adenină nucleotidă: o componentă centrală a porilor de tranziție a permeabilității mitocondriale și a jucătorului cheie în moartea celulelor. Curr Med Chem 2003; 10: 1507-25.
30. Ducen, McGuinness o, Brown La, Crompton M. privind implicarea unui pori mitocondrial sensibil la o rănire a reperfuziei miocardice. Cardiovasc res 1993; 27: 1790-4.
31. Lemasterii JJ, Nieminen al, Qian t, Trost LC, Herman B. Tranziția permeabilității mitocondriale în leziuni toxice, hipoxice și de reperfuzie. MOL Cell Biochem 1997; 174: 159-65.
32. Lemasterii JJ, Trollingger Dr, Qian T, Cascio Noi, Ohata H. Imagistica confocială a CA2 +, PH, Potențialul Electric și Permeabilitatea membranei în celule unice. Metode Enzymol 1999; 302: 341-58.
33. Xu MF, Wang Yg, Hirai K, Ayub A, Ashraf A. Precondiționarea calciului inhibă tranziția și apoptoza permeabilității mitocondriale. Am J fiziol 2001; 280: H899-908.
34. Miyata h, Lakatta, de exemplu, Stern MD, Silverman HS. Relația de calciu liber mitocondrial și citosolic la recuperarea miocitelor cardiace după expunerea la anoxie. Circ Res 1992; 71: 605-13.
35. Griffiths EJ, Ocampo CJ, Savage Js, et al. Căile de transport de calciu mitocondrial în timpul hipoxiei și reoxigenarea în cardiomiocitele cu un singur șobolan. Cardiovasc res 1998; 39: 423-33.
36. Lim KHH, Modi P, Nicholson E, și colab. Un model de porci de arestare cardiopolgică de sânge cald pentru a investiga efectele cardioprotectoare ale propofolului. J Physiol 2001; 536p: 82p.
37. Headrick JP, McKirdy JC, Willis RJ. Efectele funcționale și metabolice ale magneziului extracelular în miocardul normoxic și ischemic. Am J fiziol 1998; 275: H917-29.
38. Mallet Rt. Pyruvat: protector metabolic al performanței cardiace. PROC SOC EXP Biol Med 2000; 223: 136- 48.
39. Oldenburg O, Cohen M et al. Mitocondrial KATP canale: rolul în cardioprotecție. Cardiovasc res 55: 429-437, 2002.
40. Mensări J, McLeod C, sacul N. Plasticitate mitocondrială în precondiționarea clasică ischemică care se deplasează dincolo de canalul KATP mitocondrial. Cardiovas res 2003; 59: 1-6.
41. Kane G, Liu X, Yamada S, Olson T, Terzic A. Canale cardiace KATP în sănătate și boală. J Mol Cell Cardiol 2005; 38: 937-943.
42. Wang Y, Haider H, Ahmad N, ASCHRAF M. Mecanisme de către Wich Katp Canal Openers produc cardioprotecție acută și întârziată. Vasculare Farmacologie 2005; 42: 253-264.
43. Vanden Hoeck T, Becker L.B, Shao Z, Schumacker P. Speciile reactive de oxigen eliberate din mitocondriile în timpul scurtei hipoxie induce precondiționarea în cardiomiocite. J Biol. Chem. 1998; 273: 18092-98
44. Jahangir A, Terzic A. Katp Channel Therapeutics la noptieră. J Mol Cell Cardiol 2005; 39: 99-112.
45. Kane GC, Behfar A, Yamada S, Perez-Terzic C, O’Cochlain F, și colab. Hoenicke Em, Sun XW, RG ciudat, Damiano RJ. Conservarea cardiacă a donatorului cu o soluție nouă de hiperpolarizare: protecție superioară comparativ cu soluția Universității din Wisconsin. J Thorac Cardiovasc surg 2000; 120: 746-54.
46. Quast U, Guillon JM, Cavero I. Farmacologia celulară a canalului de potasiu Deschiderea unui mușchi neted vascular. Cardiovasc res 1994; 28: 805-10.
47. Okada Y, Yanagisawa t, Taira N. BRL 38227 (Levcromakalim) Hiperpolarizarea indică sensibilitatea la Ca2 + a elementelor contractile din artera coronariană Canine. Naunyn Schmiedebergs Arc farmacol 1993; 347: 438-44.
48. Donnelly R, Elliott Hl, Meredith PA, Reid Jl. Studii clinice cu activatorul canalului de potasiu Cromakalim la subiecții normotensivi și hipertensivi. J Cardiovasc Pharmacol 1990; 16: 790-5.
49. Simpson D, Wellington K.Nicorandil: O revizuire a utilizării sale în gestionarea anginării stabili pectorale, inclusiv a pacienților cu risc crescut. Droguri 2004; 64: 1941-55.
50. McCully JD, Levitsky S. Canalele de potasiu sensibile la Mitochondrial în cardioprotecție chirurgicală. Arch Biochem Biophys 2003; 420: 237-45.
51. Kevelaitis E, Oubentaissa A, Peynet J, Mouas C, Menasche P. Precondiționarea de către operii de canale de potasiu sensibil la Mitocondrial – o abordare eficientă pentru îmbunătățirea conservării transplanturilor de inimă. Circulație 1999; 100: 345- 50.
52. Steensrud T, Nordhaug D, Husnes KV, Aghajani E, Sorlie DG. Înlocuirea potasiului cu Nicorandil în Spitalul Sf. Thomas „Sf. Thomas” îmbunătățește conservarea energiei și a funcției în inimile de porcine. Ann Thorac Surg 2004; 77: 1391-7.
53. Hayashi Y, Sawa Y, Ohtake S, Nisuimura M, Ichikawa H, Matsuda H controlate Nicorandil Administrație Protecția formyocardică în timpul greforării by-passului coronarian sub bypass cardiopulmonar. J Cardiovasc Pharmacol 2001; 38: 21-8.
54. Garlid PD, Pauced P și colab. Efectul cardioprotector al diazoxidului și interacțiunea acestuia cu canalele K + sensibile la Mitochondrial: mecanismul sau cardioprotectia, Circ Res 1997; 81: 1072-182.
55. Interacțiunea XIC Z. Ouabain cu Na / K k-Atpasa cardiacă dezvăluie că enzima poate acționa ca o pompă și ca un traductor de semnal. Celula Mol Biol 2001; 47: 383-390.
56. Jovanovic A, López J, Alekseev A colab. Adenozina împiedică încărcarea CA21 indusă de K1: o perspectivă asupra cardioprotecției în timpul cardioplegiei. Ann Thorac Surg 1998; 65: 586-91.
57. Simpson D, Wellington K. Nicorandil: o revizuire a utilizării sale în gestionarea angineiului stabil, inclusiv pacienți cu risc crescut. Droguri 2004; 64: 1941-55.
58. Markham A, Plosker GL, Goa kl. Nicorandil – O revizuire actualizată a utilizării sale în boala cardiacă ischemică, cu accent pe efectele sale cardioprotectoare. Droguri 2000; 60: 955-74.
59. Grupul de studiu Iona. Procesul de a arăta impactul lui Nicorandil în Angina (Iona): design, metodologie și management. Inima 2001; 85: E9.
60. ITO H, Taniyama Y, Iwakura K, Nishikawa N, Masuyama T, și colab. Intravenos Nicorandil poate păstra integritatea microvasculară și viabilitatea miocardică la pacienții cu infarct miocardic anterior de perete reperfuzat. J Am Coll Cardiol 1999; 33: 654-60.
61. Schlepper M, Thormann J, Berwing K, Strasser R, Mitrovicv. Efectele lui Nicorandil asupra perfuziei regionale și a funcției ventriculare stângi. CARDIOVASC DRUMURI 1995; 9: 203-11.
62. Sakatay, Kodama K, Komamura K, Limyj, Ishikura F, și colab. Efectul salutar al administrației adjuvante intracoronare Nicorandil la restaurarea fluxului sanguin miocardic și îmbunătățirea funcțională la pacienții cu infarct miocardic acut.Am Heart J 1997; 133: 616-21.
63. Simpson D, Wellington K. Nicorandil: o revizuire a utilizării sale în gestionarea angineiului stabil, inclusiv pacienți cu risc crescut. Droguri 2004; 64: 1941-55.
64. Kaski JC. Gestionarea anginei vasospastice a rolului Nicorandil. CARDIOVASC DRUMURI 1995; 9: 221-7.
65. Chen JW, Lee Wl, Hsu NW, Lin SJ, Ting CT, Wang Sp, și colab. Efectele tratamentului pe termen scurt al Nicorandilului asupra ischemiei miocardice indusă de exercițiu și activitatea autonomă cardiacă anormală în angina microvasculară. Am J cardiol 1997; 80: 32-8.
66. Akar F, Uydes-Dogan Bs, Tufan H, Aslamaci S, Koksoy C, Kanzik I. Comparația răspunsului la mamar intern izolat uman și a arterelor gastroepilice la Levcromakalim: o abordare alternativă a managementului spasmului de grefă. BR J Clin Pharmacol 1997; 44: 49-56.
un departament de Fisiología, Universidad de Cienciias Médicas (UCIMED), Sabana Oeste, San José, Costa Rica. Teléfono (506) 296-3944, e-mail: [email protected], [email protected]
b cátedra de cirugía, Spitalul México, Ucimed, San José, Costa Rica.
c cátedra de ciruga, Spitalul México, Universidad de Costa Rica (UCR), San José, Costa Rica.
d Cátedra de Fisiopatología, Spitalul México, Ucimed Y UCR, San José, Costa Rica