Réponse de glucose / insuline à une glycémie de surcharge chez les sujets avec le risque de diabète Type 2.
Elena Ryder, Maria Esther Gómez, Virginia Fernández, Gilberto Fields, Marina Morina, Humberto Valbuena et Xiomara Raleigh.
Institut de recherche clinique « Dr. Américo Negrette « , Faculté de médecine, l’Université de Zulia, Maracaibo, Venezuela.
résumé.
Afin de déterminer l’effet de certains facteurs de risque pour le diabète de type 2, tels que l’histoire de la famille, l’obésité et la dyslipidémie, sur la réponse glycémique et insuline à une surcharge de glucose, 135 personnes ont été étudiées (77 femmes et 58 Les hommes) âgés de 20 à 68 ans, avec des glycémies de base inférieures à 110 mg / dl, mais ont considéré le risque de diabète de type 2 pour présenter un ou plusieurs des facteurs susmentionnés. Nous avons constaté que la présence de tels facteurs de risque n’affectait aucun cas de la réponse glycémique, toutefois, à la fois des concentrations d’insuline basales ainsi que de la réponse post-chirurgicale a été affectée par l’obésité, à la fois chez les hommes et les femmes, augmentant de la forme significative ( p < 0.0001) Concentrations de l’insuline. La présence de la dissipépidémie a considérablement augmenté (p < 0.002) des concentrations de base et une réponse à l’insuline uniquement chez les hommes. Lorsque la coexistence d’antécédents familiaux du diabète de type 2 et de l’obésité était présente, les individus ont montré une diminution significative (p < 0,002) des valeurs basales et de la réponse à l’insuline. Nous concluons que sans modifier la réponse glycémique, la présence d’un facteur de risque telle que l’obésité, la dyslipidémie ou l’histoire familiale du diabète conduit à une hyperinsulinémie basale et stimulée par le glucose, tandis que la coexistence d’obésité et d’histoire familiale produit un déficit de sécrétion de l’insuline.
Mots-clés: réponse glucose-insuline, obésité, fond de diabète, hyperinsulinémie, dyslipidémie.
Réponse de la glycémie-insuline à un défi de glucose chez les personnes à risque de diabète de type 2.
Résumé.
Dans le but de la compté de la manière dont certains facteurs de risque pour le diabète de type 2, tels que les antécédents familiaux du diabète, l’obésité et la dyslipidémie, affectent la réponse à l’insuline de glucose à un défi de glucose, 135 individus (77 femmes et 58) Les hommes ont été étudiés. Leurs âges variaient de 20 à 68 ans, leurs valeurs glycémiques basales étaient inférieures à 110 mg / dl, mais elles envisagaient à un risque de diabète en raison de la présence d’un ou de plusieurs de ces facteurs. Nous avons constaté que l’autre des facteurs de risque n’affectait aucun cas dans la réponse glycémique. Cependant, les niveaux d’insuline basale ainsi que les valeurs post-défi ont été étonnés de manière significative (p < 0,0001) par la présence d’obésité chez les hommes ainsi que chez les femmes. La dyslipidémie a augmenté les valeurs de l’insuline de glucose basale et post défi uniquement chez les hommes (p < 0,002). La coexistence d’obésité et d’antécédents familiaux du diabète a provoqué une diminution des niveaux d’insuline basale ainsi que dans la réponse à l’insuline au glucose. Nous concluons que, sans modification de la réponse glycémique, la présence de facteurs de risque que l’obésité, la dislipidémie ou l’histoire familiale du diabète conduit à une hyperinsulinémie basale, ainsi que de l’hyperinsulinémie stimulée du glucose, mais la coexistence d’obésité et d’histoire familiale du diabète est responsable. Pour le déficit de la sécrétion de l’insuline par le pancréas.
mots clés: réponse de glucose-insuline, obésité, histoire familiale du diabète, hyperinsulinémie, luxipidémie.
reçu: 30-05-2001. Accepté: 02-10-2001.
Introduction
Le critère de diagnostic destiné au diabète mellitus type 2 selon le groupe de données nationales du diabète ou qui a été modifié ces dernières années. Ces critères examinés sont les suivants: a) Les symptômes de diabète tels que la polyurie, la polydipsia et la perte de poids inexplicable, ainsi qu’une concentration de glucose plasmatique décontractée supérieure à 200 mg / dl (11,1 mmol / l); b) Fermeture de la concentration de glucose d’au moins 8 heures égales ou supérieures à 126 mg / dl (7,0 mmol / l) et c) une glycémie 2 h après un test de surcharge de glucose (75 g dissous dans de l’eau) supérieure à 200 mg / dl (11.1 mmol / l) (1).
D’autre part, dans des études épidémiologiques, l’estimation de la prévalence du diabète et son incidence doit être basée sur un échantillon de glucose à jeun égal ou supérieur à 126 mg / dl (7,0 mmol / l). Cette recommandation est faite pour faciliter le travail sur le terrain, en particulier lorsqu’un test de surcharge de glucose oral est difficile à effectuer.Toutefois, cette approche conduirait à une sous-estimation de la prévalence à laquelle il serait obtenu si le test de surcharge de glucose plasmatique et de glucose oral (1) de jeûne est combiné.
Les experts reconnaissent également un groupe intermédiaire de sujets, dont les concentrations de glucose bien qu’elles n’atteignent pas le critère de diabète, sont néanmoins très élevées pour être considérées comme normales. Ce groupe serait, ceux qui ont un glucose à jeun supérieur à 110 mg / dl (6,1 mmol / l) mais moins de 126 mg / dl, auxquels ils seraient considérés comme altéré de glucose basale altéré et si, à 2 heures plus tard, d’une orale Le test de la surcharge de glucose Les chiffres de glycémie sont égaux ou supérieurs à 140 mg / dl, mais moins de 200 mg / dl seraient considérés comme un test de surcharge de glucose altéré.
D’autre part, le diabète de type 2 à un pourcentage élevé de cas avec résistance à l’insuline (IR), caractérisé par un état d’hyperinsulinémie compensatoire. Cependant, lorsque le tableau progresse, il y a un déficit de sécrétion de l’insuline, comme dans les cas connus sous le nom de Lada (diabète d’autocité tardive de l’adulte).
On sait également que certaines situations métaboliques sont capables de modifier la réponse à l’insuline, en raison de la présence de l’état de résistance à l’insuline, comme dans l’obésité ou lorsqu’il y a une altération de la cellule bêta qui mène à une production d’insuline inférieure, comme c’est le cas des dyslipidémies.
Par conséquent, en plus des déterminations de glycémie lors d’un test de surcharge de glucose, il est pratique de mesurer les concentrations d’insuline pour connaître l’état de sécrétion de cellules bêta à travers la surcharge de glucose à la surcharge de glucose.
Les études précédentes effectuées dans notre laboratoire ont montré que les membres de la famille d’origine hispanique présentaient, dans une forme précoce, des modifications de plusieurs paramètres considérés comme un risque de diabète de type 2 tels que l’hyperinsulinémie, l’obésité, la dyslipidémie et les altérations de la pression artérielle ( deux).
Pour cette raison, nous avons proposé dans cette étude, déterminer les caractéristiques des réponses glycémique et d’insuline à une surcharge de glycémie chez les personnes ayant un risque de diabète de type 2, car ils seraient familiers avec les diabétiques de type 2, obèses et Dyslipidémique, pour savoir comment ces facteurs de risque modifient cette réponse.
échantillon et méthodes
135 individus ont été étudiés (77 femmes et 58 hommes) âgés de 20 à 68 ans et de glycémie basale inférieure à 110 mg / dl, mais sont considérés comme un risque de type 2 Diabète, c’est-à-dire: des parents au premier degré de diabétiques de type 2, dyslipidémiques et / ou obèses qui ont assisté à un centre de référence de la maladie métabolique, tels que la section de biochimie, de l’Institut de recherche clinique, de la Faculté de médecine, de l’Université de Zulia, à Maracaibo, au Venezuela. Les personnes qui ont présenté certaines des modifications suivantes ont été considérées comme des dyslipidémies: chiffres totaux de cholestérol > 200 mg / dl, tg
Tous les individus après un jeûne de 10 à 12 heures, ont été soumis à une surcharge de glucose buccale avec l’ingestion de 75 g de glucose (glycolab, vénézua) dans 300 ml d’eau, lors de l’extraction d’un sang basal Un échantillon dans lequel le profilé de glucose, d’insuline et de lipidique a été déterminé dans le sérum. Des échantillons de sang ont ensuite été pris à 30, 60 et 120 minutes. Après l’ingestion de glucose, pour déterminer la glycémie et l’insuline dans le sérum.
pour la détermination de la glycémie et du profil lipidique, des méthodes commerciales de l’homme humain (GmbH humain, de l’Allemagne) ont été utilisées et pour la détermination de l’insuline, les radioimmunoisis en phase solide de produits de diagnostic (DPC).
Analyse statistique
pour l’étudiant « T » a été utilisée pour des données non couplées et pour les associations, le test de corrélation Pearson, utilisant le programme statistique du programme 3,0
Résultats
Les caractéristiques physiques des femmes et des hommes à l’étude sont décrites dans le tableau I. L’âge moyen était d’environ 40 ans et l’IMC dans 32 kg / m2, il n’y a pas de différence entre les deux groupes.
les classant dans obèses ceux avec IMC > 25 kg / m2 et non obèse si votre IMC était de 25 kg / m2 Les caractéristiques physiques ont abouti au tableau II . 81,8% (63/77) des femmes et 86,2% (50/58) des hommes étaient obèses.Le groupe des femmes obèses avait un âge moyen supérieur à celui des non-obèses, bien que cette différence n’ait pas été statistiquement significative, alors que chez les hommes obèses, l’âge moyen était moins élevé, mais également non significatif.
Tableau I
Caractéristiques physiques de la population Sous étude
variable
femmes
Hommes
p
n
Âge (années)
36.8 ± 11.2
(20-66)
40,3 ± 11,2
(23 – 68)
ns
imc (kg / m2)
32,2 ± 8,5
(17.3 – 51,6)
31,8 ± 6, 4
(22,2 – 54,6)
ns
t étudiant pour des données inégalées. Programme statistique stat le plus 3.0. Dans la paradisie, la gamme est indiquée.
La glycémie basale et la réponse à l’insuline et à l’insuline de glucose, obtenues chez cette classification de son IMC, est présentée à la Fig. 1. Chez les femmes, aucune différence significative n’a été observé entre la réponse glycémique de l’obèse par rapport aux non obèses; Bien que, dans ce dernier, la réponse à l’insuline était significativement plus élevée.
Ainsi, les valeurs de la glycémie basale allaient entre 62 et 106 mg / dl (83,07 ± 13,26 mg / dl) en non obèses et 64 et 110 mg / dl (84,0 ± 11,08) Dans l’obèse. Dans ces derniers, des chiffres ont été atteints dans la réponse glycémique, supérieure à 200 mg / dl dans 3 cas (0,02%), étant ses glycémies basales de 94, 103 et 108 mg / dl. La concentration moyenne de l’insuline basale pour non obèse était de 10,0 ± 4,76 μU / ml (plage = 3,56 à 19,5 μU / ml) et pour les obèses de 19,7 ± 21,9 μU / ml (plage = 2,9 à 168 μU / ml), résultant statistiquement différent (p < 0,001). 14,3% des objectifs minces et 50,8% des obèses ont présenté des concentrations d’insuline basale supérieure à 14 μU / ml, limite établie dans notre laboratoire comme base normale.
Tableau II
Classification des individus selon l’indice de masse corporelle
|
variable |
Femmes |
hommes |
||||
|
IMC £ 25 |
imc > 25 |
IMC £ 25 |
imc > 25 |
|||
|
n |
||||||
|
Âge (années) |
33,4 ± 9,8 |
37,5 ± 11.4 |
46, 2 ± 18.3 |
39.3 ± 9.5 |
||
|
IMC (kg / m2) |
21.9 ± 2.4 |
34.9 ± 6.5 |
24,1 ± 1.1 |
33,1 ± 6.0 |
||
|
variable |
Femmes |
p |
hommes |
p |
||
|
sans CONTEXTE |
avec arrière-plan |
« 4eb4ae2491 »>
sans Contexte |
avec CONTEXTE |
|||
|
x ± de |
x ± ± de |
x ± de |
x ± ± de |
|||
|
n |
||||||
|
Âge (années) |
33,5 ± 11 |
37,4 ± 11.1 |
ns |
35,7 ± 7,8 |
41,2 ± 11,6 |
ns |
|
IMC (kg / m2) |
39,1 ± 8,5 |
30,9 ± 7,9 |
0.0001 |
34,8 ± 5,0 |
31,2 ± 6,5 |
Ns |
t pour les données sans pareil. Statistique du programme statistique 3.0.
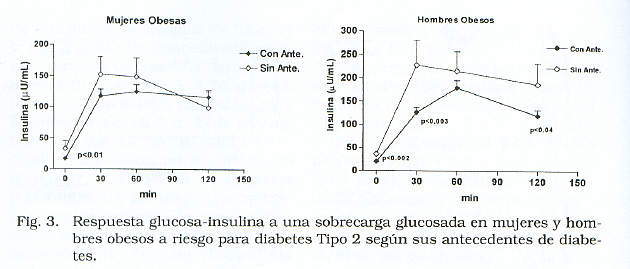
En séparant le groupe des femmes et des hommes obèses et en les classant comme ils présentés ou des antécédents non familiaux du diabète de type 2 (Figure 3), pour voir s’il y avait un effet supplémentaire de le facteur génétique du facteur de l’ obésité; Il a été observé que ceux qui avaient des antécédents de diabète de type 2, a montré non seulement des concentrations plus faibles de l’ insuline basale, mais la réponse à l’insuline était également plus faible, en particulier chez les hommes, où la différence était très significative, ce qui indiquerait que le facteur génétique En présence d’obésité peut entraîner un déficit de sécrétion de l’insuline. L’analyse de corrélation de Pearson a montré que, dans ce groupe d’obèses, chez les hommes et les femmes, les valeurs d’insuline n’étaient pas associées à l’IMC.
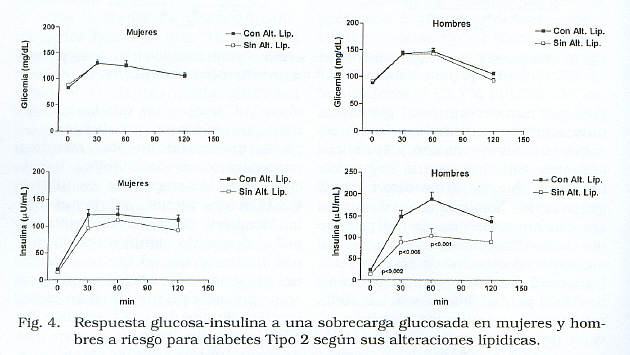
En ce qui concerne la présence d’altérations lipidiques, nous constatons que 79,2% (61/77) des femmes avaient des altérations lipidiques, alors que seulement 20,8% (16/77) ne l’ont pas montré. Dans le cas des hommes, la proportion était similaire, 81% (47/58) avaient des modifications tandis que 18,96% (11/58) ne l’ont pas présentée.
La présence d’altérations lipidiques n’a pas affecté la réponse glycémique ou de l’ insuline chez les femmes, ni la réponse glycémique chez les hommes, alors que Dans ces derniers, la réponse à l’insuline était significativement plus élevée, à la fois sur la base de valeurs basales et à 30 et 60 minutes (fig. 4). Les chiffres de base d’insuline chez les hommes sans altérations lipidiques ont été 13,15 μ 1,7 uU / ml (gamme: 4.5 à 27), alors que dans lequel ils ont présenté était de 22,5 ± 2,4 (Gamme: 4.5 à 77) (p < 0,002).
discussion
études réalisée par Lillioja et al (4) à Pima Indiens, qui ont un fonds génétique d’obésité, ont montré que l’intolérance au glucose observée dans ces sujets obèses était principalement due à une réduction Dans l’action périphérique de l’insuline, tandis que la fonction de sécrétion du pancréas était normale, mais cette situation peut initier un cycle conduisant à un déficit de la réponse des cellules bêta et de l’apparence du diabète.
D’autre part, depuis 1990, le groupe Kahn dans le Centre de diabète Joslin (5) a établi qu’une ou même deux décennies avant le diabète est diagnostiquée, le type 2 est déjà observé dans la famille de diabétiques une capacité réduite. de la consommation de glucose, accompagnée de l’hyperinsulinémie, suggérant un défaut primaire dans la réponse du tissu périphérique à l’insuline et au glucose, et non dans la cellule bêta.
Cependant, en 1995, Pimentat et al (6) dans une étude menée chez des personnes d’origine européenne, des proches au premier degré de diabétiques de type 2, ils concluent qu’il s’agit d’un dysfonctionnement de la bêta-cellule de lésion génétique primaire Dans le diabète de type 2 et non altération de la sensibilité à l’insuline. Ils discutent des résultats de Kahn et les attribuent à la présence d’obésité dans le groupe étudié; Ainsi, ils disent que la résistance à l’insuline n’est pas directement liée au développement du diabète en soi, mais est une conséquence de l’obésité.
Dans notre étude, malgré le traitement des personnes souffrant de risque de diabète de type 2, aucun cas n’a été trouvé avec une intolérance au glucose, probablement parce qu’il a été divisé des individus avec des personnages de glucose basale dans la plage normale, inférieure à 110 mg / dl.
Et si cela était notable était la présence d’hyperinsulinémie dans les réponses à la surcharge de glucose. Cette hyperinsulinémie était plus associée à la présence d’obésité chez les hommes et les femmes, cependant, lorsque l’obésité et une histoire de diabète de type 2 ont été combinées, à la fois des figures d’insuline basales et de la réponse à l’insuline étaient mineures, ce qui indique que chez les individus où ces deux facteurs de risque sont superposés, un déficit est observé dans la sécrétion de l’insuline.
Eriksson et al (7) Lors de la tentative d’identification des défauts métaboliques précoce des sujets de risque pour le diabète de type 2, ils ont conclu que bien que la résistance à l’insuline précède manifestement la carence en insuline, on ne peut pas dire que l’insuline -resistance conduit à une carence en insuline, mais dans tous les cas, une altération de la tolérance au glucose se développe avant la modification du rôle de la cellule bêta.
Dans ce travail, il a été constaté qu’un déficit peut être observé dans la sécrétion d’insuline, sans modifier la réponse glycémique, probablement en raison du chevauchement des facteurs de risque. De sorte que ces résultats soutiennent la prise en compte d’Elbein et al (8) que les personnes ayant une prédisposition génétique pour le diabète montrent une réponse compensatoire réduite de la cellule bêta à la sensibilité réduite à l’insuline associée à l’obésité et proposent ainsi que cette indemnisation modifiée peut être l’une des les manifestations du défaut génétique chez des individus sensibles. Cette constatation aide à expliquer l’effet multiplicateur de l’histoire de la famille et de l’obésité dans le risque de diabète.
Dans une étude réalisée par Grill et al. (9) Il a été constaté que chez les sujets avec le diabète de type 2, la présence d’antécédents familiaux du diabète était associée à une diminution de la sécrétion d’insuline plutôt qu’avec la résistance à l’insuline. Ces résultats sont compatibles avec un rôle plus important dans une faible décharge d’insuline dans l’influence diabétogène d’une histoire familiale de diabète chez les hommes d’âge moyen (35-54 ans) en Suède. Ils concluent en disant que le risque élevé de diabète présentée par les individus d’âge moyen, avec l’histoire de la famille et l’obésité, rend impératif d’être identifié dans la population générale pour une intervention thérapeutique.
De même, Fernández-Castañer et al (10) avaient suggéré, par des études réalisées avec des proches au premier degré de diabétiques de type 2, que la dysfonctionnement des cellules bêta est le facteur clé de l’apparence et de la progression du diabète
Edelstein et al. (11) ont analysé plusieurs études prospectives et constater que l’incidence du diabète de type 2 augmente légèrement avec l’augmentation du glucose basal entre 5,2 et 6 mmol / L (83 mg / dl à 96 mg / dl) mais de manière très importante en passant au dernier quartile de 6,1 à 7,7 mmol / L (96,2 à 123 mg / dl) tandis qu’une augmentation linéaire de l’incidence est observée avec la glycémie à 2 h entre 7,8 mmol / L et 11 mmol / L, qui est compris entre 140 et 198 mg / dl.
Dans un travail effectué dans le but de comparer le comportement de la glycémie basale et du test de surcharge de glucose en tant que physicone de diabète chez les patients obèses, Mannucci et al. (12) conclure qu’une glycémie de 7,0 mmol / L ne montre pas une sensibilité suffisante pour le diabète physiquide chez les personnes obèses, tout en jetant 6 mmol / L, s’il a une sensibilité satisfaisante; Cependant, il est de ne pas diagnostiquer l’intolérance depuis, selon eux, l’altération de la glycémie basale a des caractéristiques physiopathologiques autres que l’intolérance au glucose et ne peut pas être supposée qu’elle a la même valeur pronostique que l’intolérance.
Il a été décrit que les états d’intolérance au glucose souscinés sont associés à un risque plus élevé de mortalité de 42 à 77% de tous types (13) et de 15 à 54% de risque plus élevé pour les maladies cardiovasculaires. Depuis 1990, douze études épidémiologiques relatives à la tolérance au glucose avec la mortalité ont été réalisées. Tous montrent un gradient de mortalité constant à travers les catégories d’incroyance intolérance. D’autres études ont également montré un risque accru de décès par des niveaux élevés de glucose à 2 h (13).
Dans cette étude Bien qu’il n’y ait eu aucun cas avec des chiffres de glycémie basale supérieurs à 110 mg / dl, 20 personnes (10/58 hommes = 17,2% et 10/77 femmes = 13%) avec des chiffres supérieurs à 96 MG / DL, mais seulement 9% chez les femmes et 5,2% chez les hommes avec des chiffres supérieurs à 140 mg / dl à 2 h après la surcharge, bien qu’aucun dépassait 198 mg / dl. Cependant, chez 10% des hommes obèses et seulement 0,02% des femmes obèses ont été obtenus de chiffres supérieurs à 200 mg / dl, mais à 30 ou 60 minutes, qu’en fonction des nouvelles conditions de l’association américaine diabète ne peut être considérée comme anormale. Pour cette raison, nous pouvons conclure que les chiffres de glycémie n’ont pas été modifiés dans notre population en danger.
concernant les valeurs d’insuline, les chiffres de base ont été trouvés dans une plage comprise entre 2,9 et 168 μU / ml chez les femmes (en fonction des facteurs de risque associés) avec une moyenne de 17, 9 ± 2,3 μU / ml et entre Les hommes, la plage était de 4,5 à 77,5 μU / ml, avec une moyenne de 20,8 ± 2,0 μU / ml. Si nous comparons ces chiffres avec ceux obtenus dans le programme de prévention du diabète (DPP) (14) pour la population hispanique d’Amérique du Nord, similaire en termes d’âge, d’IMC et d’histoire familiale du diabète, nous observons que nos chiffres sont similaires à ceux obtenus par eux entre eux des femmes, étant donné que la moyenne de l’insuline basale des Hispaniques de cette étude était de 168% de 168 pmol / L (28 μU / ml) d’une gamme de 32,4 à 720 PMOL / L (5,4 à 120 μU / ml) tandis que pour les hommes le DPP. Les chiffres sont assez élevés: 178 pmol / l (29,6 μU / ml) en moyenne, avec une gamme de 42,6 à 1,104 pmol / L (7,1-184 μU / ml).
L’étude de la Botnia (15) a révélé qu’environ 10% des courbes de tolérance individuelle de glucose présentaient un syndrome métabolique, étant plus fréquentes chez les hommes que chez les femmes (15 VS 10%). Ils ont également constaté que le risque de maladie coronarienne a augmenté trois fois chez les sujets présentant ce syndrome (obésité, dyslipidémie, hypertension et microalbuminurie), ainsi que la mortalité provenant de maladies cardiovasculaires. Par rapport aux sujets sans syndrome métabolique, la mortalité totale (18 vs.6, p < 0,001) et la mortalité cardiovasculaire (12 VS 2.2, P < 0,001) ont été augmentés chez les sujets liés au syndrome. Dans cette étude, la dyslipidémie était considérablement associée à la maladie coronaire, mais en particulier dans les diabétiques.
d’autre part HAFFner et al (16), analysant la conversion en diabète de type 2 de personnes atteintes d’une résistance à l’insuline, d’une déficience à l’insuline ou des deux, constatent que les changements athérogènes ont été principalement observés chez les personnes atteintes d’insulcité. Résistance, comme recommandé que les stratégies visant à prévenir le diabète de type 2 devraient se concentrer sur une intervention de sensibilisation insulaire et non à l’intervention qui augmente la sécrétion d’insuline, en raison de ses effets potentiels sur le risque cardiovasculaire.
Dans notre étude, bien que les chiffres de glucose basal étaient dans des limites normales, ainsi que des réponses glycémiques, le pourcentage élevé de diabète de type 2 (~ 83%), de modifications de lipides (~ 80%), de L’obésité (~ 85%) et une hyperinsulinémie basale et post-charge, placent ce groupe d’individus à haut risque, en particulier la population masculine.
Remerciements
au Conseil de développement scientifique et humaniste de l’Université de Zulia et de la conticence-Venezuela pour son soutien financier.
Références bibliographiques
1.Rapport du Comité d’experts sur le diagnostic et la classification du diabète sucré. Diabetes Care, 2000; 23 (SUP 1): S4-S19.
2. Florez H., Ryder E., Campos G., Fernandez V., Morales L.M., Valbuena H., Rincón E., Gomez M., Raleigh X.: Les femmes de la famille des patients hispaniques atteintes de diabète de type présentent des perturbations métaboliques. Invest Clin 1999; 40 (2): 127-142.
3. Consenso Venezolano de Lípidos. Bureau international des informations sur les lipides. Capítulo Venezuela. Parke Davis, 2000. PP 1-39.
4. Lillioja S., Mott D.M., Howard B.V., Bennett P.H., Yki-Jarvinen H., Freymond D., Nyomba B.L., Zurlo F., Swinburn B., Bogardus c.: La tolérance au glucose altéré en tant que trouble de l’action de l’insuline. Études longitudinales et transversales dans les Indiens de Pima. N Engl J Med 1988; 318: 1217-1225.
5. Warran J.H., Martin B.C., Krolewski A.S., Kahndner J.S., Kahn C.R.: Le taux d’élimination et l’hyperinsulinémie lent de glucose a précédé le développement du diabète de type II dans la progéniture des parents diabétiques. Ann Stagiaire Med 1990; 113: 909-915.
6. Pimenta W., Korytkowski M., Mitrakou A., Jenssen T., Yki-Jarvinen H., Evron W., Dailey G., Gerich J.: Dysfonctionnement du bêta-cellule pancréatique en tant que lésion génétique principale de Niddm. Preuve d’études sur des personnes normales tolérantes au glucose avec un parent NIDDM de premier degré. JAMA 1995; 273: 1855-1861.
7. Eriksson J., Franssile-Kallunki A., Ekstrand A., Saloranta C., élargir E., Schalin C., Grop l .: Des antécédents métaboliques précoces chez les personnes à risque accru de diabète dépendant non insulinique. N Engl J Med 1989; 321: 337-343.
8. Elbein S.C., Wegner K., Kahn S.e.: Réduction de la compensation de cellules B à la résistance à l’insuline associée à l’obésité chez les membres des chaînes diabétiques familiales de type 2 caucasiennes. Diabetes Care 2000; 23: 221-227.
9. Grill V., Persson G., Carlsson S., Norman A., Alvarsson M ,. Ostensson C.G., Svanstrom L., Efendic S.: Les antécédents familiaux du diabète chez les hommes suédois d’âge moyen sont un facteur indépendant de sexe qui associe à l’insulinopénie dans des sujets diabétiques nouvellement diagnostiqués. Diabetologie 1999; 42 (1): 15-23.
10. Fernandez-Castañer M., Biarnés J., Camps I., J. de Ripolles J., Gomez N., Soller J .: Dysfonctionnement Beta-Cell des proches de patients atteints de diabète de diabète non insulinique. Diabet Med 1996; 13: 953-959.
11. EDELSTEIN S.L., KOISLLER W.C., Bain R.P., Barrett-Connor E., Dowse G.K., Petttit D.J., Sorkin J.J., Muller D.C., Hamman R.F .: Prédicteurs de la progression de la tolérance au glucose altéré à NidDM. Une analyse de six études prospectives. Diabète 1997; 46: 701-710.
12. Mannucci E, Bardini G, Ognibène A, Rotella C.M .: Comparaison des méthodes de dépistage de l’ADA et de l’OMS pour le diabète sucré des patients obèses. Association américaine du diabète. Diabet Med 1999; 16: 579-585.
13. Saydah S.H., Loria C.M., Eberhardt M.S., BRANCATI F.L.: Sous des états cliniques d’intolérance au glucose et de risque de décès dans le diabète américain 2001: 24: 447-453.
14. Le groupe de recherche du programme de prévention du diabète. Le programme de prévention du diabète. Caractéristiques de base de la cohorte randomisée. Diabetes Care 2000; 23: 1619-1629.
15. Isomaa B., Almgren P., Tuomi T., Forsen B., Lahti K., Nissen M., Taskinen M., Grop l .: Morbidité cardiovasculaire et mortalité associée au syndrome métabolique. Diabetes Care 2001; 24: 683-689.
16. HAFFNER S.M., Mykcanen L., Festa A., Burke J.P., Stern M.P .: Les sujets prédiabétiques résistants à l’insuline ont plus de facteurs de risque athérogènes que les sujets prédiabétiques sensibles à l’insuline: implications pour prévenir les maladies coronariennes pendant l’état prédiabétique. Circulation 2000; 101: 975-980.
