Article d’examen
Immunopathogenèse de la maladie hypertendue gravidique
Immune-pathogenèse de l’hypertension enceinte
Alaín Alonso-Remedios, Maité Pérez-Cutiño, Dania F. de León Delgado
Université de médecine Sciences de Cienfuegos. Cuba.
Résumé
La maladie hypertendue gravidique constitue une pathologie obstétrique relativement fréquente. Au cours des dernières années, des progrès ont été accomplis dans la compréhension de la pathogenèse de la maladie, étant le système immunitaire, l’un des acteurs de l’importance vitale dans l’apparition de ce trouble. Les cellules tueuses naturelles de la décrétion sont un composant fondamental du rénovation vasculaire lors de la formation du placenta. Lorsqu’il existe des modifications de cette population cellulaire, une ischémie placentaire qui favorise la libération de facteurs vasculaires et de médiateurs d’inflammation favorisant des dommages systémiques avec l’émergence des symptômes de la maladie.
Mots-clés: Preeclampsie; Système immunitaire; pathogénie.
Résumé
L’hypertension enceinte est de fréquenter le trouble de la chronologie. Les chercheurs ont récemment avancé pour comprendre cette maladie de la maladie. Le système immunitaire joue au rôle clé dans ce début de la conception. Les cellules tueuses naturelles énormes sont une composante fondamentale dans le remodelage vasculaire pendant le développement placentaire. Lorsque des modifications se produisent dans cette population cellulaire, l’ischémie placentaire est induite en faveur de la libération de facteurs vasculaires et de mécanismes d’inflammation qui provoquent ces symptômes de la maladie.
Mots-clés: Preeclampsie; Système immunitaire; pathogénèse
Introduction
La grossesse est considérée comme un événement physiologique et est reçue, dans la plupart des cas, comme un cadeau accordé au sexe féminin.1 Cependant, à ce stade se trouvent de nombreuses conditions qui constituent une cause de morbidité maternelle et de mortalité.
Préhelampsie / Eclampsie est une maladie d’étiologie inconnue dans laquelle une hypoxie tissulaire généralisée apparaît particulièrement, avec un impact multisystemique qui affecte particulièrement les vaisseaux sanguins du rein, du foie, du foie et du système nerveux central. La hipoxia, por otras razones (hipóxica, anémica), agravará más la situación de la paciente al incrementar el daño a la microcirculación.2
Han transcurrido aproximadamente 2 000 años después de que Paracelso describiera la enfermedad por primera fois; Cependant, les progrès accomplis dans la compréhension de la pré-éclampsie ont été lents et seulement au cours des 10 ou 15 dernières années ont changé la connaissance de ce trouble.3
L’image clinique est caractérisée par la figure de pression systolique atteint 140 mmHg ou pression plus et diastolique de 90 mmHg ou plus, accompagnée de protéinurie; Il est courant qu’il s’agisse également de la céfalea, des ongles, des phosphènes, de l’œdème, des douleurs abdominales et / ou des altérations de laboratoire. Il est connu comme des éclampsie lorsque, en outre, les patients atteints d’une maladie gravidale hypertendue présente des saisies ou un statut de virgule en l’absence d’autres causes.4
Parmi les facteurs de risque connus qui prédisposent à la prééclampsie sont les suivants: nulliparité, adolescence, femmes Plus de 35 ans, l’obésité, l’hypertension artérielle antérieure, la grossesse multiple, les maladies chroniques telles que le diabète sucré, l’histoire de la préeclampsie / éclampsie pendant la grossesse, les antécédents familiaux de la prééclampsie et / ou ont subi des éclampsie, entre autres facteurs. 4
Il a récemment été démontré que pendant la grossesse, il y a un remodelage des artères en spirale utérine avec une invasion de cellules trophoblastiques, indispensables à une irrigation de placenta. Lorsque ce phénomène est déficient, un placenta ischémique est obtenu en conséquence, ce qui constitue un facteur central de l’éthiopathogénie de la préeclampsie.5.6
composants du système immunitaire tel que des macrophages et des cellules tueuses naturelles utérines (DNK de Le tueur anglais naturel décidé) est impliqué dans le processus de placentation. Il existe des preuves qui visent à une relation directe entre les populations de cellules immunitaires du placenta, l’environnement cytokine produite par ces cellules et l’émergence de maladies associées à la croissance intra-utérine enceinte, aux avortements et aux maladies hypertendus gestinentes.5,7
Sur la base des preuves solides qui pointent sur un rôle important dans le système immunitaire de la pathogenèse de la maladie graphique hypertendue, nous avons décidé de faire cet examen dans le but de décrire les principaux mécanismes immunologiques impliqués dans la pathogenèse de la pré-eclampsie Grâce au résumé des données fournies par des articles publiés sur le sujet au cours des 10 dernières années.
Méthodes
Un examen bibliographique a été effectué dans la base de données PubMed / MedLine, en utilisant les descripteurs: pré-eclampsie, pré-éclampsie et inflammation, pré-eclampsie et système immunitaire, pré- Eclampsie et Citoquinas. Tous les articles publiés dans le journal Open Access Journal dont la date de publication n’a pas prévenu 2005. Un total de 225 articles sont apparus, dont 30 œuvres ont été sélectionnées dans les résumés de laquelle nous trouvons des aspects liés à l’objectif de notre recherche. De plus, le magazine cubain de gynécologie et d’obstétrica a été examiné lorsque les descripteurs ont été utilisés: pré-éclampsie, éthiopathogénie de la pré-eclampsie à partir de laquelle 4 articles publiés à partir de 2005 ont été sélectionnés à ce jour.
immunopathogenèse
Système immunitaire dans le placenta normal
Le placenta est l’organe d’échange fœtal, en plus de prendre en charge la production d’hormones. Vers le quatrième mois consiste en deux composantes; Un foetal le corion feuillu et une maternelle, la décentrée basale. Les cellules trophoblastiques et décodées sont mélangées dans la zone de l’Union. Entre la feuille coronique et décidée sont l’espace intermédiaire occupé par le sang maternel.8 L’interface maternelle-fœtale est formée dans les espaces intermédiaires et dans la décidue basale (Fig. 1) .9
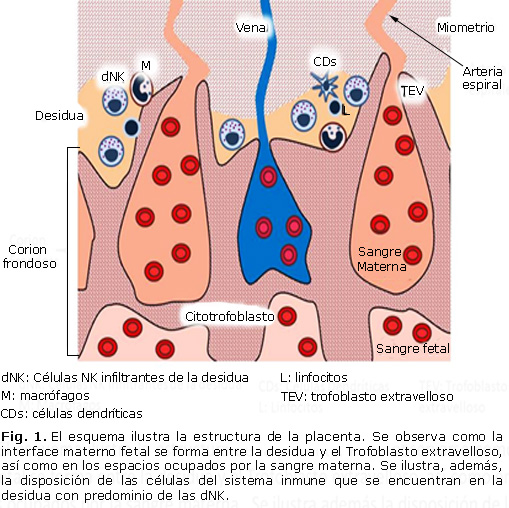
Les cellules trophoblastiques sont en contact direct avec le sang maternel. Le fœtus se comporte comme une transplantation semi-allogénique en ayant la moitié des informations génétiques d’information de la mère.10 Pour éviter le rejet, les cellules trophoblastiques n’expriment pas les molécules du complexe d’histocompatibilité principale (MHC de l’anglais: complexe d’histocompatibilité majeur) Classe II (DP , DQ et DR). Ils n’ont pas non plus de molécules de classe de la MHC i a NI B; Ils n’expriment que le CMHC IC et les formes non classiques de MHC I, telles que HLA (de l’anglais: antigènes de leucocytes humains) E, F et G.11 de cette manière, des cellules trophoblastiques empêchent l’élimination par les cellules immunitaires maternelles de l’interface maternelle. FOTAL.
Dans la décision, il existe des cellules du système immunitaire telles que des lymphocytes, des cellules dendritiques, des cellules tueuses naturelles et d’autres personnes nécessaires à la grossesse normale.12 Les cellules tueuses naturelles (NK de tueur naturel) constituent la principale Population de leucocytes dans l’interface maternelle-fœtale.13 chez l’homme, cette population représente 70% de toutes les cellules blanches trouvées dans le placenta au cours du premier trimestre de la grossesse et sont appelées infiltration NK de la décentration (DNK). Cette population est distinguée par le Fénotype CD56 lumineux CD16 – Contrairement aux cellules NK traditionnelles présentes dans le sang périphérique et les autres tissus, caractérisés par l’exprimer les marqueurs CD16Dim CD16 + (Fig. 1) .14
La population DNK Ne pas exprimer à partir du récepteur de faible affinité pour les IgG (CD16) manque d’activité cytotoxique dépendante de l’anticorps (cytotoxicité à médiation de cellule dépendante de l’ADCC) .9 DNKS supplémentaires ont une expression supérieure du récepteur KIR (de l’anglais: Immunoglobuline de la cellule Killer Comme des récepteurs) 14 et ILT (de l’anglais: récepteur de type immunoglobuline leucocyte) 15 que les cellules nucléaires de sang périphérique.
Le KIR est une famille polymorphe de récepteurs où certains ont une action inhibitrice tandis que d’autres transmettent des signaux actives. Les ligands de ces récepteurs sont les molécules de classe I MHC, en particulier la HLA-C.16, le ligand des récepteurs ILT est les molécules HLA-G et sa signalisation inhibe également l’activité cytotoxique des cellules NK.15 dans le trofoblaste est généralement Exprimé hautement exprimé HLA-C et HLA-G; 14 Cela joue un rôle important dans la tolérance du fœtus et la formation du placenta.
Le DNK sécrète des cytokines pro-inflammatoires telles que TNF-α (Alpha, Anglais Tumeur Necrose Facteur: Nécrose tumorale Facteur alpha), IL-8 et IFN-γ (gamma interféron); En plus de produire des facteurs de croissance tels que le facteur de croissance de l’endothélium vasculaire (VEGF, facteur de croissance vasculaire-endothélium), 5 facteur de croissance du placenta (PGF, Anglais: Facteur de croissance Placentan), Angpt1 / 2 (de l’anglais: angiopiétine) et transformant Facteur de croissance bêta1 (TGF-β1, de l’anglais: transformation de la croissance BETA1 facteur) .14
Les études in vitro et in vivo ont montré que la signalisation en activant le récepteur dans le DNK favorise l’activité de sécrétion; Contrairement au sang périphérique, qui libère des facteurs cytotoxiques de ses granules.17 L’IL-8 produit par le DNK intervient dans les processus de migration et d’invasion du trophoblaste, mais TNF-α augmente l’activité cytotoxique du DNK sur les cellules de trophoblaste.5 De même, la PGF, l’angypte 1/2 et le VEGF interviennent dans le processus d’entraînement du placenta et du rénové des vaisseaux sanguins.14
dans l’interface maternelle-fœtale en plus des DNK que nous trouvons Autres cellules immunitaires. Les lymphocytes T représentent moins de 10% des leucocytes trouvés dans le placenta. Ils sont principalement des lymphocytes TCD4 bien que nous puissions également trouver des lymphocytes de CD8 T en charge de la production de cytokines et de régulation de l’invasion trophoblastique.18
cellules dendritiques (CD) ne représentent que entre 1 et 2% des leucocytes (Fig. . 1). Dans l’utérus, des CD immatures caractérisés par l’expression du marqueur CD1A, contrairement aux CD matures trouvés dans l’endomètre pendant la phase menstruelle, qui exprime le CD38. Les CD interagissent directement avec le trophoblast via le récepteur DC-Sing (à partir de l’ICAM spécifique à la cellule dendritique. Compte tenu de sa fonction de présenter des antigènes, les CD ont la capacité de réguler le schéma de différenciation des lymphocytes T.15
L’action des hormones pendant la grossesse a également effet sur les lymphocytes. La progestérone induit la production du facteur de liaison induit par la progestérone (PIBF du facteur de liaison induite par la progestérone anglais). Le GDPF favorise la différenciation du phénotype Th2 de l’IL-4, IL-5 et IL-10. Les cellules TH2 favorisent l’acquisition du phénotype M2 dans les macrophages, qui contribuent à l’environnement tolérogène des macrophages Placenta.19.19
représentent environ 20% des leucocytes infiltrants du feuillus pendant la grossesse; Cependant, ils constituent une source importante de cytokines pour la tolérance du fœtus et la défense contre les infections. En grossesse normale, les macrophages des sécréteurs de cytokine anti-inflammatoires M2 (CD68 +) et des facteurs vasculaires tels que VEGF, IL-8 et Angpt ½ (Fig. 1) .20
Immunopathogène de La préeclampsie
pendant une longue période était considérée comme une maladie hypertendue gestationnelle (pré-eclampsie / eclampsie) comme affection de multiples étiologies; Cependant, dans les années 1970 du siècle dernier, il a été révélé que cette maladie était associée à une ischémie utérine placentaire. De nos jours, il est connu que cette irrigation insuffisante est due à la formation inadéquate des vaisseaux sanguins dans le placenta.21
pendant la grossesse normale, les cellules dérivées du cyto-trophoblastrateur fœtal migrent vers l’endomètre et le myomètre remplaçant le muscle lisse et le Endothélium des artères en spirale utérine, ce remodelé garantit des navires de plus grand calibre et moins de résistance au flux sanguin. Toutefois, lorsque ce processus ne se produit pas complètement, les complications associées à la grossesse sont initiées.5
efforts intensifs ont été déployés pour comprendre les facteurs impliqués dans le processus de formation du placenta. Des preuves récentes indiquent que la faible prolifération, la migration et l’invasion des cellules trophoblastiques sont des conséquences de l’infiltration aberrante par les cellules immunes de l’utérus et l’action des cytokines produites par ces cellules.5
dans la pathogénèse de praeclampsie sont impliquées Molécules MHC non classiques, cellules NK, cellules dendritiques, récepteurs de reconnaissance des motifs, cytokines et sous-populations de lymphocytes TCD4 et TCD8. C’est pourquoi le système immunitaire joue un rôle important dans ce trouble. Les expériences in vitro montraient que les DNKS sont importants pour le processus de remodelage des artères en spirale et de la formation correcte du placenta. Par conséquent, les modifications de cette population cellulaire sont liées à l’émergence de la maladie.23
dans un modèle murin de maladie graphique hypertendue de maladie graphique hypertendue a été une réduction de la population DNK avec la perte de facteurs résultant À partir de ces cellules.24 Autres études, à travers le modèle Murine Pré-Eclampsia BPH / 5 a montré une élévation de l’IL-15 tout en déclinant la population DNK. Chez l’homme, l’existence de la relation entre les niveaux de l’IL-15 et la gravité des préeclampsie.13
Les études immunohistochimiques ont été corrompues chez l’homme ont démontré une augmentation de la population des cellules placentaires NK (CD56). Aux placentas des femmes enceintes normales. Cependant, il n’ya pas eu de différences significatives entre l’infiltration des cellules de la NK placentaire entre les femmes atteintes de pré-eclampsie et d’éclampsie.25 Ces résultats apparemment contradictoires à ce que l’on trouve dans les modèles animaux sont dus chez les patients atteints d’une maladie gravidale hypertendue, un processus inflammatoire associé se produit. À l’ischémie Placentaria avec recrutement de cellules NK périphériques avec activité cytotoxique16, ces données corroborent la théorie selon laquelle il existe un lien entre l’inflammation et le développement de la maladie.Bien que de nouvelles preuves aient été récemment publiées qui confirment le rôle de l’inflammation dans la genèse de la pré-eclampsie.26.27
Autres causes d’inflammation différentes de l’ischémie ont été liées à la genèse de la maladie. Par exemple, l’association entre les infections des tractus génitales et les pathologies multiples chez les femmes enceintes est décrite. En eux, les défaillances d’implantation, les avortements et la livraison pré-termes. Cependant, l’environnement inflammatoire causé par ces germes modifiait le schéma de cytokines dans l’utérus, qui pourrait contribuer à l’apparition de la maladie hypertendue gestationnelle en tant que déclencheur .28
études dans les modèles animaux montrait que l’injection de LPS Au début de la grossesse produisit des symptômes similaires à la pré-éclampsie. Ces résultats suggèrent que la signalisation par le récepteur de reconnaissance des motifs TLR-4 (de l’anglais: un récepteur à péage) est importante dans la genèse de cette maladie. Il existe des données cliniques sur l’augmentation de ce récepteur des placentas humains de femmes atteintes de pré-eclampsie.29, pointez également vers une association éventuelle entre les bactéries grammes négatives et le développement d’une maladie hypertendue gestationnelle.30 Il est nécessaire de se rappeler qu’une partie importante de la Les microbiotes génitales sont des bactéries grammes négatives.
La réponse inflammatoire apparaît non seulement avant les infections; Par exemple, l’obésité est associée à un processus inflammatoire chronique de faible qualité. 31 études ont montré que l’obésité et les régimes riches en sucres et en graisses diminuent l’infiltration de DNK pendant la grossesse. De plus, les adipocytes produisent des laptine, qui augmente l’activité cytotoxique du DNK.5 Les résultats sont des niveaux inférieurs des facteurs nécessaires pour stimuler la migration du trophoblast et par l’autre, une population de DNK avec la capacité de détruire des cellules trophoblastiques. La combinaison de ces phénomènes est traduite dans un remodelage inférieur des artères en spirale. Par conséquent, le flux sanguin utérin-placentarium est affecté et le placenta devient ischémique.
Le placenta ischémique produise des facteurs solubles tels que SFLT1 et VEGF, l’élévation de ces facteurs dans le sang maternel est associée au début de la pré-eclampsie.32-34 L’utilisation d’anticorps monoclonaux (ACM) contre la SFLT1 et le VEGF ont montré une protéinurie réduisant les souris. Fait intéressant chez l’homme, la pré-éclampsie ne se développe pas chez toutes les femmes ayant des valeurs élevées de SFLT1.35 Ces résultats sont dus aux facteurs produits par le placenta ischémique induisant des dommages endothéliaux généralisés responsables de la protéinurie et des chiffres L’élévation de la pression artérielle. La combinaison de ces deux facteurs et des dommages endothéliaux sont responsables de l’apparition de l’œdème chez ces patients (fig. 2) .26

endoglin semble jouer un rôle important dans la blessure endothéliale et pourrait servir de marqueurs à risque pour le développement de la maladie. Le facteur inductible de l’hypoxie alpha (HIF1-α des facteurs inductibles de l’hypoxie anglais) semble jouer un rôle pertinent dans le début de la maladie hypertendue gestationnelle.36 HIF1-α se produit en réponse à l’hypoxie et son augmentation de la placenta est associée à l’expression de gènes de réponse hypoxia dans lesquelles le VEGF et le SFLT1.37
HIF1-α sont non seulement intervenus dans la synthèse de facteurs vasculaires dérivés du placenta si elle n’a pas d’effet dans le système immunitaire, qui favorise L’environnement inflammatoire de l’interface maternelle-fœtale, 37 avec une augmentation des populations de TH1, des producteurs d’IFN-γ, IL-2 et IL-12, ainsi qu’une diminution des populations de lymphocytes t des régulateurs.38 Cet environnement inflammatoire, associé à l’endothéliale Les dommages favorisent le recrutement de NK avec une activité cytotoxique, qui détruisent des cellules trophoblastiques qui affectent de plus en plus la circulation de placentaux utérin et renforce l’ischémie39. Par conséquent, cette cotisation inadéquate d’oxygène Être le facteur de détonation de la maladie.
L’ischémie placentaire induit également une augmentation de la population de macrophages M1-γ-γ.5 Bien que l’IFN-γ augmente la production de CXCl12 par des cellules endothéliales, facteur principal du recrutement NK CD56 Bright CD16, -40 Son La signalisation induit une apoptose dans les cellules trophoblastiques.11 Par conséquent, cette ischémie initiale aggrave la genèse de la maladie devenant une boucle d’amplification dans l’immunopathogenèse de la préeclampsie. Pour cette raison, nous pouvons affirmer que l’effet de l’IFN-γ dans l’immunopathogenèse de la préeclampsie est controversé; Cependant, de nombreux auteurs ont une association associée entre des niveaux élevés de cette cytokine et le développement de la maladie.22
Autres cytokines produites par des macrophages du phénotype M1, telles que TNF-α, favorise une expression aberrante de métalloprotéinases et produit une apoptose directe dans des cellules trophoblastiques avec lesquelles une invasion trophodélastique aux artères de spirale est ralentissée. 40 En général, les cytokines proinflammatoires diminuent la migration trophoblastique et sont liées au développement de la maladie.222
de la même manière, le modèle de réponse à lymphocytes TCD4 est également lié à l’apparition de la pathologie, où certaines sous-populations telles que comme treillis et TH17 favoriser leur apparence; Alors que la Treg et la TH2 constituent des facteurs de protection41.42 En général, les cytokines du modèle TH1 favorisent l’apoptose des cellules trophoblastiques et retardent l’invasion du trophoblaste; Tandis que les cytokines du modèle TH2 favorisent la prolifération et l’invasion des études cliniques de Trophoblaste.22 On a montré que les femmes atteintes de préeclampsie ont surélevé des nombres de lymphocytes Th1743 et Treg diminuaient des femmes enceintes normales et ces altérations maternelles transcendent le fœtus, qu’il influe sur le fœtus. Le système immunitaire du nouveau-né au cours des premières semaines de la vie.44
En outre, le développement d’une maladie grave gestéologique est liée à des changements épigénétiques et génétiques chez le patient. Une étude bioinformatique a montré que dans l’expression de gènes polymorphes en villi chronique influencent sur l’apparition de la préeclampsie, elles sont principalement liées à des gènes d’expression différentielle. Une grande partie des produits de ces gènes sont liés à l’activité des écoles DNK.45
chez Humans montraient que les mères dans lesquelles leur DNK n’expriment que l’inhibiteur des récepteurs de Kir tels que la combinaison Kir2DL1N avec l’expression de l’allèle de HLA-C2 par le fœtus augmente le risque de maladie hypertendue de la sauce et de croissance intra-utérine retardée par rapport aux mères exprimant l’allèle Kir2DS1 du récepteur d’activation à DNK.46, il est expliqué par le fait que la signalisation en activant les récepteurs induit dans la DNK de leur sécrétion. fonctions et non cytotoxique.17
Les polymorphismes de HLA-G ont également été liés à un risque accru de prééclampsie, car les porteurs de fœtus de l’allèle +14 BP / + 14 BP HLA -G ont une expression inférieure de HLA-G dans des cellules trophoblastiques qui favorise l’action cytotoxique de NK. (11) D’autres polymorphismes tels que TGF-β 1869 T˂C; 47 ainsi que dans les protéines C6 MASP1 du complément ont également été associés au développement de la maladie.48
comme résumé dans Pathogenèse de la maladie, des facteurs environnementaux et génétiques qui provoquent en conséquence, un infiltrat inférieur de cellules DNK est imbriqué. En raison de l’importance de la DNKK de promouvoir la migration et l’invasion de cellules trophoblastiques, une diminution de cette population entraîne la conséquence que les cellules endothéliales ou musculaires lisses des artères en spirale ne sont pas remplacées par l’insuffisance conséquente de la contribution du sang et nutriments.. En réponse à cette ischémie placentaire, les facteurs et les cytokines sont libérés qui transforment l’environnement tolérogène en inflammatoire avec lequel des cellules trophoblastiques sont en outre détruites. D’autre part, l’excédent de facteurs vasculaires et la transformation du processus inflammatoire local dans systémique produit des dommages endothéliaux, qui est responsable de l’apparition de l’image clinique chez ces patients.
Les conflits d’intérêts des auteurs ne déclarent pas avoir de conflits d’intérêts.
1. García I, M. German M. Risques de la grossesse à l’âge avancé. Rev Cubana Obsêt Gynecol. . 2013; 39 (2): 120-7. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2013000200007&lng=es
2. Suárez J, Gutierrez M, Le Caire V, Marín Y, Rodríguez L, Veitia M. Preeclampsie Précédent comme un facteur de risque dans la Grossesse actuelle Rev Cubana Obsêt Gynecol. . 2014; 40 (4): 368-77. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2014000400003&lng=es
3. Delgado J, Reyes E, Amador A, García M, Cubero ou, Quesada F, et al. Malondialdéhyde et poids à la naissance dans la pré-eclampsie. Bref examen et association entre les deux. Rev Cubana Obsêt Gynecol. . 2008; 34 (3): Disponible en: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2008000300003&lng=es
4. Álvarez V, Alonso R, Muñiz M, MARTÍNEZ J. Caractérisation de l’hypertension induite par la grossesse . Rev Cubana Obsêt Gynecol. . 2014; 40 (2): 165-74. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2014000200004&lng=es.
5. Spradley f, Paléi A, Granger J. Mécanismes immuns reliant l’obésité et la prééclampsie. Biomolécules . 2015; 5: 3142-36. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4693273/
6. Abbas Y, Oefner C, Polcack W, Gardner L, Farrell L, Sharkey A, et al. Un test de microfluidique pour étudier l’invasion des cellules de troproplaste placentaire humaines. J r interface SOC. . 2017; 14 (130). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5454302/
7. Matson BC, Caron km. Adrenomédulline et contrôle endocrinien des cellules immunitaires pendant la grossesse.Cel & Mol Immunol. . 2014; 11: 456-9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4197213/
8. Sauteur TW. Embriologie médicale de Langman. 8ème éd. Mexique: Ed Médica Panamericana; 2010.
9. Jabrane-Ferrat N, Siewiera J. Le côté en haut des cellules tueuses naturelles décodées: Nouveaux développements en immunologie de la grossesse. Immunologie. . 2013; 141: 490-7. DISPONIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3956423/
10. GÖHNER C, PLÖSCH T, FAAS M. Effets modulateurs immunodynamiques des vésicules extracellulaires syncytiotrophoblastes pendant la grossesse et la prééclampsie. Placenta. . 2017; PII: S0143-4004 (17) 30288-6. http://www.sciencedirect.com/science/article/pii/S0143400417302886?via%3Dihub
11. Serrano NC. Immunologie et génétique de la préeclampsie. Clin développe l’immunol. . 2006; 13 (2-4): 197-01. Disponible FR: https://www.ncbi.nlm.nih.gov/pubmed/17162362
12. Lamarca B, Amaral L, Harmon A, Cornelius D, Faulkner J, Cunningham MJ. Ischimie placentaire et phénotype résultant dans des modèles animaux de préeclampsie. Curry hypertens rep.. 2016; 18 (5): 38. DISPONIBLIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5127437/
13. SONES JL, LOB He, Isroff CE, Davisson RL. Rôle des cellules tueuses naturelles crixsiales, interleukin-15 et interféron-γ dans le développement placentaire et la prééclampsie. Suis J Physiol Regul Integrate Compha Cathiol. . 2014; 307 (5): 490-2. Disponible fr: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4214833/
14. Da Lima P, Zhang J, Dunk C, Lye SJ, Croy BA. Angiogenèse décimentée au leucocyte en début de grossesse. Cel & Mol Immunol. . 2014; 11: 522-37. DISPONIBLIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4220841/
15. Martínez-Vaea A, Pellicer B, Perales-Marín A, Pellicer A. Relation entre la réponse immunologique maternologique pendant la grossesse et l’apparition de Preéclampsie. J d’immunol résolution. . 2014; 2014: 210241. DISPONIBLIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4060291/
16. TAKESHITA LYC, GONZALEZ-GONARZA FF, DOS SANTOS EJM, MAIA MHT, RAHMAM MM, Zain SMS, et al. Une base de données destinée à la conservation des associations entre les récepteurs et les maladies de type immunoglobuline des cellules meurtrières dans les populations mondiales. Base de données. . 2013; 2013: BAT021. Disponible fr: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3625957/
17. Hannaj Gwy. Les cellules NK désirées régissent les processus de développement essentiels à l’interface fœtale humaine-maternelle. Nat Med. . 2006; 12: 1065-74. DISPONIBLIBLE EN: http://www.nature.com/nm/journal/v12/n9/full/nm1452.html?foxtrotcallback=true
18. WALLACE AE, Fraser R, Cartwright Jee. Trophoblaste extravilleux et cellules tueuses naturelles décodées: un partenariat de remodelage. Mise à jour de la reproduction humaine. . 2012; 18 (4): 458-71. Disponible fr: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3373213/
19. Robinson DP, Klein SL. La grossesse et les hormones associées à la grossesse modifient les réponses immunitaires et la pathogenèse de la maladie. Se coiffer. . 2012; 63 (3): 263-71. Disponible FR: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3376705/
20. Smith SD, Dunk Ed, Aplin JD, Harris lk, Jones RL. Preuve de participation à la cellule immunitaire dans le remodelage de l’artériole en spirale, à une grossesse humaine précoce. Am j pathol. . 2009; 174: 1959-71. DISPONIBLIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2671283/
21. Vázquez Cabrera J. Embarazo, Parto Y puerperio. Principales complicaces. LA HABANA: ÉDITORIAL CIENCIAS MÉDICAS; 2009.
22. Ning F, Liu H, Lash G. Le rôle des macrophages criminels pendant la grossesse normale et pathologique. Je reproduit immunol. . 2016; 75 (3): 298-309: p. 510-24. https://www.ncbi.nlm.nih.gov/pubmed/26750089
23. Robson A, Harris Lk, Innes Ba, Lash Ge, Aljunaidy MM, Aplin JD, et al. La cellule tueuse naturelle utérine initie un remodelage de l’artère en spirale dans la grossesse humaine. FASEB J.. 2012; 26: 4876-85. Disponible fr: https://www.ncbi.nlm.nih.gov/pubmed/22919072
24. Linzke n, Schumacher A, Woidacki K, Croy Ba, Zenclussen AC. Le monoxyde de carbone favorise la prolifération des cellules tueuses naturelles utérines et du remodelage des artères en spirale chez les souris mutantes hème oxygénase hème oxygénase-1. Hypertension. . 2014; 63: 580-8. Disponible fr: http://hyper.ahajournals.org/content/63/3/580.long
25. Akhlaq m, Nagi Ah, Yousaf aw. La morphologie placentaire dans la pré-eclampsie et l’éclampsie et le rôle probable des cellules NK. Indian j Pathol Microbiol. . 2012; 51 (1): 17-21. Disponible FR: http://www.ijpmonline.org/article.asp?issn=0377-4929;year=2012;volume=55;issue=1;spage=17;epage=21;aulast=Akhlaq
26. Borzychowski am, Sargent Il, Redman CWG. Inflammation et pré-eclampsie. SEM dans FET & NEON MED. 2006; 11: 309-16. DISPONIBLIBLE EN: http://www.sciencedirect.com/science/article/pii/S1744165X06000436?via%3Dihub
27. Harmon A, Cornelius D, Amaral L, Faulkner J, Cunningham MJ, Wallace K, et al. Le rôle de l’inflammation dans la pathologie de la préeclampsie. Clin SCI (londre). . 2016; 130 (6): 409-19. Disponible FR: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5484393/
28. Weiss g, Goldsmith Lt, Taylor Rn, Belle D, Taylor Hs. Inflammation dans les troubles de la reproduction. Réprodez SCI. . 2009; 16 (2): 216-29. DISPONIBLIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3107847/
29. KOGA K, MOR G. RÉCEPTEURS DE COMMUNIQUÉS À TOLL À L’Interface maternelle-FOTAL en matière de grossesse normale et de grossesse. Je reproduit immuno. . 2010; 63 (6): 587-00. DISPONIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3025804/
30. RAMPERSAUD R, RANDIS TM, RATNER AJ. Microbiota du tractus génital supérieur et inférieur. Séminaire de la médecine néonatale fœtale. . 2012; 17 (1): 51-7.Disponible fr: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3242913/
31. Romeo GR, Lee J, Shoelson SE. Syndrome métabolique, résistance à l’insuline et rôle des inflammations-mécanisme et des cibles thérapeutiques. Artérioescler. Thromb. Vasque. Biol. . 2012; 32: 1771-6. DISPONIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4784686/
32. PALMER K, TONG S, KITUU’U-LINO T. SFLT-1 SPFLT-1: Rôle dans la physiopathologie pré-eclamptique et ses possibilités de translation pour la prévision clinique et le diagnostic. Mol hum reprod. . 2017; 23 (2): 69-78. DISPONIBLE EN:
33. Almasry S, Elfayomy A, Hachem H. Ultrastructure et analyse histomorphométrique des navires de cordon ombilicaux humains dans la préeclampsie: un rôle potentiel de VEGF , Vegfr-1 et Vegfr-2. Embryol de Rom J Morphol. . 2016; 57 (2 Suppl): 681-9. DISPONIBLIBLE EN: http://www.rjme.ro/RJME/resources/files/571216681689.pdf
34. Liberis A, Stanulov G, Ali E, Hassan A, Pagalos A, Kontomanolis E. Pré-Eclampsie et la croissance endothéliale vasculaire facteur: un nouvel aspect. Glex Exp Obset Gynecol. . 2016; 43 (1): 9-13. Disponible FR: https://www.ncbi.nlm.nih.gov/pubmed/27048010
35. Kanasaki K, Kalluri R. La biologie de la préeclampsie. Rein int. . 2009; 76 (8): 831-7. DISPONIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4313558/
36. Robb K, Cotechini T, Allaire C, Sperou A, Graham C. La restriction de croissance fœtale induite par l’inflammation chez le rat est associée à augmentation de l’accumulation de HIF-1α placentaire. Plos un. . 2017; 12 (4): E0175805. DISPONIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5397034/
37. Charnock-Jones D. Hypoxie placentaire, stress de réticulum endoplasmique et sensibilisation endothéliale maternelle par SFLT1 dans la pré-eclampsie. J reprod immunol. . 2016; 114: 81-5: 38-42. DISPONIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4822533/
38. Vianna P, Mondadori A, Bauer M, Dornfeld D, Chies J. HLA-G et CD8 + Licules T réglementaires dans l’inflammatoire Environnement de pré-eclampsie. La reproduction. . 2016; 152 (6): 741-51. DISPONIBLIBLE EN: http://www.reproduction-online.org/content/152/6/741.long
39. Southcombe J, Redman C, Sargent I. Sargent I. Invariant de sang périphérique Sangeur naturel des cellules T tout au long de la grossesse et des femmes prééclamptiques. J reprod immunol. . 2010; 87 (1-2): 52-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2995212/
40. Lockwood CJ, Basar M, Kayisli UA, Guzeloglu-Kayisli O, Murk W, Wang J, et al. Interféron-g protège les cellules de décision des premières trimestres contre les métalloprotéinases de matrice aberrantes 1, 3 et 9 d’expression dans la prééclampsie. Am j pathol. . 2014; 184: 2549-59. Disponible FR: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4188280/
41. Lamarca B, Cornelius D, Harmon A, Amaral L, Cunningham M, Faulkner J, et al.. Identifier les mécanismes immunitaires médiatant l’hypertension pendant la préeclampsie. Suis J Physiol Regul Integrate Compha Cathiol. . 2016; 311 (1): R1-9. Disponible FR: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4967235/
42. Figueiredo A, Schumacher A. Le paradigme Type Type 17 / Réglementation Type T dans la grossesse. Immunologie. . 2016; 148 (1): 13-21. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4819144/
43. Cornelius D, Amaral L, Wallace K, Campbell N, Thomas A, Scott J, et al. La pression utérine réduite de la pression de perfusion T-HELPER 17 cellules provoque une pathophysiologie associée à la prééclampsie pendant la grossesse. Suis J Physiol Regul Integrate Compha Cathiol. . 2016; 311 (6): R1192-R1199. Disponible FR: http://ajpregu.physiology.org/content/311/6/R1192.long
44. SAVA F, TOPI G, TRESZL A, HAJDú J, HARMATH Á, RIGÓ JJ, et al. Les sous-ensembles de cellules immunitaires, les taux de cytokine et de cortisol au cours de la première semaine de vie chez les néonates nés aux mères pré-eclamptiques. Je reproduit immunol. . 2017; 77 (6). Disponible FR: http://onlinelibrary.wiley.com/doi/10.1111/aji.12659/pdf
45. Rabaglino MB, Post-Uiterweer Ed, Jeyabalan A, Hogge wa, Conrad Kp. Une approche bioinformatique révèle des preuves pour une maturation endomètre altérée avant et pendant la grossesse précoce chez les femmes qui ont développé des préeclampsia. Hypertension. . 2015; 65 (2): 421-9. DISPONIBLIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4290371/
46. Ivarson Ma, Michaëlsson J, Fauriat C. Activer les récepteurs de la cellule de cervelle de la cellule tueuse dans la santé et la maladie. Immunol avant. . 2014; 5 (184): 1-9. DISPONIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4001058/
47. LI x, SHEN L, TAN H. POLYMORPHISMES ET NIVEAU DE PLASMA DE TRANSFORMATION FACTEUR DE CROISSANCE-BETA 1 ET RISQUE DE PREECLAMPSIA: A Revue systématique. Plos un. . 2014; 9 (5): E97230. DISPONIBLIBLE EN: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4019528/
48. Wu W, Yang H, Feng Y, Zhang P, Li S, Wang X, et al. Les polymorphismes dans les gènes complémentaires et le risque de prééclampsie à Taiyuan, en Chine. Inflammement res. . 2016; 65 (10): 837-45. Disponible fr: https://link.springer.com/article/10.1007%2Fs00011-016-0968-4