Original
Quelques aspects de la dynamique de la population des hippopotames de Caranx ( Poissons: Carangidae) dans les cendres Bocas, Caraïbes colombiennes
Quelques aspects de la dynamique de la population de la crevalle Jack Caranx Hippos (Poissons: Carangidae) à Bocas de Ash, Caraïbes colombiennes
ID = « 604BA26359 »> ITALA CAIAFA H, 1 BIOL, JOHN NARVÁEZ B, 2 * M.C, Silvana Borrero F, 3 Biol.
1minteriale de l’agriculture et du développement rural, Bogotá, Colombie.
2Université de la Magdalena, Programme d’ingénierie de la pêche, Groupe de la biodiversité et écologie appliquée, Santa Marta, Magdalena, Colombie.
3Corporation Colombie Internationale (JRC), Barranquilla, Atlántico, Colombie.
* correspondance: [email protected]
reçu: septembre 2009; Accepté: juillet 2010.
Résumé
objectif. Le but de cette étude était d’évaluer les aspects biologiques et la dynamique de la population des hippopotames creux (caranx) dans le secteur des cendres Bocas, des Caraïbes colombiennes. Matériaux et méthodes. Entre juin 2005 et juin 2006, les données de fréquence des longueurs commerciales ont été collectées pour déterminer le rapport de poids à coiffure longueur (LH-W), la taille moyenne de la maturité sexuelle (L50%), les paramètres de croissance (K, L ∞ et T0). , taux de mortalité (m, f et z) et exploitation (e). Il y avait 1151 personnes, dont 264 ont été utilisées pour l’analyse biologique. Résultats. Le ratio LH-W diffère entre les sexes. Un L50% a été estimé à 63,6 cm de lh. Les paramètres de croissance ont présenté les valeurs suivantes: L∞ = 91 cm de LH, K = 0,38 an-1 et à = 0,32 an. La valeur de l’indice de performance avait une plage comprise entre 3,33 et 3,73. Le taux de mortalité total (Z) était de 1,85 an-1, la mortalité de pêche (F) de 0,72 an-1 et naturel (m) à 1,13 an-1. Le statut d’exploitation (e) était de 0,30 an-1. Conclusions Selon le taux d’exploitation, le Jurel ne présente pas la surexploitation dans les bouches de cendres. Cependant, lors de la comparaison de la taille de capture moyenne avec L50%, l’espèce est capturée avec le principal engin de pêche avant 50% de la population parvient à mature. Des directives pour la conception d’un système de pêche garantissent la conservation et l’utilisation durable de cette ressource sont proposées.
Mots-clés: Pêche, reproduction, Caranx Hippos, Caraïbes, Colombie. (Source: Objectifs).
Résumé
Objectif. Évaluer les aspects biologiques et la dynamique de la population de Crevalle Jack (Hippo-caranx) de Bocas de Ash, des Caraïbes colombiennes. Matériaux et méthodes. Entre juin 2005 et juin 2006, des données de fréquence de longueur ont été collectées pour déterminer la relation de longueur de la fourche, la taille moyenne de la maturité (L50%), les paramètres de croissance de l’équation de von Bertatalffy (K, L∞ et T0), la mortalité (M, F et Z) et Taux d’exploitation (e). Au total, 1151 personnes étaient échantillons et 264 ont été utilisés pour une analyse biologique. Résultats La relation de la longueur de la fourche-poids a montré des différences entre les genders. L50% a été établi en 63,6 cm FL. Les valeurs de paramètres de croissance étaient les suivantes: L∞ = 91 cm FL, K = 0,38 an-1 et à = 0,32 an. Les valeurs d’indice de croissance comparative (φ ‘) allaient de 3,33 à 3,73. Taux de mortalité totale (Z) a été estimé à 1,85 an-1, mortalité de pêche (F) comme 0,72 an-1 et mortalité naturelle (m) comme 1,13 an-1. Le taux d’exploitation (e) a été déterminé comme 0,31 an-1. Conclusions Le taux d’exploitation indique que Crevalle Jack de Ash Bocas n’était pas surexploitée; Avant que 50% de la population atteigne sa maturité sexuelle. Nous proposons au Cadre pour le système de gestion de la pêche, à assurer la conservation et à l’utilisation appropriée de cette ressource.
mots clés: pêche, reproduction, hippopotames caranx, caribéen, colombie. (Source: Objectifs).
Introduction
La famille Carangidae est l’un des groupes de poissons de la plus grande importance économique dans les pêcheries tropicales et subtropicales du monde (1, 2). Depuis la pêche artisanale de la pêche artisanale dans le département de l’Atlantique, les hippopotames Caranx (Linnae 1766) sont l’une des espèces de la demande accrue (3). Il représente 47% des captures atterrissantes chaque année et 70% du revenu économique de la population de pêche, étant principalement capturés avec transmir et dans certains cas avec des crochets et du bowling (3). Malgré cela, il existe peu d’informations détaillées sur les aspects biologiques et de la population qui permettent d’élucider l’état d’exploitation dans lequel sa population se trouve à l’embouchure de la rivière Magdalena.
Les estimations des paramètres de croissance, la mortalité et les taux d’exploitation sont un élément important de l’étude de la biologie des poissons commerciaux, car ils permettent de déterminer les niveaux d’exploitation et fournissent des outils pour la mise en œuvre des politiques d’administration et de contrôle pour une exploitation adéquate (4-6). L’objectif de ce travail était de déterminer le ratio LH-W, la taille moyenne de la maturité sexuelle, les paramètres de croissance, les taux de mortalité et de l’exploitation de C. hippopotames dans les cendres Bocas pour connaître l’état d’exploitation dans ce secteur et instrument le scientifique Les bases pour proposer des directives orientées vers la conception de systèmes de pêche conduisant à une exploitation durable de cette ressource importante.
matériaux et méthodes
Zone d’étude. L’estuaire de la rivière Magdalena comprit dans la mer des Caraïbes, secteur appelé Ash Bocas (11ème 06 ‘- 11 ° 08’ Nord; 74 ° 50 ‘- 74 ° 52’ Ouest; Figure 1). Ce secteur est situé au nord du département de l’Atlantique (3). Le climat se caractérise par la présence de deux périodes climatiques qui affectent l’activité des pêcheurs (7); Le sec qui commence au début de décembre et se termine à la fin d’avril sans précipitations et une diminution du débit de la rivière Magdalena avec une moyenne de 4068 m3 S-1 (7, 8). La période pluvieuse commence en mai et se termine au début du mois de décembre avec une diminution des vents et une nuance élevée (7, 9) et est lorsque la plus grande eau décharge d’eau avec une moyenne de 10287 m3 S-1 (8) est présentée.
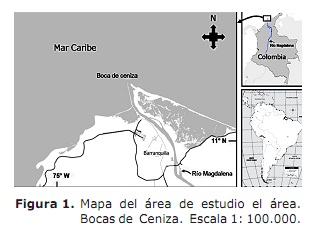
Les bouches de cendres sont un estuaire de solution saline, où son opération répond à l’interaction entre la vague de marée et la contribution fluviale à l’intérieur les contours imposés par la géométrie du même estuaire (9). Le secteur est influencé par deux courants: les Caraïbes des Caraïbes avec un sens ouest et le courant du Panama avec ceci (9). Dans ce domaine, l’activité de la pêche est de type à la main et compte environ 250 pêcheurs qui opèrent les équipements de pêche, les crochets, les arts palangriers et les bowling. Les captures sont représentées par des espèces marines, ainsi que par des espèces réalisées. Macrodon Ancyclodon, Caranx Crysos, C. Hippos, Scomberomorus Brésiliensis, Ariopis SP, SPP, SPP. et des accessoires Arius (3).
phase de champ et de laboratoire. Entre juin 2005 et juin 2006, des échantillons ont eu lieu pendant cinq jours de chaque mois pour enregistrer des fréquences de longueurs de captures commerciales atterrissantes dans le quartier de Las Flores, Barranquilla. Les captures ont été effectuées avec des crochets de jauge de 7 à 10 et avec des bols et transmis entre 8,89 et 20,32 cm de taille de maille. Chaque individu a été sexed et lourd (sans éviscération) avec un équilibre de précision de 0,1 g. Étant donné que tous les poissons ne sont pas venus avec des flux complets, la longueur de la fourche a été utilisée. Les mesures ont été apportées à la limite inférieure à l’aide d’un ichtiomètre avec une précision de 0,1 cm (3). Pour l’analyse biologique, des observations macroscopiques des gonades ont été effectuées pour déterminer le sexe et l’état de la maturation gonadique, en faisant référence à la classification qualitative de Vazzoleler (10), qui consiste en quatre états: indifférencié; immature (i); en maturation (II); Mature (III) et engendré (iv).
rapport de longueur de longueur (LH-W). Le rapport de longueur de longueur a été déterminé par des relations sexuelles à travers l’équation potentielle W = ALHB, où W est le poids total, A et B sont constants de la régression potentielle et de LH est la longueur de la fourche. Pour déterminer les différences dans le rapport LH-W entre les sexes, une analyse de covariance (ANCOVA) a été effectuée, où la variable dépendante était W, la variable indépendante était lh et le facteur sexuel. Avant l’analyse, les hypothèses de la normalité ont été évaluées (Kolmogorov-Smirnov), homogénéité des variances (test Bartlett), rapport linéaire entre la variable W et LH (analyse de corrélation) et homogénéité des boucles d’oreilles de la relation entre W et LH .
Demi-stock de maturité sexuelle (L50%), Composition de capture par tailles et taille moyenne de capture (TMC). Pour évaluer l’impact de la pêche sur la biologie de C. Hippos, L50% a été calculé. Ces spécimens dont les gonades ont été observées dans les États III et IV ont été examinées. Le calcul était basé sur le modèle logistique qui relie la proportion d’individus matures avec une longueur (L; 5):
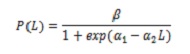
où , β = 1; α1 et α2 sont les paramètres de la régression.
estimer L50%, le rapport -α1 / α2 a été utilisé. Pour ajuster le modèle, la méthode de régression non linéaire a été utilisée par des carrés minimums, à l’aide de l’algorithme itératif de Newton.
La composition de la capture de taille a été utilisée pour calculer le TMC et les paramètres de croissance.Les données ont été groupées mensuellement dans les camarades de classe tous les deux centimètres. La relation entre la fréquence relative et le nombre total d’individus a été utilisée pour calculer le TMC en utilisant la procédure proposée par Sparre et Venema (5); Par la suite, un TMC a été calculé pour chaque art de la pêche observé. Le TMC a été comparé à L50% pour évaluer l’impact de la pêche sur la biologie de l’espèce.
Paramètres de croissance. Les données de longueur ont été groupées mensuellement dans les camarades de classe de 1 cm. Les paramètres de croissance ont été estimés par trois routines contenues dans la version 1.1 (4) du package de calcul de FISAT (4): l’analyse de fréquence électronique (Elefan I), celle des longueurs de la feuille de berger (SLAD; 11) et la méthode de projection matrice (Projmat; 12) . La routine Elefan je travaille avec l’équation de croissance saisonnalisée de von Bertatalanffy (Elefan I), étant la taille exprimée en fonction de l’âge (5):
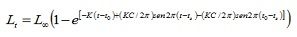
où, lt est la longueur à l’âge t; La longueur asymptotique; K est la constante de croissance, c’est le paramètre de condition initial, qui détermine le point hypothétique au cours de laquelle le poisson a une taille égale à zéro; C est le paramètre d’amplitude de la croissance oscillation; TS fait partie de l’année dans laquelle le taux de croissance est minime.
La routine SLCCA estime la croissance indépendante du nombre et de la position des fashions de l’échantillon, basée sur le réglage de la fonction cosinus:
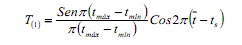
où, Tmax et Tmin sont des âges correspondant aux limites supérieure et inférieure d’un intervalle de classe donné; C’est l’âge moyen et la TS est la fraction de l’année dans laquelle l’échantillon a été pris (6).
La projmat projette un échantillon de la distribution de fréquence des temps de temps Temps T + 1, en utilisant le K et L∞ valeurs. Les fréquences projetées ont été comparées à celles observées par la somme des différences de carrés, répétant le processus jusqu’à obtenir les meilleures estimations (6).
Prenant en compte qu’il n’est pas possible d’obtenir une estimation des fréquences de longueurs (13,14), ce paramètre a été estimé à partir de l’équation empirique de Pauly (15):
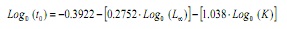
Où, à l’âge hypothétique à laquelle l’animal commence à croître, l∞ la longueur asymptotique et k est la constante de croissance
comparer les estimations de la croissance entre les méthodes, le taux de performance de croissance φ ‘(16) a été utilisé. De plus, ces valeurs ont été comparées aux estimations des autres populations de l’hippopotame documentée dans la littérature. Cet indice a été estimé à partir de l’expression:
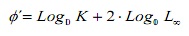
où, k et l, sont les paramètres de croissance.
Étant donné que la valeur estimée de L∞ dans cette étude était basée sur LH et celles documentées dans la littérature de la longueur totale (LT), à des fins de comparaison entre les valeurs, une simple régression linéaire a été faite entre LT (à charge) et lh (indépendant) pour faire la conversion de LH en lt. Pour cela, le modèle linéaire suivant a été obtenu avec des données de cette étude:
lt = – 0.4387 + (1 2335 lh)
des fréquences LH des captures commerciales, la mortalité totale (Z), naturel (m) et la pêche (F) de la population de C. Hippopota a été procédé à estimer. Z a été estimé à partir de la courbe de capture linéarisée convertie en tailles (17):
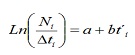
où, ni le nombre d’individus capturés appartenir à la classe de longueur I; T’I est l’âge relatif de la classe I; ΔI est le temps moyen requis par une personne pour sa croissance grâce à la classe I.
M a été estimé à l’aide de l’équation empirique de Paully (17):
Où, L∞ et K sont les paramètres de la von Bertatalanffy et de T équation T est la température annuelle moyenne d’eau côtière de surface dans la zone d’étude, considérée à 28,2 ° C
Le taux de mortalité de la pêche et le taux de fonctionnement ont été estimés à partir de:
Pour effectuer les estimations des paramètres, une croissance saisonnalisée de C. Hippos a été supposée, étant donné que sur l’année, des épisodes environnementaux dans la zone d’étude qui influençaient peut-être la croissance du poisson. Tel est le cas des conditions saisonnières de la caudale de la rivière Magdalena, qui peut influer sur les conditions physiques, chimiques et biologiques à sa bouche (8). À ceci est ajouté, l’influence des vents d’alisium dans le secteur de la bouche des cendres, puisqu’ils sont en cours et en fonction de leur intensité, ils modifient également les conditions océanographiques du secteur (18). De même, la connaissance biologique de l’espèce indique que C.Les hippopotames sont une espèce migratoire (1), à partir de laquelle une saisonnalité peut également être déduite de la croissance. Basé sur ce qui précède, les valeurs trouvées par Elefan I ont été sélectionnées pour estimer les taux de mortalité de C. Hippos dans cette étude.
dans le but de quantifier l’effet des échantillons mensuels dans les paramètres de croissance et Obtenez les valeurs de précision de celui-ci, la technique de remavage Jackknife (6) a été appliquée. Ceci consiste à estimer les n tailles mensuelles de la fréquence de tailles et de manière séquentielle est omise d’obtenir des combinaisons de chacun des paramètres. Pour spécifier cette estimation, l’erreur pourcentage (EP) et le coefficient de variation (CV) ont été utilisés, à l’aide des formules suivantes:
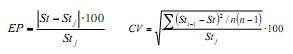
où, ST est le paramètre de croissance estimé à l’aide de la base de données annuelle complète et de STJ est l’estimateur moyen dérivé des estimations successives de Jackknife; STI-1 est le paramètre estimé lors de l’omission du mois I, et n est la taille de l’échantillon annuel (n = 12).
résultats
Au cours de la période de l’étude 1151 personnes ont été collectées, dont 868 ont été capturées avec transmir, 120 avec un crochet et 167 avec le bowling; En présentant une fourchette de taille comprise entre 10,5 et 96,5 cm de long. Pour l’analyse des aspects biologiques étudiés, 264 personnes ont été comptées, étant 180 hommes et 84 femelles, avec une gamme de taille comprise entre 25 et 96,5 cm de LH et un poids total compris entre 281,5 et 10500 g.
rapport de longueur de longueur (LH-W). L’analyse a révélé qu’entre le rapport sexuel Le ratio LH-W diffère de manière significative, observant que les femelles pèsent plus que les mâles de la même longueur (Ancova: F1, 260 = 21,5, P < 0.05 ). Par conséquent, le rapport LH-W pour les hommes était W = 0,060LH2.709 (p < 0,05) et pour les femelles w = 0,039LH2.825 (p < 0,05) (Figure 2). Les valeurs de b résultant de régressions pour les deux sexes étaient nettement inférieures à 3, indiquant une croissance mineure (T test T, p > 0,05; 15).
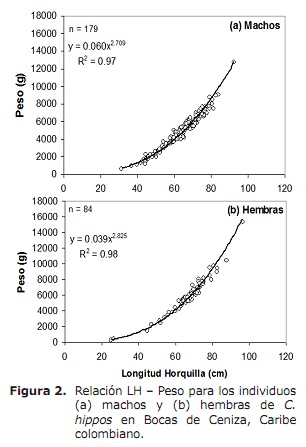
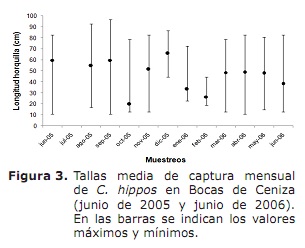
Composition de taille, taille moyenne de maturité sexuelle (L50%) et taille moyenne de capture (TMC). En général, les tailles de capture minimales ont été enregistrées en octobre, novembre 2005 et mars, avril et juin 2006; Bien que les maximes soient fréquentes tout au long de la période d’étude, à l’exception d’octobre, janvier et février (figure 3).
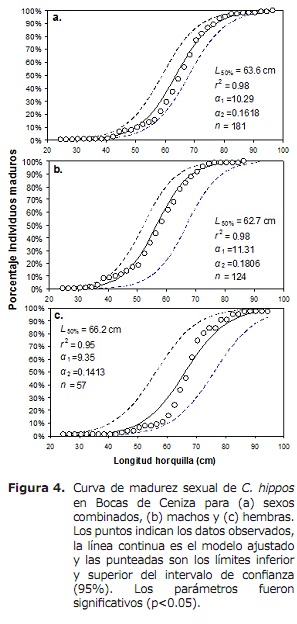
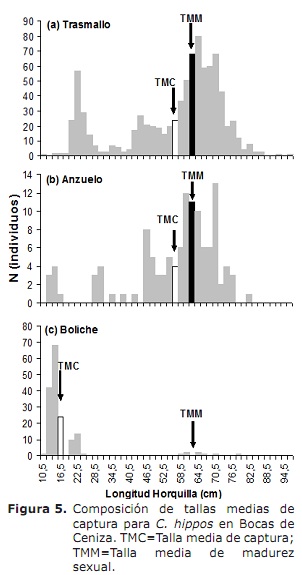
L50% pour les sexes combinés était de 63,6 cm (95% CI: 59,0-68,4 cm). Pour le cas des mâles et des femmes étaient de 62,6 cm (95% CI: 58,3-70 cm) et 66,2 cm (95% CI: 56,1-76,2 cm) respectivement (Figure 4). Le TMC mondial a été estimé à 50,3 cm de LH. Pour le cas des transmas, des crochets et du bowling ont été estimés à 56,0, 56,2 et 17,8 cm, respectivement (figure 5a, 5b et 5c), en dessous de L50%.
croissance. Les résultats de L∞ et K fournis par les méthodes Elefan I, SLCA et Projmat sont présentés dans le tableau 1. Il est observé que ces trois méthodes ont fourni des valeurs différentes pour chacun des paramètres de croissance. L’analyse de Jackknife a montré qu’il existait un effet des données sur les différents paramètres de croissance, en particulier pour SLCA et Projmat. Pour le cas d’Elefan I, L∞ variait de 77,4 à 100 cm, tandis que les valeurs K étaient comprises entre 0,20 et 0,75 an-1 (figure 6). Avec la SLCA, les valeurs les plus élevées de L∞ et K ont été obtenues avec des valeurs comprises entre 78,25 et 120 cm et entre 0,3 et 1,0 an-1, respectivement. Selon les valeurs lancées par Projmat, une dispersion moins dispersion a été observée pour K fluctuant entre 0,10 et 0,17 an-1. L’inverse s’est produit pour L∞, où les valeurs ont varié entre 87 et 120 cm, étant la fin supérieure à celle observée dans les estimateurs de croissance précédents. Les valeurs K estimées K ont montré des différences entre les méthodes, avec les plus élevées calculées par Elefan I et SLCA (tableau 1). La valeur obtenue pour l’âge hypothétique auquel l’animal (à) commence à se développer par l’équation empirique de Pauly (20) était de 0,32 an, avec un coefficient de variation de 13,92% et un pourcentage d’erreur (PE) de 10,02. L’analyse de l’indice de performance ǿ a montré des valeurs similaires entre Elefan I (3.33-3.73) et SLCA (3.17-4.45), qui ne s’est pas produite pour Projmat qui a montré des valeurs inférieures aux précédentes (2.76-3,34). Malgré tout, la variation inférieure a été présentée à Elefan I, suivie de Projmat et de la SLAC, ce dernier étant le rang le plus élevé présenté. Compte tenu du coefficient de variation (CV) de chacun des paramètres, il a été constaté que l’ELEFAN I estime que l’analyse de Jackknife avait tendance à fournir des valeurs inférieures à la LLCA, contrairement à la SLCA et à Projmat, qui ont atteint des valeurs plus élevées (tableau 1). .Le résultat de la PE obtenu pour K avec Projmat était inférieur à celui de Elefan I et de la SLACA. En conséquence, la méthode qui a jeté les estimations les plus crédibles des paramètres de croissance était projmat, suivie d’Elefan I et enfin SLCA.
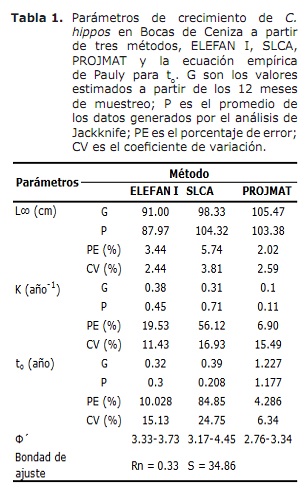
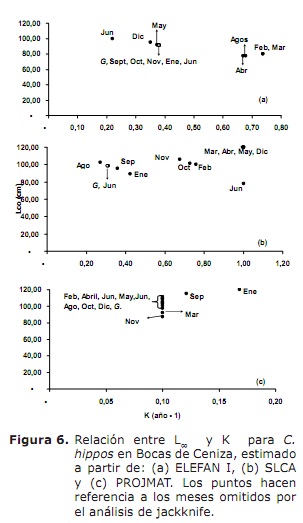
statut de mortalité et d’exploitation. Basé sur les paramètres de croissance suivants: k = 0,38 an-1; L∞ = 91 cm lh; à = 0,32 an; Oscillation saisonnière dans le schéma de croissance (c) de 0,5 et un taux de croissance minimal de 0,3, un taux de mortalité total (Z) de 1,76 an-1 (figure 7) a été estimé, oscillant entre 1,38 et 2,22 ans –1 ( de l’analyse de Jackknife).
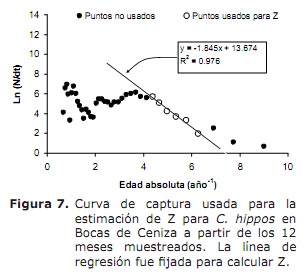
La mortalité naturelle (m) était de 1,12 an-1, variant entre 1,10 et 1,14 an-1. Le taux de mortalité de pêche (F) a été estimé à 0,63 an-1, présentant une gamme de variations comprise entre 0,2 et 1,06 an-1. Les valeurs du ratio F et Z visant à estimer le taux de fonctionnement (E) présentaient une valeur maximale de 0,5 an-1, une moyenne de 0,30 an-1.
Discussion
Rapport sur la longueur de la longueur (LH-W). Le concept de croissance implique des changements relatifs de la taille et du poids des individus (19) et leur relation a plusieurs utilisations dans la recherche de pêche. Par exemple, il est utile dans les modèles d’analyse des stocks de pêche pour estimer la biomasse d’une population; connaître l’état d’un poisson; comparer l’histoire de la vie de certaines espèces entre régions; et de déterminer le type de croissance que le poisson est généralement présent (20). C. Hippos, présente un poids sans poids de type alométrique (< 3; 15), indiquant qu’elle présente des taux de croissance différentielle pour différentes parties du corps, où la longueur augmente à un taux plus élevé que le poids.
Les résultats indiquent que cette condition était plus évidente pour les hommes que chez les femmes, étant donné que ces derniers, malgré la présentation d’une croissance alomptuaire mineure, environ une croissance isométrique. C’était concordant avec le résultat de l’ANCOVA, qui indiquait que le même LH existe des différences de poids sexuel. Les femelles de cette espèce présentent une plus grande hauteur de poids et de corps que les hommes. D’autre part, il est important de souligner que les échantillons ont été collectés pendant un an, le ratio LH-W dans cette étude ne représente pas une période donnée de l’année. En ce sens, les valeurs B pourraient être considérées comme une valeur moyenne annuelle pour l’espèce (20). Les résultats de cette recherche étaient similaires à ceux documentés pour l’espèce dans différentes zones géographiques. Par exemple, des valeurs B basées sur B ont été documentées de 2,73 dans le sud de la Floride (21), de 2,85 en Inde (1) et de 2,91 dans le golfe de Salamanca, en Colombie (22).
croissance, état de mortalité et d’exploitation. Sur la base des paramètres de croissance obtenus par ELEFAN I, la longueur maximale estimée pour C. hippopotames dans les cendres BOCAS était de 91 cm LH correspondant à 111,81 cm de LT. Si ce dernier est converti en âge correspondant à 14 ans, obtenu avec un taux de croissance K de 0,38 an-1, suggérant que C. hippopotames est une espèce de longeva (17). D’autre part, en tenant compte de la courbe de la croissance, cette espèce est devenue rapidement jusqu’à l’âge de 5 ans. Ces données coïncident pour d’autres dépôts, tels que celui de Trachinotus Falcatus, qui atteint une taille maximale de 90 cm et a également une croissance maximale de 5 ans, à partir de laquelle elle initie la phase stationnaire de sa croissance (2).
D’autre part, les valeurs estimées pour C. hippopotames dans cette étude étaient supérieures à celles documentées dans la littérature; Bien que ceux de l’indice de performance examiné dans la littérature ont montré des valeurs très proches de l’estimation de cette étude (tableau 2). Prenant cet indice comme critère de comparaison entre les valeurs des paramètres de croissance obtenus et en tenant compte que C. Hippos est une espèce migratoire (23), on peut supposer que la croissance de cette espèce est concordante dans celle décrite dans Différents domaines de sa distribution globale (tableau 2).
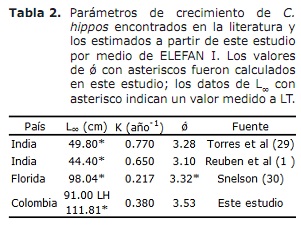
Le modèle de croissance annuel de C. Hippos a montré des oscillations (C = 0,5) avec un taux de croissance minimal au mois de septembre (WP = 0,3). Ce modèle peut être influencé par l’un des aspects les plus caractéristiques de la croissance du poisson: la variabilité observée entre les individus d’une population et entre les populations d’une espèce, qui est directement liée à l’environnement (24). Par exemple, la variabilité des conditions physiques-chimiques d’eau (24) et la qualité et la quantité de nourriture (19) conditionne la migration d’une espèce, qui englobe des déplacements de la station entre les zones de reproduction, d’alimentation et de frai (15, 25) .
basé sur ce qui précède et en tenant compte des fréquences de longueurs observées au cours de la période d’étude, qui indique également que la présence possible de saisonnalité de la croissance (13) peut être déduite que la croissance de C. hippopotames est saisonnier. En ce qui concerne le taux de croissance minimal, cet événement peut éventuellement être donné par la phase de reproduction de l’espèce, depuis en septembre, une augmentation du nombre d’individus matures (dans les étapes iii) a été observée.
D’autre part, la relation entre le taux de mortalité de la pêche (F) et la mortalité totale (Z) de 0,3, indique que la population dans la zone des bouches de cendres n’exécute pas le risque de surexploitation , dans le principe, une population atteint sa performance optimale lorsque la fraction de décès causée par F est supérieure à 0,5 (6,13). Cependant, il est important de souligner que lorsque L50% était comparé à TMC, C. Hippos a présenté une plus grande pression sur la population adulte, fréquemment capturée avec transmirement et crochet. La situation s’aggrave avec l’utilisation de Boliche, qui n’a pas seulement une incidence sur les adultes, mais aussi les jeunes, qui ne permettent pas le renouveau naturel de cette ressource de pêche.
Proposition de conception d’un système de manutention de pêche . Partant de la base selon laquelle la surpêche peut avoir lieu de trois manières différentes: (i) par rapport à la croissance; (ii) en ce qui concerne le recrutement; et (iii) la surpêche qui affecte l’écosystème (15). En ce sens, la pêche de C. hippopotames dans le secteur de la bouche des cendres peut être classée dans le premier élément, qui a lieu lorsque des individus sont capturés avant d’atteindre la taille nécessaire pour garantir le renouvellement biologique de la population. Ce qui précède est devenu un problème commun pour la plupart des espèces commerciales et a été documenté pour de nombreuses espèces côtières dans les Caraïbes colombiennes.
Tout ce qui précède, il est nécessaire que les efforts investissent pour la gestion des stratégies de conception de la gestion des stratégies pour la gestion des stratégies de conception de C. Les hippopotames de la pêche de Asho Bocks, de manière à ce qu’ils soient conformes à l’approche de précaution de la pêche responsable de cette ressource (27). Caddy (27) suggère que des stratégies doivent être appliquées dans un cadre de redondance de la direction dans le cas d’un tel cadre pouvant consister en un mélange de mesures impliquant des arts, des critères de secking temporaires et l’augmentation des tailles de capture minimales. En ce sens, en tenant compte de la L50% en tant que point de référence limite (28), il est recommandé ici de fixer la taille de la capture minimale de cette ressource à une fourche de 64 cm de long. De même, dans tous les engrenages de pêche utilisés, il est proposé d’augmenter les tailles de maille supérieures à 8,89 cm et d’utiliser des calibres crochets visant à capturer des poissons plus gros. Dans des conditions actuelles, ces engins de pêche affectent directement la fraction de jeunes individus entrant dans la première phase de maturité sexuelle. Avec les mesures susmentionnées, complétées par d’autres variables telles que la capture, l’effort de pêche et la capture par unité d’effort, ainsi que des facteurs sociaux et économiques, on s’attend à ce que C. hippopotames soit capturé dans une plus grande proportion d’individus au-dessus de L50%. garantir la durabilité de cette ressource au fil du temps. En ce sens, il est important de prendre en compte le statut multispécifique et multiflot de la pêche et, par conséquent, un processus d’accord est recommandé entre les pêcheurs, les marchands et les entités compétentes pour atteindre des accords destinés à une exploitation responsable de la ressource.
En conclusion, le Jorel ne présente pas une surexploitation dans les bouches de cendres. Cependant, lors de la comparaison de la taille de capture moyenne avec L50%, l’espèce est capturée avec le principal engin de pêche avant 50% de la population parvient à mature. Des directives pour la conception d’un système de pêche garantissent la conservation et l’utilisation durable de cette ressource sont proposées.
Remerciements
à la communauté des pêcheurs, aux membres de l’Asopscar et à Coopez. À la villa des frères et à La Pescadería El Nuevo Tambó pour sa collaboration dans la coordination des activités et de l’offre d’informations sur le terrain. Aux enseignants G. LOZANO, L.C. Gutiérrez, O. Galvis, J. Blanc et E. Viloria.
Références
1.Reuben, S, HM Kasim, S Sivakami, Pn Radhakrihnan, KN Kurup, M Sivila, noble, Kvs Nair, Raje Sg. Évaluation de la pêche, de la biologie et des stocks des ressources de Carangid des mers indiennes. Inde J Poisson 1992; 39 (3,4): 195-234.
2.CRABTREE, R, Hotte de PB, Snodgrass D. Age, Grouteur et reproduction du permis (Trachinotus Falcatus) dans les eaux de la Floride. Poisson taureau 2002; 100: 26-34.
3.River R, Solano, G.Diagnostic de l’activité de pêche artisanale dans la zone côtière du département de l’Atlantique, des Caraïbes colombiennes. Barranquilla, Colombie: Incoder; 2005.
4.Gayalino, FC, P Sparre, Paully D. Le Guide de l’utilisateur FISAT. FAO – Outils d’asessation des stocks iCLARM. Rome: FAO; 1993.
5.SPARRE, P., Venema S. Introduction à l’évaluation des ressources de pêche tropicales. Rome: FAO; 1995. Document de la pêche technique: 306/1.
6.Rueda, M, Santos-Martínez A. Dynamique de la population de la rayure Mujarra Eugerres Plumieri de la grande Ciénaga de Santa Marta, en Colombie. Poisson res 1999; 42: 155-166.
7.blanco, JA, EA Viloria, Narváez BJC. Les changements de salinité Enso et Interunnual dans le système de lagon côtier de Big Ciénaga de Santa Marta, Caraïbes colombiennes. Tablette de la côte estuaire SCI 2006; 66: 157-167.
8. Restrepo, JD, Kjerfve B. Magdalena Rivière: Variabilité interunale (1975-1995) et estimations de charge révisées de la décharge de l’eau et des sédiments. J hydrol 2000; 235 (1-2): 37-149.
9.Acevevedo a, gutiérrez ml. Quelques aspects reproducteurs de la Rhizotrionodon poreuse Toyo (1831) (Elasmobranchii: Carccharinidae). Dans le secteur de la bouche des cendres, des Caraïbes colombiennes. . Barranquilla, Colombie: Université Atlantique, Faculté des sciences de base; 1999.
10.Vazzoleler, eam. Manuel de la méthode pour Stuxes Populare Biological Studists: Reproduction et Crescimento. BRASÍLIA: CNPQ; 1982.
11.ShePerd, JG. Une méthode faiblement paramétrique pour l’analyse des données de la composition de longueur. Dans: Paully, D, Morgan GP Editors. Méthodes à base de longueur dans la recherche sur les pêches. Manille, procédures de la conférence ICLARM 13. 1987.
12.Lielie, pH. L’utilisation de matrices dans certaines mathématiques de la population. Biométrika 1945; 35: 213-245.
13.Gulland, JA, Rosemberg AA. Examen des méthodes qui sont basées sur la taille pour évaluer les populations de poissons. Rome: FAO; 1992.
14.Tordecilla-Petro G, S Sánchez-bande, olaya-Nieto ch. Croissance et mortalité de Moncholo (Hoplias Malabaricus) à la Lorica Lorica, en Colombie. REV MVZ CÓRDOBA 2005; 10 (2): 623-632.
15.Pauly, D. Quelques méthodes simples pour l’évaluation des ressources de pêche tropicales. Rome: FAO; 1983.
16.Pauly, D, Munro JL. Onze autres sur le Comparson de la croissance des poissons et des invertébrés. FISHB 1984; 1:21
17.Pauly, D. Dynamique de la population de poissons dans les eaux tropicales; Un manuel d’utilisation avec des calculatrices programmables. IClarm Stud revern 1984; 8: 235.
18.Blanco, JA. Les variations environnementales saisonnières dans les eaux côtières et son importance pour la pêche dans la région de Santa Marta, des Caraïbes colombiennes. . Santa Marta-Bogotá. Université nationale de Colombie, faculté des sciences de base; 1988.
19.Abaunza L, Karlou-Riga C, Murta A, Eltik W, García Santamaría Mt, Zimmermman C, Hammer C, et al. Croissance et reproduction du maquereau de cheval, Trachurus Trachurus (Carangidae). Rev poisson biol poisson 2003; 13: 27-61.
20.Froee, R. Cube Law, Facteur de condition et relation de poids: Histoire, méta-analyse et recommandations. JPL Appl ichthyol 2006; 22: 241-253.
21.BoHsack, JA, Harper de. Relations sur le poids de la longueur des poissons de récif marine sélectionnés du sud-est des États-Unis et des Caraïbes. NOAA Mémorandum technique; 1988. NMFS-SEFC-215.
22.DUARTE, LO, CB García, I Moreno, G Melo, P Navajas, N Sandoval, et al. Atlas démographique du golfe de Salamanque, Caraïbes colombiennes: Dynamique de la population, distribution, nourriture et reproduction. . Version 1. Santa Marta: Invemar-Unal-Colcicias; 1999.
23.Honeybrink, R. Un examen de la biologie de la famille Carangidae Whith Shahassis sur les espèces trouvées dans les eaux hawaïennes. Honolulu: Division des ressources acuatiques; 2000.
24.Macer, ct. Quelques aspects de la biologie du maquereau de cheval (Trachurus Trachurus (L)) dans les eaux autour de la Grande-Bretagne. J poisson biol 1977; 10: 51-62.
25.Harden, fr. Migration de poisson. Londres: Arnold; 1968.
26.Narváez B, JC, F Herrera, J. blanc Effets des engins de pêche sur la taille du poisson dans une pêche artisanale des Caraïbes colombiennes. Bol Invest MAR COÛT 2008; 37 (2): 163-187.
27.Caddy, JF. Gestion des pêches au XXIe siècle: De nouveaux paradigmes seront appliqués ?. Rev poisson poisson biol 1999; 9: 1-43.
28.Caddy, JF. Limitez les points de référence, les feux de circulation et les approches holistiques de la gestion de la pêche avec une contribution minimale d’évaluation des stocks. Poisson res 2002; 56 (2): 133-137.
29.Torres, FJR, MBTM Norizam, LR Garcés, Silvestre GT. La compassion des paramètres de population des espèces de poissons est couramment prise dans les chaluts d’Asie du Sud et du Sud-Est. Manille: Centre mondial de poisson; 2001.
30.Snelson, ff. Études biologiques de Crevalle Jack (Caranx Hippos) en Floride. St. Petesburg: Institut de la Floride Marine de recherche de la mer; 1992.