Papillary Neoplane indraductal pâncreas: Resultados patológicos clínicos
neoplasias mucinais papilares intraductais (IPMN ) do pâncreas: resultados clínico-patológicos
j. A.-Cienfuegos1, F. Rotellar1, P. Martí Cruchaga1, V. Valentí1, G. Zozaya1, A. Bueno1, N. Pedano1, MD Lozano2, JJ Solo2 e F. Pardo1
1Departamento de cirurgia geral e digestivo.
2 serviços de anatomia patológica. Universidade Clínica de Navarra. Pamplona, Navarra
Direção para correspondência
Introdução: A neoplasia papilar mucinosa intraductal (NPMI) do pâncreas compreende uma série de lesões que evoluem De lesões benignas (adenoma) para carcinoma ductal invasivo. Objetivo: Analisar os resultados clínicos e patológicos de 15 pacientes diagnosticados com NPMI e intervenientes de acordo com as recomendações da conferência de consenso. Material e métodos: Análise retrospectiva de 15 pacientes com 15 pacientes com NPMI, intervindo entre março de 1993 e setembro de 2009; De acordo com as diretrizes para conferências de consenso internacional. Dados demográficos, testes diagnósticos, tipo de intervenção, histopatologia e sobrevida atuarial foram coletados com um acompanhamento entre mês e meio e nove anos. Resultados: 6 Duodenopancreatetomies, 4 pancreatectomies Total, 2 pancreatectomies Central, 2 pancreatectomies pancreatectomia distal. Uma morbidade de 40% foi registrada, sem mortalidade operatória, com uma permanência média de 10 dias. Em 5 casos, o NPMI foi misturado, em 4 afetou o ducto pancreático e nos últimos 6 para ramos acessórios. Dois pacientes apresentaram carcinoma in situ e 3 carcinoma invasivo com linfonodos negativos. Um paciente, sem carcinoma invasivo, morreu em 66 meses por pâncreas adenocarcinoma. Sobrevivência atuarial até que a recorrência ou a morte fosse 105.133 meses; Com uma gama de acompanhamento entre o mês e meio e 9 anos.
O NPMI ductal e misto requer rescisão total devido à alta incidência de carcinoma invasivo ou lesões precursores de malignidade. Por sua natureza multifocal, os pacientes devem ser revisados a longo prazo. Existem controvérsias no tipo de NPMI acessório assintomático e inferior a 3 cm.
Palavras-chave: neoplasia papilar mucinosa intraductal. Fatores Prognósticos. Carcinoma invasivo. Sobrevivência.
Abstract
Background: Neoplasma mucinosa de papilar intraductal (IPMN) mostra à série de lesões que evoluem de lesões benignas – a carcinoma invasivo.
AIM: Para analisar Os resultados clínicos e patológicos de 15 pacientes diagnosticados de IPMN, e cirurgicamente tratado de acordo com as diretrizes da Conferência de Conferência Internacional. Material e método: Uma análise retrospectiva de 15 patentes tratadas cirurgicamente entre março de 1993 e setembro de 2009, de acordo com a Recomendação de consenso. Ferramentas demográficas, diagnósticas, relatório cirúrgico, banco de dados patológico e sobrevida atuarial foram analisados com um acompanhamento de um mês e meio a nove anos. Resultados: 6 patentes submetidos a pancreaticodenectomias, 4 corpo ou pâncreatortectomies parciais (enucleação ) e 1 pancreatectomia distal. Uma morbidade de 46 e 0% de mortalidade hospitalar foram avaliadas, com uma permanência hospitalar mediana de 10 dias. Em cinco casos, o IPMN foi tipo combinado (ambos os dutos principais e pancreáticos da filial) em quatro tipos de duto e duto de duto principal e tipo de duto nos outros seis também. Várias atípicas (CARCINOMA IPMN em Sitión) foram observadas em 2 patentes e carcinoma invasivo com linfonodos negativos foram identificados em 3 patentes. Um paciente sem carcinoma invasivo morrido em 66 meses de acompanhamento para pâncreas adenocarcinoma. A sobrevivência atuarial até a recorrência ou a morte foi de 105.133 meses com uma gama de acompanhamento de 1 mês e meio até 9 anos. Conclusões: O duto principal do IPMN ou o tipo misto garantem a ressecção completa devido à sua incidência de carcinoma invasivo ou lesões precursoras de malignidade também. Devido ao seu padrão multifocal, os pacientes devem ser seguidos em vigilância a longo prazo. A gestão da ramificação do tipo IPMN assintomático inferior a 3 cm é controversa.
palavras-chave: neoplasma mucinosa papilar intraductal. Fatores de prognóstico. Carcinoma invasivo. Sobrevivência.
Introdução
O pâncreas endraductal de neoplasia papilares (NPMI) compreende um espectro de lesões com características biológicas e clínicas que despertou grande interesse na última década (1-6).
A primeira série de casos clínicos de NPMI foi descrita por Ohhashi em 1982 e recebeu seu nome por SESSA em 1994 (7,8).O fato de que 20-30% do NPMI é multifocal e que 5-10% possam afetar toda a glândula, gerou múltiplas controvérsias em tratamento cirúrgico e acompanhamento desses pacientes (1-5).
Os fatos mais significativos dos NPMI são suas formas de apresentação – ductal do vanitor, de acessórios de dutos pancreáticos e progressão mista e sequencial de lesões incipientes, como adenoma para carcinoma in situ e carcinoma invasivo; Assim, deve ser considerado uma lesão precursora do câncer de pâncreas, especialmente nas lesões do ducto pancreático principal (9-13).
Para esclarecer as controvérsias acima mencionadas, várias reuniões de consenso relacionadas ao diagnóstico e tratamento . O objetivo deste trabalho é analisar os resultados do tratamento cirúrgico do NPMI e seu acordo com as recomendações das conferências de consenso (14-16).
Material e métodos
entre Março de 1993 e setembro de 2009, 38 pacientes foram intervenientes por tumores de pâncreas, dos quais 15 foram diagnosticados com neoplasia papilar mucinosa intraductal (NPMI), objeto deste estudo.
Uma análise retrospectiva das histórias clínicas, Objetivo dos principais sintomas, aqueles relacionados à cirurgia, histopatologia, sobrevivência e padrão de recorrência. A indicação cirúrgica foi estabelecida na sessão interdisciplinar, com base em diferentes testes de imagem: tomografia computadorizada multicort (TC), ultra-sonografia endoscópica (uso) com punção de agulha fina (PAAF), ressonância magnética collangiopancreatografia (CPRM) e citologia de acordo com as diretrizes do consenso Reuniões mencionadas.
Nas lesões localizadas na cabeça do pâncreas, processo desinteressado e corpo de pâncreas, duodenopancreatectomia cefálica (intervenção Krauss-Whipple). Nos lesões centrais, a pancreatectomia central foi realizada e no corpo e lesões na cauda, fluxo ou pancreatectomia distal. Em pacientes com envolvimento de todo o duto WirSung, a pancreatectomia total foi realizada. Em todos os casos, o estudo intraoperatório das bordas de ressecção pancreático foi realizado.
O diagnóstico de NPMI foi realizado de acordo com a nomenclatura estabelecida pela Organização Mundial da Saúde (OMS) (17) e a conferência de consenso realizada em Osaka em 2004 (15). Os tumores foram excluídos que apresentaram um padrão semelhante ao estroma ovariano e que foram diagnosticados como tumores químicos mucinosos (17).
O NPMI foi classificado em três categorias: aqueles que afetaram o principal ducto pancreático, aqueles que se originaram no acessório ramos e neoplasias misturadas quando afetadas os dois componentes. Os tumores foram classificados em NPMI não invasivo e NPMI invasivo; De acordo com os critérios de quem foram posteriormente publicados por Singh e Maitra (9,17).
As bordas de ressecção foram estudadas de acordo com os padrões do AJCC (manual de estadiamento do câncer) (18). A margem de ressecção pancreática foi considerada positiva sempre que qualquer grau de NPMI foi identificado microscopicamente.
A mortalidade operativa foi definida como morte na mesma renda hospitalar ou nos primeiros 30 dias de período pós-operatório. A fístula pancreática foi definida quando as concentrações de amilase foram três vezes maior do que o valor de plasma na drenagem percutânea (19). A recorrência foi definida como “local” na cama pancreática, “regional” na cavidade peritoneal e “remota”, se ocorreu no fígado, pulmão, ossos, etc. Os intervalos de confiança foram calculados com o programa EPI Info 6.0, 4C. A sobrevivência atuarial foi calculada de acordo com o método Kaplan-Meier, com o programa SPSS, versão 15.0.
na tabela i Resumindo os recursos clínicos mais relevantes da série. A incidência foi semelhante em ambos os sexos e com uma faixa etária entre 33 e 79 anos (mediana 61 anos, média 63,2 anos); Limite de confiança (LC): 95%; 55.95-70.44.
Os sintomas da apresentação eram geralmente anodyne, embora cinco pacientes estudados com sintomas específicos, como icterícia, febre, episódios anteriores de pancreatite e síndrome constitucional.
mais O teste de diagnóstico usado foi o CT-abdominal com ultra-sonografia endoscópica (uso) e punção de agulha fixa. A citologia foi positiva para o tumor mucinoso em 8 dos 9 casos em que foi realizado (88,8% de sensibilidade). Em dois pacientes, foi obtido material insuficiente.
Oito das neoplasias foram localizados na cabeça do pâncreas, em três pacientes difundidos de maneira difusa para o principal canal pancreático e no corpo remanescente de NPMI afetados -Cola, processo não acinado e em dois casos para o corpo do pâncreas.Seis duodenopancreatomias foram realizadas, quatro pancreatectomies totais, duas pancreatectomias centrais, duas pancreatectomias parciais e uma pancreatectomia distal.
As complicações foram registradas em 6 pacientes (40%). Quatro apresentaram “coleções na cama cirúrgica”, das quais 3 drenagem transgástrica necessária usando. Uma pessoa doente, que foi praticada uma enucleação, desenvolveu uma fístula pancreática aos quatro dias da descarga e foi tratada com drenagem percutânea. Outro paciente desenvolveu o esvaziamento gástrico retardado. A média permanência hospitalar foi de 10 dias (variação de 4 a 22 dias). Não houve mortalidade operacional.
Em cinco casos, o NPMI foi misturado e em quatro NPMI afetou o principal ducto pancreático (Figura 1). Nos seis restantes, o NPMI afetou os ramos de acessórios pancreáticos (Fig. 2). Em três casos, a ligeira displasia foi descrita na margem de ressecção pancreática e a ressecção não foi estendida.
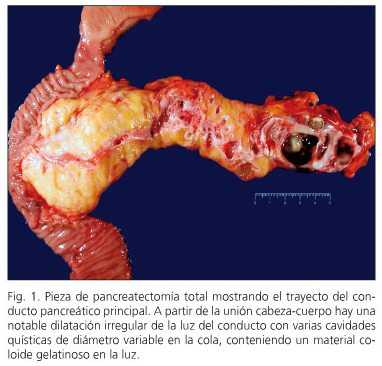
em três pacientes, a neoplasia intraepitelial pancreática (“panina” foi detectada. Em dois casos, foi o tipo de Panin-1a, lesões planas com atípico mínimo e uma lesão Panin-2 com atípico moderado. Dois pacientes tinham NPMI com displasia de alto grau -Carcinoma in situ- (casos 6 e 10) e outros três pacientes (casos 1, 2 e 3) apresentaram um carcinoma invasivo com linfonodos negativos (Figura 3). Dois deles são livres de doenças com oito e nove anos de acompanhamento, enquanto um é livre de doença aos três anos de pancreatectomia e depois de ser reinterrado de uma recorrência regional aos 15 meses de pancreatectomia.
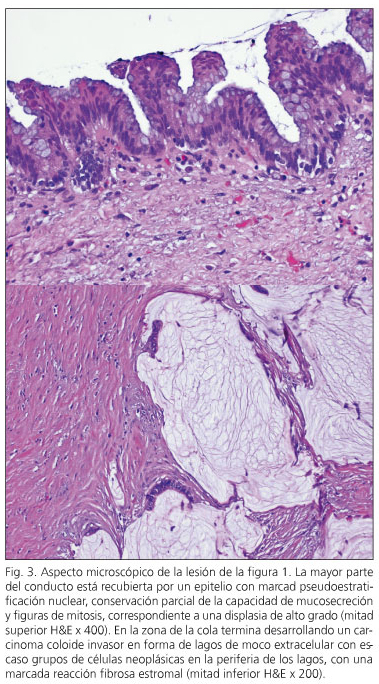
Um paciente (caso 4) morreu a cinco anos e meio de uma recorrência gânglica luxal do pâncreas adenocarcinoma. O resto dos pacientes permanecem vivos e livres de doenças. Todos os pacientes foram revisados com uma faixa de acompanhamento entre um mês e meio e nove anos; Obtendo uma sobrevida atuarial de 105.133 meses com um índice de confiança de 95% (86.264-124.003) e uma sobrevivência para a recorrência ou morte de 98,355 meses (intervalo de confiança: 76.761-119.949). Na Figura 4 a sobrevivência atuarial é coletada até a presença de recorrência ou morte.
discussão
A primeira série de NPMI foi descrita por Ohhasi em 1982 (7,20). Posteriormente Sessa et al. Eles caracterizaram a lesão com o termo atualmente empregado (8).
Finalmente, a Organização Mundial de Saúde (OMS) em 1996, por ocasião de uma classificação do exócrino do pâncreas, definiu o NPMI como papilares Proliferação de um eluggestor colunar epitélico no conduto principal ou nos acessórios de dutos pancreáticos (17). A referida classificação esclareceu uma série de termos confusos que dificultavam a sua evolução natural e realizam avaliações comparativas entre diferentes autores (5,6).
Na última década, houve uma grande proliferação de publicações Para o NPMI e estima-se que entre 8 e 20% das ressecções pancreáticas em centros de referência se devam a essa entidade (22-24). Um dos aspectos mais exclusivos são suas formas de apresentação -cutal, acessório pancreático e ramo misto, e aquele que é considerado como uma lesão de premaligação, no qual a displasia de sequência ligeiramente in situ, o carcinoma invasivo é bem estabelecido. Nas peças de ressecção pancreática, a neoplasia intraepitelial pancreática (PANIN) foram descritas, divididas por vários graus de telefone celular (Panin-1, Panin-2, Panin-3). As lesões Panin-1, por sua vez, são subdivididas no tipo de plano (PANIN-1A) e tipo papilar (PANIN-1B).
Devido a diferentes controvérsias, vários consensos e reuniões emitidas foram realizadas guias atuantes sobre isso (14-16). Embora nossa série seja limitada, representa o segundo na literatura espanhola e expressa todas as lesões NPMI, desde a sua forma mais benigna até o carcinoma invasivo. O perfil demográfico é semelhante a outras séries, apresentando-se em idades relativamente avançadas (70-80 anos); O que conseguiu levantar uma atitude “Nihilista” em relação ao tratamento cirúrgico desses pacientes.
O local mais frequente da cabeça e do corpo do pâncreas (9 dos 15 casos), e os sintomas da apresentação coincide com os descritos em outras obras (3.21-25). Em nossa série, os quatro casos com sinais de malignidade – carcinoma in situ ou invasivo – eram aqueles que tiveram afetação do conduto principal ou misto, fato de que concorda com a maioria dos autores (24,26-29).
Um paciente morreu em 66 meses, de uma recorrência ganglion de um adenocarcinoma de pâncreas (processo 3) e que apresentou o tipo de afetação mista, padrão morfológico com maior incidência de lesões invasivas na maior série (24 26-30). A possível recorrência ou tumor “de novo” pancreática apareceu aos cinco anos e meio, que é o tempo estimado (5-7 anos) para completar a evolução do adenoma ao carcinoma (9,11,12,24,27). Em uma série muito semelhante à nossa, Adsay et al. Descrevem dois pacientes com NPMI não invasivos que morreram em 65 meses da cirurgia de disseminação locorregional de um adenocarcinoma de pâncreas (21). Em um dos pacientes e carcinoma invasivo (caso 13), houve uma recorrência peritônio aos 15 meses de pancreatectomia total. Disse que os doentes permanecem vivos e livres de doença aos 3 anos depois de serem reintervados.
Multifocal envolvimento no pâncreas foi descrito até 30% dos pacientes – com variante “duto acessório” – e se ele publicou 10 % Recorrências em pacientes com NPMI não invasivo, submetidos a pancreatectomias parciais e margens negativas (31,32). O adenocarcinoma de pâncreas síncronas ou metracrônicos foi descrito em 9,2% de 76 pacientes em NPMI (33). Três dos pacientes apresentaram afetação da margem de ressecção pancreática com displasia leve. Existe acuerdo en que no es necesaria una resección más amplia del páncreas (11,16,15,32,34).
El resto de los pacientes permanecen libres de enfermedad con un rango de seguimiento entre 6 meses y 8 anos. Não houve mortalidade operatória e a morbidade de 40% é encontrada no intervalo referido por centros credenciados com experiência em ressecções pancreáticas (35,36). A hospitalização média foi de 10 dias, com um intervalo de 5 e 22 dias. Da experiência publicada conclui-se que os npmis de afetação ductal e misto devem ser resistidos cirurgicamente com a confirmação intraoperatória da ausência de invasão da ressecção pancreática, estimaram uma sobrevivência de 80% em cinco anos no caso de NPMI invasivo e 30 % em casos com carcinoma invasivo. Na Tabela II, apresentamos a recente experiência de grandes séries (26,31.37-41).
Comentamos anteriormente que a incidência de carcinoma invasivo é mais frequente nas lesões da conduta principal do pâncreas (75%), que nos ferimentos se originaram em dutos acessórios (25%) (15,24,30,42,43). Estes origens justificam o estudo de Salvia et al. Em que realizaram 89 pacientes com acessório de ramificação do tipo NPMI, assintomáticos, de tamanho inferior a 3,5 cm e valores CA-19.9 normais. No referido estudo, apenas cinco pacientes (6%) desenvolveram um aumento de tamanho e foram ressecados sem sinais de malignidade (44,45). Resultados semelhantes foram publicados por Tanno et al., No seguimento de 81 pacientes por 61 meses (46).
Após este estudo – grau de evidência 3- Diretrizes práticas recomendam o acompanhamento de Aquelas lesões que afetam exclusivamente os acessórios assintomáticos de dutos pancreáticos, sob 3 cm de diâmetro e que não apresentam nódulos dentro (15,44,47,48). O intervalo de acompanhamento – CT e EUs – não deve exceder seis meses; Devido à maior incidência de adenocarcinoma pancrean metacrônico no resto da glândula pancreática (49,50).
Baseado em experiências anteriores, podemos concluir que o NPMI com sua conduta principal e tipo misto é devido com a confirmação histológica da ausência de invasão de bordas de ressecção. Nos casos de NPMI não invasivos, uma sobrevida é estimada em 5 anos de 80% e 30% naqueles casos que apresentam um carcinoma invasivo. A Tabla II resume a experiência da série mais importante.
![]() Gerenciamento para correspondência:
Gerenciamento para correspondência:
Javier A. Cienfuegos.
departamento de cirurgia geral.
Clínica da Universidade de Navarra.
AVDA. Pio XII, 36. 31008 Pamplona, Navarra.
E-mail: [email protected]
recebido: 24-11-09. Aceito: 09-02-10.
Bibliografia
1. Garcea G, ONG SL, Rajesh A, Neal CP, Pollard CA, Berry DP, et al. Lesões císticas do pâncreas. Um dilema de diagnóstico e gestão. Pancreatology 2008; 8: 236-51.
2. Goldsmith JD. Neoplasias císticas do pâncreas. Sou J Clin Pathol 2003; 119 (1): S3-S16.
3. Basturk ou, Coban I, Adsay NV. Cistos pancreáticos: classificação patológica, diagnóstico diferencial e implicações clínicas. Arch Pathol Lab Med 2009; 133: 423-38.
4. Adsay nv. Lesões císticas do pâncreas. Patologia moderna 2007; 20: 571-93.
5. Eu Seixo Ríos, Lariño Nonia J, Igrejas García J, Lozano León A, Domínguez Muñoz Je. Tumor papilar mucinoso e intraductal: abordagem diagnóstica e terapêutica. Gastroenterrol hepatol 2008; 31: 92-7.
6. Fernández-Esprach G, Pellisé M, Ginès A.Tumor mucinoso Papilar Intraductal Del Páncreas: Una Entidade Más Desconocida Que Infrecuente. Gastroenterol hepatol 2003; 26: 562-70.
7. Ohhashi K, Murakami Y, Takekoshi T. quatro casos de câncer de pâncreas segredo muco (ABSTR). Prog Homey EndoSc 1982; 20: 348-51.
8. SESSA F, Solcia E, Capella C, Bonato M, Scarpa A, Zamboni G, et al. Os tumores paperis-mucinosos intraductais representam um grupo distinto de neoplasias pancreáticas: uma investigação de diferenciação de células tumorais e anormalidades de K-RAS, P53 e C-ERBB-2 em 26 pacientes. Virchows arch de 1994; 425: 357-67.
9. Singh M, Maitra A. Precursor Lesões de câncer de pâncreas: patologia molecular e implicações clínicas. Pancreatology 2007; 7 (1): 9-19.
10. Hruban Rh, Maitra A, Kern SE, Goggins M. Precursores para câncer de pâncreas. Gastroenterol Clin Am North 2007; 36: 831-49.
11. Maitra A, Fukushima N, Takaori K, Hruban Rh. Precursores para câncer de pâncreas invasivo. Adv anat pathol 2005; 12: 81-91.
12. Maitra A, Hruban Rh. Câncer de pâncreas. Annu Rev Pathol Mech Dis 2008; 3: 157-88.
13. Serikawa M, Sasaki T, Fujimoto Y, Kuwahara K, Chayama K. Gerenciamento da neoplasma pupillary-mucinosa intraductal do pâncreas: estratégia de tratamento baseada na classificação morfológica. J clin gastroenterol 2006; 40: 856-62.
14. Furukawa T, Klöppel G, Volkan Adsay N, Alborres-Saavedra J, Fukushima N, Horii A, et al. Classificação de tipos de neoplasia mucous-mucinosa intraductal do pâncreas: um estudo de consenso. Virchows archa 2005; 447: 794-9.
15. Tanaka M, Chari S, Adsay V, Fernandez-del Castillo C, Falconi M, Shimizu M, et al.; Associação Internacional de Pancreatologia. Diretrizes Internacionais de Consenso para Gestão de Neoplasias Mucases Intradaturais Papillary e Neoplasmas Císticos Mucinaises do Pâncreas. Pancreatology 2006; 6: 17-32.
16. Hruban Rh, Takaori K, Klimstra DS, Adsay NV, Alborres-Saavedra J, Biankin AV, et al. Um consenso ilustrado sobre a classificação da neoplasia intraepitelial pancreática e neoplasias mucinais invasoras intraductais. Sou J Surg Pathol 2004; 28: 977-87.
17. Kloppel G, Solcia E, Longnecker DS, Capella C, Sobin Lh. Digitação histológica de tumores do pâncreas exócrino. Em: Classificação Internacional da Organização Mundial da Saúde de tumores. 2ª ed. Berlim: Springer; 1996. p. 11-20.
18. Borda SB, Byrd Dr, Compton CE, Fritz AG, Greene FL, Trotti A, Editores. Pâncreas exócrino e endócrino. PT: AJCC. Manual do Estabelecimento do Câncer. 7ª ed. Nova York: Springer-verlag; 2010. p. 241-9.
19. Bassi C, Dervenis C, Buturini G, Fingerhut A, Yeo C, Izbicki J, et al.; Grupo de estudo internacional na definição da fístula pancreática. Fístula pâncreas pós-operatória: como definição do grupo de estudo internacional (ISGPF). Cirurgia 2005: 138: 8-13.
20. Ohhashi K, Takagi K. Ercp e Diagnóstico de Imagem do Câncer Pancreático (ABSTR). Endoscopia 1980; 77: 1493-5.
21. Adsay NV, Conlon KC, Zee Sy, Brennan MF, Klimstra DS. Neoplasias paperis-mucinais intraductais do pâncreas: uma análise de carcinomas in situ e invasivos em 28 pacientes. Câncer 2002; 94: 62-77.
22. Raut cp, cleary kr, staerkel ga, abbruzzesse jl, wolff ra, lee jh, et al. Neoplasias mucinais de papilares intraductais do pâncreas: efeito de invasão e status de margem pancreática em recorrência e sobrevivência. Ann Surg Oncol 2006; 13: 582-94.
23. Ubiña Aznar E, Rivera Irigoin R, Méndez Sánchez I, Fernández Moreno N, García Fernández G, Sánchez Cantos A. Sinais endoscópicos de tumor mucinoso do pâncreas. Rev esp enferm cave 2007; 7: 413-4.
24. Sohn ta, yeo cj, cameron jl, hruban rh, fukushima n, campbell ka, et al. Neoplasias mucinais de papilares intraductais do pâncreas: uma experiência atualizada. Ann Surg 2004; 239: 788-97.
25. Marín Serrano E, Macías Rodríguez Ma, Rendón Unceta P, Pérez Requena J, Guillén Mariscal P, Martín Herrera L. Tumor mucinoso intraductal pancreático. Rev esp enferm cave 2005; 11: 836-7.
26. Schnelldorfer T, Sarr Mg, Nagorney DM, Zhang L, Smyrk TC, Qin R, et al. Experiência com 208 ressecções para neoplasia mucinosa papilar intraductal do pâncreas. Arch Surg 2008; 143: 639-46.
27. Salvia R, Fernández-del Castillo C, Bassi C, Thayer SP, Falconi M, Mantovani W, et al. Neoplasias mucinais papilares intraductais principais do pâncreas: preditores clínicos de malignidade e sobrevida a longo prazo após a ressecção. Ann Surg 2004; 239: 678-85.
28. Yang Ad, Melstrom LG, Bentrem DJ. Resultados após pancreatectomia para neoplasias mucinais papilares intraductais do pâncreas: uma experiência institucional. Cirurgia 2007; 142: 529-34.
29. D’Angelica M, Brennan MF, Suriawinata Aa, Klimstra D, Conlon KC. Neoplasias mucinais de papilares intraductais do pâncreas: uma análise de características clinicopatológicas e resultados. Ann Surg 2004; 239: 400-8.
30. Rodríguez Jr, Salvia R, Crippa S, Warshaw al, Bassi C, Falconi M, et al.NEOPLASMS MUCOSÕES PROPILAIRAS INTRACTURAS DE FILIACAS: Observações em 145 pacientes submetidos à ressecção. Gastroenterologia 2007; 133: 72-9.
31. Branco R, D’Angelica M, Katabi N, Tang L, Klimstra D, Fong Y, et al. Destino do pâncreas remanescente após a ressecção da neoplasma mucinosa intradatural não invasiva. J am coll surg 2007; 204: 987-93.
32. Chari St, Yadav d, Smyrk TC, Dimagno EP, Miller LJ, Raimondo M, et al. Estudo de recorrência após ressecção cirúrgica de neoplasia mucinosa invasorial intraductal do pâncreas. Gastroenterologia. 2002; 23: 1500-7.
33. YAMAGUCHI K, OHUCHIDA J, OHTSUKA T, Nakano K, Tanaka M. Tumor Papilar Intraductal-Mucounce do pâncreas Concomitant com carcinoma ductal do pâncreas. Pancreatologia 2002; 2: 484-90.
34. Andea A, Sarkar F, Adsay Vn. Correlatos clínico da neoplasia intraepitelial pancreática: uma análise comparativa de 82 casos com e 152 casos sem adenocarcinoma ductal pancreático. Mod Pathol 2003; 16: 996-1006.
35. Joseph B, Morton JM, Hernandez-Boussard T, Rubinfeld I, Faraj C, Velanovich V. Relação entre o volume do hospital, os recursos clínicos do sistema e a mortalidade na ressecção pancreática. J am coll surg 2009; 208: 520-7.
36. Van Heek NT, Kuhlmann KF, Scholten RJ, De Castro Sm, Busch ou, Van Gulik TM, et al. Volume do hospital e mortalidade após ressecção pancreática: uma revisão sistemática e uma avaliação da intervenção nos Países Baixos. Ann Surg 2005; 242: 781-8.
37. Wada K, Kozarek Ra, Traverso W. Resultados Após a ressecção de neoplasias mucinais invasivas e não invasivas de papilares intradaturais do pâncreas. AM J SURG 2005; 189: 632-7.
38. Raut cp, cleary kr, staerkel ga, abbruzzesse jl, wolff ra, lee jh, et al. Neoplasias mucinais de papilares intraductais do pâncreas: efeito de invasão e status de margem pancreática em recorrência e sobrevivência. Ann Surg Oncol 2006; 13: 582-94.
39. Nakagohri T, Kinoshita T, Konishi M, Takahashi S, Gotohda N. Resultado Cirúrgico de Neoplasias Mucinosas Intraductais Papillary do pâncreas. Ann Surg Oncol 2007; 14: 3174-80.
40. Nara S, Shimada K, Kosuge T, Kanai Y, Hiraka N. Minimamente invasivo Carcinoma de Papillary-Mucasmo Intraductal do pâncreas: Estudo clinicopatológico de 104 neoplasias paperis-mucinais intraductais. Sou J Surg Pathol 2008; 32: 243-55.
41. Nagai K, Doi R, Kida A, Kami K, Kawaguchi Y, Ito T, et al. Neoplasias mucinais de papilares intraductais do pâncreas: características clínicopatológicas e acompanhamento a longo prazo após a ressecção. Mundo J Surg 2008; 32: 271-8.
42. Terris B, Ponsot P, Paye F, Hammel P, Sauvanet A, Molas G, et al. Os tumores mucinosos infraductais do pâncreas confinado a dutos secundários mostram recursos patológicos menos agressivos em comparação com aqueles que envolvem o principal ducto pancreático. Sou J Surg Pathol 2000; 24: 1372-7.
43. Kobari M, Egawa S, Shibuya K, Shimamura H, Sunamura M, Takeda K, et al. Tumores mucinosos paperis intraductais do pâncreas compreendem 2 subtipos clínicos: diferenças em características clínicas e gestão cirúrgica. Arch Surg 1999; 134: 1131-6.
44. SALVIA R, CRIPPA S, Falconi M, Bassi C, Guarar A, Scarpa A, et al. NEOPLASMS MUCOSSMAS PROPILASES INSTADURADAS DE RAMAS DE RAMO DO PANCREAS: Para operar ou não operar? GT 2007; 56: 1086-90.
45. Ghaneh P, Neoptolemos J. Uma nova abordagem para gerenciar neoplasias pancreáticas mucinais intraductais. Gut 2007; 56: 1041-4.
46. Tanno S, Nakano Y, Nishikawa T, Nakamura K, Sasajima J, Minoguchi M, et al. História Natural de Neoplasias Papilar Intraductais Dute Intraductal do pâncreas sem nódulos mural: resultados de acompanhamento de longo prazo. Gut 2008; 57: 339-43.
47. Bassi C, Sarr Mg, Lillemoe KD, Reber ha. História Natural de Neoplasias Mucinosas Intraductais Papillary (IPMN): evidência atual e implicações para a gestão. J gastrointest cirurg 2008; 12: 645-50.
48. Woo sm, ryu jk, lee sh, yoon wj, kim yt, yoon yb. Neoplasias mucinais paperilas intraducais do duto da filial em uma série retrospectiva de 190 pacientes. BR J SURG 2009; 96: 405-11.
49. Tanno S, Nakano Y, Koizumi K, Sugiyama Y, Nakamura K, Sasajima J, et al. Adenocarcinomas ducturais pancreáticos em pacientes de acompanhamento a longo prazo com neoplasias mucinais papilares do duto da filial. Pâncreas 2010; 39: 36-40.
50. Belyaev O, Seeling MH, Muller CA, Tannapfel A, Schmidt Nós, Uhl W. Neoplasmas mucinais de Papillary Intraductal do pâncreas. J clin gastroenterol 2008; 42: 284-94.