na antiguidade, houve uma grande controvérsia entre os estudiosos de física em relação à composição essencial de todo o assunto que eles observaram. Neste contexto, alguns filósofos da Grécia antiga levantaram que cada forma de matéria era composta de partículas que constituíam tal substância: um pedaço de papel poderia ser dividido quase inúmeras vezes até decompostos em partículas de papel primordial; Um pedaço de osso seria feito de partículas ósseas primordiais; A água do mar seria constituída por milhares de pequenas partículas de água do mar. Tais partículas elementares foram chamadas de “homeomerias” e representavam a ideia incipiente de que as coisas materiais eram compostas de minúsculos tijolos eternos, idéia que evoluiria mais tarde no conceito de “átomo”. De fato, a palavra “átomo” era igualmente cunhado pelos filósofos gregos (atribuindo o mérito especialmente para o demócrito e a sua abordagem “O que aconteceria se para os grãos de areia, que vêm de fragmentar as rochas, ainda estou fragmentada?”) , para designar as partículas “indivisíveis” e “indissionáveis” que eles construíram tudo o que vemos.
Atualmente, sabemos que, de fato, o assunto que conhecemos é constituído por unidades que continuamos a chamar átomos. No entanto, ao contrário da concepção original, temos evidências suficientes para afirmar que os átomos não pertencem a um número ilimitado de substâncias: não há átomos de ossos, carne ou água. Todas essas substâncias complexas surgem, de fato, da combinação de um certo número de espécies químicas puras que conhecemos como “elementos químicos”, que coletamos no modelo da tabela periódica, cada uma das quais é constituída por um tipo específico de átomo Os átomos dos diferentes elementos químicos combinam entre eles para dar origem a todas as substâncias que existem e, além disso, são aquelas que dão origem às reações químicas acontecem. Por Atom, entendemos, então, para a menor unidade de matéria com Sua própria identidade e que é capaz de participar de uma reação.
Por outro lado, também sabemos hoje que os átomos são divisíveis em unidades menores que conhecemos, como um todo, como “partículas subatômicas”. Há uma quantidade considerável de partículas subatômicas e nem todas fazem parte do sujeito, mas nos átomos temos uma estrutura muito definida: um núcleo constituído por um conglomerado de partículas com carga positiva (prótons) e carga neutra (nêutrons) em número variável e uma crosta de partículas com carga negativa (elétrons). As cargas positivas compensam cargas negativas, de modo que, nos átomos neutros, a coisa normal é que existe o mesmo número de prótons como elétron.
O número de prótons é dado pelo “número atômico” , Que identifica o elemento químico que é. Por exemplo: o átomo com um próton em seu núcleo é do elemento “hidrogênio”; O átomo com dois prótons, de “hélio”; o átomo de três prótons, “lítio”, etc. Na tabela periódica, os elementos são encomendados de menor que maior dependendo do seu número atômico (Z). Por outro lado, o número de massa (a) representa o número de prótons e nêutrons, que são aqueles que concentram a maior parte da massa do átomo. No entanto, o número maciço de um elemento pode variar, para que cada elemento tenha várias versões de si, o que conhecemos como isótopos. Nos isótopos, o número de nêutrons varia, que altera a massa do átomo; Assim, muitos isótopos são instáveis e decomporem com a passagem do tempo, o que causa “radioatividade”.
Esse conhecimento tem sido o resultado do acúmulo progressivo, em todo o século XIX e XX, de evidências experimentais que foram melhorar os modelos atômicos que foram desenvolvidos a partir da concepção original do átomo. O modelo Thompson concebeu o átomo como uma sólida esfera de carga positiva com os elétrons frisados nele. Foi o primeiro modelo que associava as cargas elétricas ao átomo; Um, o de Dalton, não contemplou. No entanto, com os experimentos de Rutherford, viu-se que o átomo era principalmente espaço vazio, com cargas positivas em um núcleo cercado por uma crosta de elétrons. BOHR definiu que esses elétrons foram distribuídos em diferentes níveis de energia, com base em espectros atômicos. Com o desenvolvimento, no século XX, da teoria quântica, o modelo do átomo Bohr foi modificado até o Modelo atual, o modelo mecanocgal, influenciado pelas contribuições de cientistas como Sommerfield, Schrödinger, Broglie ou Planck.
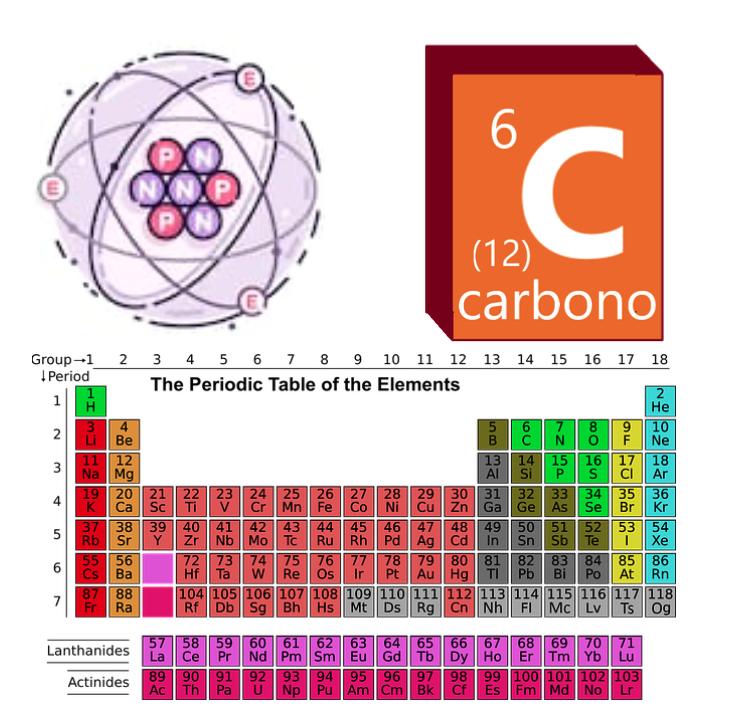 átomos não são como eles são geralmente representados, mas nós realmente não temos muitas maneiras melhores de atraí-las compreensivelmente.Portanto, geralmente adotamos modelos didáticos simples, como o modelo de Rutherford ou o modelo Bohr, onde podemos facilmente visualizar que os átomos são constituídos de vários prótons, nêutrons e elétrons intuitivamente. Na tabela periódica, os átomos são encomendados de acordo com seu número atômico (Z). O número de massa pode mudar. Carbono, por exemplo, tem Z = 6 e um número de massa variável. O isótopo mais comum é carbono-12 (AT = 12), mas também há outros isótopos muito comuns, como o carbono-14 (AT = 14), que se desintegram radioactivamente com uma certa facilidade e é usado para restos arqueológicos do datTream. / p>
átomos não são como eles são geralmente representados, mas nós realmente não temos muitas maneiras melhores de atraí-las compreensivelmente.Portanto, geralmente adotamos modelos didáticos simples, como o modelo de Rutherford ou o modelo Bohr, onde podemos facilmente visualizar que os átomos são constituídos de vários prótons, nêutrons e elétrons intuitivamente. Na tabela periódica, os átomos são encomendados de acordo com seu número atômico (Z). O número de massa pode mudar. Carbono, por exemplo, tem Z = 6 e um número de massa variável. O isótopo mais comum é carbono-12 (AT = 12), mas também há outros isótopos muito comuns, como o carbono-14 (AT = 14), que se desintegram radioactivamente com uma certa facilidade e é usado para restos arqueológicos do datTream. / p>  Projeto Dodocience é um projeto Por escondido Nature está sob licença internacional Creative Commons Reconhecimento – não comercial – compartilhada 4.0. Criado sob o projeto Nature Hidden. Você pode encontrar permissões adicionais do concedido com esta licença em nossas políticas de privacidade
Projeto Dodocience é um projeto Por escondido Nature está sob licença internacional Creative Commons Reconhecimento – não comercial – compartilhada 4.0. Criado sob o projeto Nature Hidden. Você pode encontrar permissões adicionais do concedido com esta licença em nossas políticas de privacidade