Estudo de reações adversas relacionadas à infusão paclitaxel e docetaxel
estudo sobre o Reações de análise relacionadas com o Paclitaxel e docetaxel infusão
i. J. Castro1, M. Pons Busom1, GI Ballesteros Cabañas1, E. Ramió Montero1, A. Álvarez Méndez2, R. De Castro Chivato3, M. Centelles Ruiz4
1Servicio de Farmacia, Capio Hospital Universitari Sagrat Cor, Barcelona Espanha.
2nfermera serviço de farmácia, Capio Hospital Universitari Sagrat Cor, Barcelona, Espanha.
3Enfermera Day Hospital, Capio Hospital Universitari Sagrat Cor, Barcelona, Espanha.
4songologia, Capio Hospital Universitari Sagrat Cor, Barcelona, Espanha.
Este trabalho foi parcialmente apresentado como uma comunicação posters no 56º Congresso Nacional da Sociedade Espanhola da Farmácia que foi realizada em Santiago de Compostela de 18 a 21 de outubro de 2011.
Gerenciamento para correspondência
Resumo
Objetivo: Determinar a incidência de reações à infusão de paclitaxel e docetaxel, e as causas possíveis que podem acioná-las. Método: Estudo de coorte de infusões paclitaxel e docetaxel realizada em um hospital de terceiro nível, de julho de 2010 a dezembro de 2011 (18 meses). Para cada infusão, os dados clínicos do paciente e os referentes ao taxano gerenciado foram registrados. Dada a aparência de uma reação durante a infusão, foi especificado: tipo, gravidade e se forçou a suspensão do tratamento. Histórias clínicas e ordens médicas foram consultadas. O acompanhamento das infusões foi realizado entrando em contato com o Day Hospital Enfermeiros. Um estudo descritivo das variáveis mais relevantes incluídas no acompanhamento foi realizado e analisado se algum deles pudesse influenciar a aparência de reações. Resultados: Durante o período de estudo, 357 infusões de paclitaxel e docetaxel foram administrados a 92 pacientes: média de 61,4 anos (de 11.1), 50,0% mulheres. 9 Reações infusionais foram detectadas que afetadas 8 pacientes, todas causadas por docetaxel (χ2 = 8,3, p = 0,004); 14,5% dos pacientes que o levaram e sempre durante o primeiro ou segundo ciclo de tratamento. As variáveis associadas ao aparecimento de reações foram: neoplasma pulmonar (p < 0.005), esquema docetaxel-cisplatina (p < 0,005) , Receba a droga na primeira linha (p = 0,021) e doença inconsciente (p = 0,014).
Conclusões: Em nosso centro hospitalar, a DOCetaxel é o taxano que causou mais problemas de segurança durante a sua infusão.
Palavras-chave: paclitaxel; Docetaxel; Reação de hipersensibilidade.
abstrato
Determinar a incidência de paclitaxel e docetaxel associadas à infusão, e as prováveis causas que podem acioná-las. Método: Estudo de coorte do paclitaxel e docetaxel infusões realizadas em um hospital terciário de julho de 2010 a dezembro de 2011 (18 meses). Para cada infusão, os dados clínicos e os dados relacionados a drogas foram registrados. Quando uma reação ocorreu durante a infusão, foram especificados os seguintes dados: tipo, gravidade, se a retirada do tratamento fosse necessária. Os gráficos clínicos e pedidos de tratamento foram revisados. O acompanhamento das infusões foi feito entrando em contato com os enfermeiros hospitalares do dia. Um estudo descritivo foi feito para as variáveis mais relevantes incluídas no acompanhamento e analisamos se algum deles poderia ter influenciado na ocorrência das reações.
Resultados: Durante o período do estudo, 357 paclitaxel e docetaxel infusões foram administrados a 92 patentes: média de 61,4 anos (SD 11.1), 50,0% eram do sexo feminino. 9 A infusão reage afetando 8 patentes ocorridas, todas causadas por docetaxel (χ2 = 8,3, p = 0,004); 14,5% dos pacientes recingi-lo e sempre durante o primeiro ou segundo ciclo de tratamento. As variáveis associadas à ocorrência da ocorrência da reação: câncer de pulmão (p < 0,005), docetaxel-cisplatin regime (p < 0,005) , Recebendo a droga como primeira linha (p = 0,021) e doença não avançada (p = 0,014).
Conclusões: Em nosso hospital, Docetaxel é o taxano que provocou os problemas de segurança mais frequentes durante a infusão.
Palavras-chave: paclitaxel; Docetaxel; Reação de hipersensibilidade.
Introdução
Desde algumas décadas atrás, os taxans paclitaxel e docetaxel provaram ser eficazes em uma variedade de tumores. O paclitaxel é aprovado para o tratamento de mama, pulmão (células não pequenas) e neoplasias de ovário; e docetaxel para mama, pulmão (células não pequenas), cabeça e pescoço, adenocarcinoma gástrico e próstata1,2.A ação citotóxica do taxano é sustentada na estabilização da tubulina e da formação subsequente de microtúbulos não funcionais que desencadeiam uma mitose errada, de modo que as células cancerígenas parem de dividir e terminadas por morrer1-3. Em estudos pré-clínicos, Docetaxel demonstrou ser mais eficaz do que o paclitaxel, uma vez que junta a tubulina com maior afinidade, apresenta uma ação direta antitumorial pela ativação de vias apoptóticas e maior retenção em células tumorais4.
Uma das desvantagens apresentadas Por essas substâncias, é a sua pobre solubilização, portanto, eles exigem o uso de veículos surfactantes não iônicos para sua formulação. O cremóforo, derivado polioxietilado de óleo de mamona, é a solubilização utilizada para paclitaxel e polissorbato 80 (Tween 80), outro derivado polioxietilado, é para docetaxel. Estes dois veículos aumentam as interacções farmacológicas com outros antineoplásticos (por exemplo, antraciclinas) e podem alterar a farmacocinética das drogas com as quais são formuladas, predispostas a uma maior toxicidade, especialmente no caso do paclitaxel por sua farmacocinética não linear4-6. Para minimizar as reações adversas, evitar premedientes e diminuir os tempos de administração do Paclitaxel e DOCetaxel, novas estratégias de formulação, como nanopartículas de albumina, poligluinsamatos, pró-fármacos, emulsões ou lipossomes5. Até o momento, apenas a nova formulação de paclitaxel baseada em nanopartículas de albumina (Abraxane®) foi comercializada na Espanha.
O perfil de segurança desses agentes antitumorais é divergente; Enquanto o Paclitaxel está mais associado a neuropatias periféricas, mialgias e artralgias, docetaxel está na retenção de líquidos (ganho de peso, inflamação dos tornozelos ou zona abdominal) 5.7. Aproximadamente com a mesma frequência, as duas drogas podem causar reações à infusão (dispneia, dor no peito, angioedema, hipotensão, urticária e erupção cutânea) que dependem das características do taxano, solvente ou ambos, e cuja aparência é possível entre outras causas, para a rápida infusão dessas preparações8,9. Essas reações, muitas vezes também chamadas de reações de hipersensibilidade, geralmente ocorrem durante os primeiros minutos de infusão e geralmente na primeira ou segunda dose, sendo capaz de aparecer mesmo com premediação adequada baseada em corticosteróides e anti-histamínicos8.10.
todos Isso motivou nosso interesse em determinar a incidência de reações adversas relacionadas à infusão do paclitaxel de taxans e docetaxel em nosso centro, e as possíveis causas que podem desencade-lhes.
Estudo observacional, longitudinal e prospectivo de todos os paclitaxel ou docetaxel infusões de julho de 2010 a dezembro de 2011, em um hospital universitário de nível 3 sem transplantes.
Os pacientes tratados com paclitaxel receberam premediação oral com dexametasona 8 mg no dia anterior Para quimioterapia, e no mesmo dia intravenosamente: Ondansestron 8 mg, dexameton 8-12 mg, dexclorofeniramina 5 mg e ranitidina 50 mg, 30 minutos SO antes da sua administração. A pré-medicação usada para docetaxel consistia de dexametasona oral 8mg duas vezes por dia durante três dias, começando um dia antes da quimioterapia, e também no mesmo dia intravenosamente: ondansestron 8 mg e dexametasona 8-12 mg, 30 minutos antes de sua administração.
As marcas registradas utilizadas foram paclitaxel Hospira® no caso de paclitaxel e taxoterere® e docetaxel hospitar® para docetaxel. A DOCETAXEL foi administrada em soro fisiológico de 250 ml por 60 minutos, e paclitaxel em soro fisiológico de 500 ml em 180 minutos de infusão. Na policimioterapia, os taxinos eram sempre administrados em primeiro lugar, por isso as reações que poderiam aparecer durante as primeiras actas de infusão só podiam ser atribuídas a eles.
Um acompanhamento diário foi realizado de todas as administrações de taxanes e As seguintes variáveis foram registradas:
• idades: idade, sexo, número de história clínica e oncologista responsável.
• clínica Dados: Neoplasia, Estádio, História Patológica, Alergias, Medicação habitual e tratamentos quimioterapêuticos prévios, caso haja.
• Dados sobre tratamento de oncologia: tipo de taxan (incluindo nome comercial), dose, frequência, ciclo, concomitante quimioterapia e pré-medicação.
• Aparência de qualquer reação adversa de medicamentos (RAM) durante a infusão de taxistas, especificando o tipo e a gravidade de acordo com a classificação NCI-CTCAE V.3.0 2006 do câncer nacional Insitute11 .
Para registrar os dados relacionados ao paciente, os registros médicos foram consultados.Os dados referentes ao tratamento oncológico foram obtidos da prescrição pelo ciclo do paciente e do tratamento. O acompanhamento de cada infusão foi realizado pelo farmacêutico responsável pela área de citostáticos e do farmacêutico residente, entrando em contato com a enfermeira do hospital do dia encarregada de administrar o taxano. A proporção de causalidade das reações foi determinada pelo algoritmo Karch-lasagna modificada12.
A análise estatística das variáveis qualitativas e quantitativas foi realizada com o programa SPSS V.15.0. Foi avaliado se a variável dicotômica de RAM principal não, foi significativamente associada a cada uma das variáveis independentes. O teste qui-quadrado foi utilizado para as variáveis categóricas e o aluno t para a comparação de meios em amostras independentes, tomando p < 0,05 como proporção estatisticamente significativa.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa Clínica do Hospital e exigido para sua implementação a empresa de consentimento informado por pacientes que preencheram os critérios de inclusão.
durante os 18 meses de estudo , 4.689 drogas oncológicas foram infundidos, dos quais 7,6% corresponderam aos taxanes incluídos no acompanhamento. No total, 357 infusões de paclitaxel e docetaxel administrados a 92 pacientes (50,0% mulheres), com idade entre 36 e 79, e uma idade média de 61,4 anos (a partir de 11.1). A DOCETAXEL foi o taxan mais utilizado em número de pacientes (n = 55, 57,3%) e infusões (n = 188, 52,7%). Não foram encontradas diferenças significativas nas variáveis basais de ambas as coortes, exceto para a distribuição de neoplasias (Tabela 1): A indicação mais comum para docetaxel era câncer de mama (47,3%), enquanto para paclitaxel era do pulmão (53,7%). Mais da metade dos pacientes receberam o tratamento na primeira linha (62,5%).
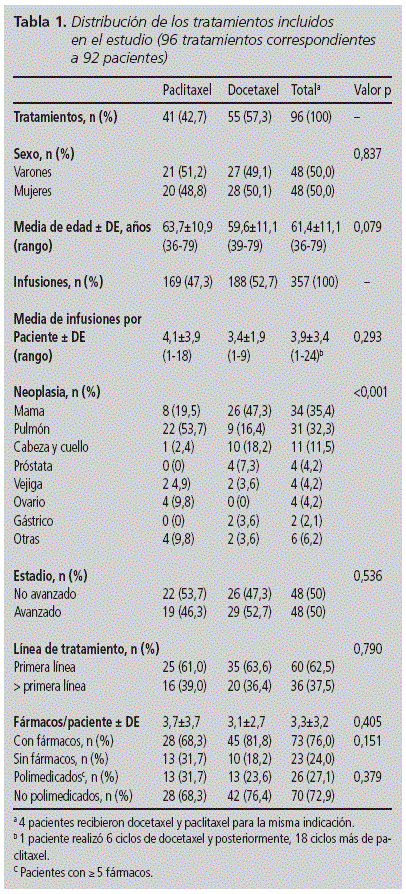
Um total foi usado de 36 Protocolos quimioterapêuticos, sendo o esquema mais utilizado para docetaxel e paclitaxel a combinação com carboplatina (cabeça e pescoço, e câncer de pulmão, respectivamente) (Tabela 2).
9 Reações infinacionais correspondentes a 8 pacientes (8,7% O total), tudo causado por docetaxel (χ2 = 8,3, p = 0,004) e sempre durante o primeiro ou segundo ciclo de tratamento. Assim, 4,8% das infusões docetaxel causaram uma reação, 66,7% (n = 6) das quais apareceram no segundo ciclo de tratamento e acabaram afetando 14,5% dos pacientes que haviam recebido essa quimioterapia. Se apenas as infusões docetaxel administradas durante o primeiro ou segundo ciclo forem selecionadas, a incidência de reações aumenta até 10,5% das administrações. Em todos os casos, as reações apareceram em pacientes com idade inferior a 65 anos (56,3 anos de 4.1), não polimeedicadas, sem alergias anteriores conhecidas e na primeira linha de tratamento.
os 66,7% ( n = 6) das reações foram consideradas como moderadas de acordo com NCI-CTCAE V.3.011. Em um dos casos, a reação foi considerada muito grave, já que foram necessárias medidas de apoio vitais. Este foi o único caso em que a reação motivou a suspensão do tratamento. Em 6 pacientes, a Docetaxel Retreat foi tolerada sem problemas e em dois pacientes foram administrados paclitaxel subsequentemente sem incidentes (Tabela 3). De acordo com o algoritmo de Karl-lasanha modificada12 todas as reações foram classificadas como prováveis.
no grupo de homens 5 Reações apareceu como um câncer de pulmão denominador comum e esquema docetaxel 75 mg / m2 + cisplatina 75mg / m2 C / 21 dias. Este regime foi administrado a um total de 6 pacientes, portanto, 83,3% daqueles que receberam este protocolo apresentaram uma reação à infusão. Nas 3 reações que apareceram em mulheres, a única neoplasia envolvida era o seio, e os protocolos quimioterápicos foram 2 vezes a combinação com trastuzumab e em um com carboplatina.
Neste estudo as variáveis que estão correlacionadas Estatisticamente com a aparência de reações à infusão DOCetaxel foram: neoplasma pulmonar (p < 0,005), Docetaxel-Cisplatin Scheme (P < 0.005) , receba a droga na primeira linha (p = 0,021) e em doença não avançada (p = 0,014). No entanto, essa correlação não foi observada com variáveis de medicação sexual, idade e habitual.
Discussão
A eficácia dos táxis pode ser comprometida pelo aparecimento de reações de hipersensibilidade durante a sua infusão. Às vezes, estes podem forçar a suspender o tratamento com que se recorram a outros esquemas que possam ser menos eficazes.
Na literatura científica, é descrito que docetaxel e paclitaxel causam reações de hipersensibilidade com uma frequência próxima a 30%, mas diminui até 2-5% se o pré-tratamento for realizado com corticosteróides e anti-histamínicos, e se for reduziu a velocidade de perfusão1,2,8,13,14. Em nosso estudo, o Paclitaxel não causou nenhuma reação com a premediação usada e infundindo-a por 3 horas2. No entanto, 9 episódios apareceram com docetaxel (14,5% dos pacientes) administrando-o por uma hora e especialistas no hospital do dia a premediação recomendada sobre a segurança técnica1. A maioria das reações (6) foram resolvidas reforçando a premedulação e reduzindo a velocidade de administração de 250 ml / h a 125 ml / h e subseqüentemente aumentando a velocidade progressivamente. Alguns autores, além de reduzir a velocidade de administração também recomendar outras opções, como reduzir a concentração de fármaco a ser administrada ou considerando a aplicação de protocolos de dessensibilização aumentando as perfusões doses15. Há estudos que também defendem a mudança de um taxano por outro quando uma reação de hipersensibilidade parece um deles 19-21. Certamente, mudando um ao outro pode favorecer a continuação do tratamento, no entanto, há controvérsia a este respeito, uma vez que outros autores, como Dizon et al.14, acreditam que isso não é possível devido à existência de uma reatividade cruzada entre os taxanes. Em nosso seguimento não houve tal reatividade cruzada, já que dois pacientes que apresentaram uma reação infusional ao Docetaxel receberam paclitaxel sem incidentes. Em 6 pacientes, o retiro docetaxel foi bem tolerado, no entanto, havia um paciente que depois de apresentar uma reação moderada ao docetaxel, re-receber este taxano e novamente apresentou uma reação, desta vez considerada a suspensão definitiva e que causou a suspensão definitiva do tratamento. Em qualquer caso, o que é claro é que a administração de qualquer taxano é contraindicada se a reação de hipersensibilidade causada por qualquer uma delas é grave (grau 3-4) 1.2.
Sintomas relacionados com essas reações, eles geralmente aparecem na primeira ou segunda infusão de quimioterapia e, geralmente, dentro de alguns minutos de iniciá-lo, como aconteceu nos 9 pacientes afetados em nosso acompanhamento. Portanto, atenção especial deve ser paga nas primeiras administrações taxanas, organizando em todos os momentos de pessoal experiente e o apoio de uma equipe de ressuscitação no caso de haver uma reação que ameaça a vida 22 do paciente. Outros cuidados que poderiam ser realizados são o monitoramento da pressão arterial e observação do paciente até 2 horas após a administração de taxane.
Em nosso estudo, a sintomatologia do paciente que tinha uma reação infusional ao docetaxel é muito séria foi caracterizada por cianose , perda de consciência, crise, insuficiência respiratória e hipotensão. A imagem foi revertida rapidamente depois de parar a infusão e com a ajuda de corticosteróides, oxigenoterapia e fluidoterapia; Esta reacção foi notificada ao centro de farmacovigilância regional. Nos outros casos mais pequenos, as reações consistiram de eritema cutânea, blush facial, dor lombar, taquicardia e em alguns casos calafrios, hipotensão e tontura. Em nenhum deles houve dispnéia ou broncoespasmo.
Dois dos pacientes que apresentaram uma reação de hipersensibilidade docetaxel reconhecida não ter tomado adequadamente a dexametasona programada no dia anterior à quimioterapia (pacientes 1 e 2, Tabela 3). Não há dúvida, que reduzir o risco de ocorrência desses eventos é levantar pacientes de tomada adequada de premedia que são pagas. Administrar uma premediação baseada em anti-histamínicos e corticosteróides antes do taxano é de escolha, uma vez que demonstrou reduzir a incidência e gravidade da retenção de fluidos, bem como a gravidade das reacções de hipersensibilidade1,2,7. Além disso, evita interrupções no tratamento e permite aumentar as doses cumulativas dos taxanes8.
Não se sabe se essas reações dependem do solvente, ou do taxano ou de ambos os componentes. Nem o mecanismo é para o qual eles aparecem também. Acredita-se que eles podem ser mediados pela ativação do complemento, liberação não específica de histamina, produção de óxido nítrico ou pela liberação de citocinas. Ao contrário do que acontece com os derivados de platina, em princípio não relaciona sua aparência com um mecanismo mediado pela IgE, uma vez que as reações geralmente aparecem dentro de alguns minutos após o início da infusão durante o primeiro ou segundo ciclo de tratamento, o que sugere que não há necessidade para pré-sensibilização23-25.Outro aspecto para levar em conta, e que, com a bibliografia, consultado não foi elucidada com precisão8,26, é determinar se há aspectos clínicos ou subjetivos que poderiam predispor o paciente a uma reação de hipersensibilidade aguda ou qualquer outro RAM.
Em nosso estudo, os fatores que estavam intimamente relacionados ao aparecimento de reações infusões foram: neoplasia pulmonar, esquema docetaxelcisplatina, receba a droga na primeira linha e da doença inconsciente. Desses fatores, na literatura consultado apenas para receber docetaxel na primeira ou segunda linha tem sido considerado uma variável decisiva na aparência dessas reações.
Por outro lado, é possível que o concomitante O uso de paclitaxel ou docetaxel com outros antineoplásticos, como trastuzumab, carboplatina ou cisplatina, pode melhorar a aparência de reações de hipersensibilidade, uma vez que elas também podem nos originam. Trastuzumab, como os taxanes, geralmente causam essas reações no primeiro ou segundo ciclo, mas estas não são apresentadas dentro de alguns segundos de iniciar a infusão27. Em contraste, as reações dos derivados de platina ocorrem principalmente do sexto ciclo, durante ou mais tarde à sua infusão25,28. Em nosso estudo, todas as reações apareceram em pacientes em tratamento policimiótico com estas drogas: 6 em combinação com cisplatina, 2 com carboplatina e 1 com trastuzumab. No entanto, apenas relacionamento pode ser encontrado naqueles que ocorreram durante o segundo ciclo, que é em que a combinação de drogas foi recebida anteriormente (em 6 das 9 reações em nosso estudo). Assim, em uso combinado, seria aconselhável usar uma premediação completa, monitorar de perto os pacientes e saber diferenciar reações de hipersensibilidade produzidas por cada droga, para determinar o agente causal.
Referência a possíveis vieses ou limitações de O estudo, provavelmente a incidência de reações poderia ter sido maior porque sua avaliação constitui uma variável subjetiva ou suave que depende da percepção do observador. Portanto, essa circunstância pode ter causado uma minoria de reações leves, porque eles poderiam ter ido despercebido. Outro preconceito a ser destacado, foi o uso de duas marcas comerciais diferentes de docetaxel em diferentes fases do estudo (Taxotere® e Docetaxel Hospira®), bem como uma mudança de formulação no caso do Taxotere®. Essa mesma preparação comercial foi aquela que apresentou todas as reações infusivas (duas delas com a antiga formulação), embora seja verdade que foi o mais utilizado (91,5% das infusões). Os excipientes de ambas as marcas são: etanol, polissorbato 80 e ácido cítrico, e no caso de taxoterere®, além de macrogol 300. A composição quantitativa dos excipientes não pôde ser obtida a partir das folhas técnicas, por isso não sabemos se a marca registrada ou seus excipientes poderiam influenciar a aparência das reações. Uma limitação importante do estudo, e que deve ser levada em conta para o trabalho subseqüente, foram os testes de não provocação encarregados do serviço de alergia para poder discernir se as aparições apareceram foram causadas pelo princípio ativo ou pelo excipiente. / P>
Finalmente, com os resultados obtidos neste estudo, as medidas que foram tomadas em nosso centro foram reforçarem a pré-medicação da DOCETAXEL, e fazer uma lenta administração de droga (2-3 horas) no primeiro e segundo ciclo de tratamento. Com o Paclitaxel, foi decidido continuar com a mesma metodologia de trabalho, conforme indicado na folha técnica.
Conclusões
docetaxel é o taxano que esteve relacionado a um número maior em nosso ambiente de reações adversas durante a sua infusão, superior aos dados descritos na literatura.
Uma premedulação adequada no dia e da casa do paciente, é crucial para reduzir a incidência destes.
É essencial fazer mais estudos para saber exatamente a etiologia dessas reações e, portanto, ser capaz de aplicar medidas eficazes que evitam sua aparência.
Conflito de interesse
Os autores declarar não ter nenhum conflito de interesse.
Bibliografia
1. FOLHA TÉCNICA DOCETAXEL (TAXOTERE®) (Access Junho 2010). Disponível em: www.Agemed.es
2. FOLHA TÉCNICA PACLITAXEL (Taxol®) (acesso junho de 2010). Disponível em: www.Agemed.es
3. Bagnall A-M, Forbes C, Lewis R, Golder S, Kleijnen J. Uma atualização de uma revisão rápida e sistemática da eficácia e custo-efetividade dos taxanes utilizados no tratamento do câncer de mama avançado. O Instituto Nacional de Excelência Clínica (Centro NHS para revisões e divulgação). Universidade de York, abril de 2001 (acesso junho de 2010). Disponível em: www.nice.org.Reino Unido / Nicemedia / Live / 11435/32235 / 32235.PDF
4. Gligorov j, loto j-p. Farmacologia pré-clínica dos taxanes: implicações das diferenças. O oncologista. 2004; 9 (Supl 2): 3-8.
5. Hennenfent K L, Govindan R. Novas Formulações de Taxanes: uma revisão. Vinho velho em uma nova garrafa? Anais de oncologia. 2006; 17: 735-49.
6. Dez Tije AJ, Verweij J, Loos WJ, Sparreboom A. Efeitos Farmacológicos dos Veículos de Formulação: Implicações para a quimioterapia do câncer. Clin Pharmacokinet. 2003; 42 (7): 665-85.
7. Markman M. Gerenciando toxicidades taxanas. Câncer de cuidado de apoio. 2003; 11 (3): 144-47.
8. Atualizado. Base de dados. Reações de infusão à quimioterapia sistêmica; Occubrério 2009 (Acceso Marzo 2010). Disponível en: http://www.uptodate.com/contents/infusion-reactions-to-systemicchemotherapy
9. Michaud lb. Métodos para prevenir as reações secundárias ao Cremophor El. Ann Farmacother 1997; 31: 1402-4.
10. Weiss Rb, DoneHower RC, Wiernik Ph, et al. Reações de hipersensibilidade do taxol. J clin oncol. 1990; 8: 1263-8.
11. Instituto Nacional de Câncer Critérios de Toxicidade Comum para eventos adversos (CTCAE) V3.0; AGOSTO 2006. (Acceso Marzo 2010). Disponível PT: http://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcaev3.pdf
12. Naranjo CA, Busto U, Vendedores, Sandor P, Ruiz I, Roberts EA, et al. Um método para estimar a probabilidade de reações adversas de medicamentos. Clin farmacol. 1981; 30: 239-45.
13. Série Micromedex Health Care. Banco de dados de drogas. Série Thomson (Acceso Marzo 2010). Disponível PT: www.thomsonhc.com
14. Dizon DS, Schwartz J, Rojan A, Miller J, Pires L, Disilvestro P, et al. Sensibilidade cruzada entre paclitaxel e docetaxel no programa de câncer de mulheres. Ginecol oncol. 2006; 100 (1): 149-51.
15. Markman M, Kennedy A, Webster K, et al. Reações de hipersensibilidade associadas à paclitaxel: Experiência do Programa Ginecológico Oncológico do Centro Cleveland Clinic Cancer. J clin oncol. 2000; 18 (1): 102-5.
16. Castells MC, Tennant Nm, Sloane de, Ida Hsu F, Barrett NA, Hong Di, et al. Reações de hipersensibilidade à quimioterapia: resultados e segurança da dessensibilização rápida em 413 casos. J allergy clin immunol. 2008; 122: 574-80.
17. Feldweg am, Lee CW, Matulonis UA, Castells M. Rapid dessensibilização para reações de hipersensibilidade ao Paclitaxel e Docetaxel: um novo protocolo padrão usado em 77 tratamentos bem sucedidos. Ginecol oncol. 2005; 96: 824-49.
18. Syrigou E, Dannos I, Kotteas E, Makrilia N, Tourkantonis I, Dilana K, et al. Reações de hipersensibilidade ao Docetaxel: Avaliação retrospectiva e desenvolvimento de um protocolo de dessensibilização. Int Arch Allergy Immunol. 2011; 156 (3): 320-4.
19. J lokich j, anderson n. reações de hipersensibilidade de paclitaxel: um papel para a substituição do docetaxel. O centro de câncer de Boston. Anais de oncologia. 1998; 9: 573-4.
20. Moon C, Verschraegen CF, Bevers M, Freedman R, Kudelka AP, Kavanagh JJ. Uso de docetaxel (taxotere) em pacientes com hipersensibilidade do paclitaxel (taxol). Drogas anticancerígenas. 2000; 11 (7): 565-8.
21. Bernstein BJ. Docetaxel como uma alternativa ao paclitaxel após reações agudas de hipersensibilidade. Ann farmacother. 2000; 34 (11): 1332-25.
22. Baker J, et al. Efeitos colaterais relacionados ao docetaxel e sua gestão. Jornal Europeu de Enfermagem de Oncologia. 2009; 13: 49-59.
23. Lee C, Gianos M, KlausterMeyer WB. Diagnóstico e gestão de reações de hipersensibilidade relacionadas com os agentes de quimioterapia do câncer comum. Ann Allergy Asthma Immunol. 2009; 102 (3): 179-87.
24. Ardavanis A, Tryfonopoulos D, Yiotis I, Gerasimidis G, Baziotis N, Rigatos G. Natureza não alérgica das reações agudas induzidas por Docetaxel. Drogas anticancerígenas. 2004; 15 (6): 581-5.
25. Sánchez-Muñoz A, Mediola Fernández C, Poza Guedes P, Canto Diez G, Bezares Montes S, Cortés Funes Hipersensibilidad Um Carboplatino Y Paclitaxel: Revisión Y Recomendaciones Clínicas. Rev OnCol. 2002; 4 (2): 68-71.
26. Cortijo-Cascajares S, Jiménez-Cerezo MJ, Herreros de Tejada A. Revisión de Las Reacciones de Hipersensibilidad A Antineoplásicos. Fazenda. 2012; 36: 148-58.
27. Chung ch. Gerenciando premediações e o risco de reações à terapia de anticorpo monoclonal infusional. Oncologista. 2008; 13: 725-32.
28. Markman M, Kennedy A, Webster K, et al. Características clínicas de reações de hipersensibilidade à carboplatina. J clin oncol. 1999; 17 (4): 1141-5.