Introdução
A esclerose lateral amiotrófica (ELA) tem como uma característica principal a perda seletiva de neurônios motorizados no cérebro, tronco cerebral e medula espinal1. A maioria dos casos da ELA são esporádicos, mas aproximadamente 10% dos pacientes têm histórico familiar2, e esses pacientes, 20% têm mutações no superóxido CU2 + / ZN2 + superóxido1 (SOD1) 3. Além disso, o TDP-43 e a Proteína da Fig / TLs podem ser associados em pacientes com uma família e ELA4,5 e a maior porcentagem de casos foram ligados a uma expansão intromada de uma repetição GGGGCC de hexanucleótido no gene C9ORF726 .
O mecanismo pelo qual os neurônios motores se tornam seletivamente vulneráveis e morrem em pacientes com ELA ainda são desconhecidos. O padrão de progressão clínica encontrado em ratinhos transgênicos transgênicos mutados pode indicar que a doença se espalha centrífuga de uma região afetada a uma área adjacente; Portanto, pode-se especular que os produtos tóxicos gerados em uma área difundiram a lesão, afetados por neurônios adjacentes e, assim, espalhando a doença, e uma possibilidade é que esses fatores possam ser veículos através do fluido cerebrospinal (LCR) 7. Esta suposição levou vários pesquisadores a desenvolver experimentos para investigar se in vitro incubação em culturas neurônicas e linhas celulares neuronais com o FCR de pacientes com ele (ELA-LCR) poderia causar danos celulares, que foi confirmado na maioria dos estudos7-22 como revisão , embora não em all23. Nosso grupo determinou que a Ela-LCR afeta a viabilidade dos neurônios motor corticos cerebrais de rato mantidos em culturas primárias; No entanto, esse efeito parece ser mediado por um mecanismo independente de glutamato, embora a Ela-LCR causasse uma elevação da concentração de linha de base de citose de CA2 + () dos neurônios motor24,25. Esses dados apoiam a presença de fator (s) tóxico (s) no (s) ela (es) responsável (s) para causar danos causados por neurônios motorizados em experimentos in vitro, mas é possível que não em todos os pacientes ou em todas as fases da doença26. A questão é se o ela-lcr também pode causar danos cerebrais in vivo. De fato, a injeção intratecal ou intracerebroventricular aguda de ela-lcr produz mudanças na atividade neuronal, na expressão de receptores de glutamato e canais de íons, em proteína fosforilação após apenas 2ndies após a injeção27-99, induz alterações mitocondriais, estresse oxidativo ou disfunção lisossômica30.
Estas experiências produzidas com injeções pontuais não imitam o curso temporário do ELA e, portanto, não o reproduzem. Portanto, parecia apropriado realizar os experimentos que descreveremos aqui: o exame das mudanças cerebrais histopatológicas e funcionais que ocorrem após a infusão contínua de ELA-LCR para 20 ou 43dias, alcançadas pelo uso de um minibalto ligado ao Ventrículo cerebral de rato através de uma cânula, a fim de determinar as conseqüências da mais prolongada exposição de ELA citotóxico. Embora não encontremos mudanças funcionais semelhantes ao ELA, encontramos maior expressão precoce de moléculas de sinalização neuroprotética, uma reação neuroinflamatória precoce acompanhada por microglia ativada e astroglyiose, bem como a superexpressão de proteínas citoplasmáticas ligadas pela ELA como TDP-43, cistatinaque e Transferrina.
Modos e métodos Hefalloquideo e preparação de elc citotóxico (CELA-LCR)
As amostras de LCR foram coletadas por punção lombar em 32 pacientes com ALA diagnosticados de acordo com os critérios de diagnóstico de El Escorial31 (25). ** Extraído entre 1,5 e 3CC de cada paciente, centrifugado a 1.500rpm durante 10min, e dividido em 4 a 5 alíquotas para fins de estudo. Um consentimento informado de cada paciente foi obtido. Dezesseis pacientes eram mulheres; A idade média da série foi de 59 anos no momento da extração de LCR. Quatro pacientes tinham a família e o resto eram esporádicos; 11cases foram apresentadas como uma forma de aparência bulbar, 20 casos sofreram o tipo de espinha, e um paciente apresenta sintomas em ambos os locais. Dos pacientes com ELA, apenas 4 mutações apresentadas no gene SOD1 e uma era assintomática, o que significa que a FCR de pacientes com um mecanismo de genética SOD1 teve uma presença muito baixa no grupo ELA-LCR.Vinte amostras (68,7%) mostraram uma citotoxicidade significativa (CELA-LCR) usando o método descrito abaixo. As amostras de LCR usadas como controles (no-ela lcr) foram obtidas de pacientes que sofrem de dor de cabeça ou convulsões e necessitavam de punção lombar durante um exame de rotina. Um consentimento informado dos controles também foi obtido. As amostras de LCR permaneceram congeladas a -80 ° C até serem utilizadas.
Para demonstrar citotoxicidade, culturas de células de neurônios motor in vitro, como foi previamente descrito24. Para estas experiências, os neurônios foram obtidos da motocicleta cerebral de embriões de ratos 20day. As células obtidas foram semeadas a uma densidade de 105 saltos / ml em placas de 48 poços contendo 0,25 ml de meio neurobasal suplementado com B-27 e cultivados por 8-10 dias. Após esse período, as culturas foram incubadas por 24h com 10% de ela-lcr e a viabilidade dos neurônios foi medida com ensaios MTT32. O ELA-LCR conseguiu que os animais fosse preparado pela partilha de frascos de LCR que exibiram efeitos citotóxicos in vitro (pelo menos 20% de perda de neurônios motorizados), e a maioria das CSM incluídas nesse grupo foi tomada em pacientes com elo esporádico. As amostras de controle de LCR para não-tóxicas de 3 pacientes também foram consideradas antes da Administração ICV.
Animais
Os animais foram manipulados de acordo com os princípios do cuidado animal de laboratório publicado pelo Comitê de Ética Espanhola (RD 1201/2005) e a Directiva Europeia 86/609 / CEE; O procedimento foi aprovado pelo Comitê de Ética para o cuidado e uso de animais de pesquisa no hospital clínico San Carlos de Madrid, Espanha. Os 28 ratos Wistar Albinas Os adultos masculinos foram obtidos dos laboratórios de Charles River. Todos os animais foram alojados sob um ciclo de luz 12h / escuro, com acesso livre a alimentos e água. Eles foram enjaulados individualmente sob condições de colônias padrão no hospital clínico de instalações da área San Carlos. O grupo LCR foi administrado aos ratos em 4 períodos. No primeiro período, 14 ratos entre 1 e 5 meses de idade (média de 3,25mes) e no segundo período, 12 ratos entre 2,5 e 5 meses de idade (média de 4,1 meses) foram injetados com o LCR descrito acima. O intervalo entre os 4 períodos foi de aproximadamente 3 meses.
Grupos experimentais
Três grupos experimentais foram projetados para este estudo. O Grupo1 incluiu 9 ratos para os quais os minibops ICV cheios de pacientes não-ela (sem ela-lcr) foram implementados. O Grupo2 foi composto por 15 ratos implantados ICV com minibocunos de ELA-LCR citotóxicos (CELA-LCR). Finalmente, 4 ratos implantados ICV com minibumps cheios de solução salina fisiológica formada ao Grupo3 (grupo de tratamento simulado ou sham).
Administração intrecessária de Cela-LCR ou No-ela-LCR
Os ratos foram anestesiados com tribromeetanol, e Um minibalma osmótico (0.15L / H; ALZET 2006, Alzet Palo Alto, CA, EUA) foi implementado via subcutânea. Digite as escápulas. Antes do implante, minibumps osmóticos foram preenchidos com a preparação correspondente para cada grupo experimental. As minibocidades foram ligadas a uma cânula de infusão cerebral (Alzet) através de um tubo de polietileno e são preparados por imersão em solução salina normal a 37 ° C durante 24h. Estes procedimentos foram realizados sob condições estéreis. A cânula foi implantada no ventrículo cerebral lateral direita (-0,5mm anteroposterior, -1,4 mm lateral e -3,3mm dorsoventral (coordenadas com base nos Paxinos ATLAS) 33 e foram fixados ao crânio com cimento dental.
O volume do tanque das bombas garante o bombeamento pelo menos durante os 42days. O LCR foi injetado intratecamente a uma taxa de 0,15L / h por um período de 43, exceto os ratos sacrificados até a data 20. Os animais que permanecem no estudo que permaneceram Até o dia 82 foram implantados com um tubo de polietileno selado mecanicamente para impedir a irritação local devido à atração contínua de água para a bomba.
avaliações clínicas
Os animais foram clinicamente testados para menos um dia por semana a partir de uma semana Após a cirurgia. Todos os testes foram realizados com os examinadores cegos para o grupo experimental ao qual cada rato pertencia. As avaliações do estudo incluíram a medição do peso corporal, a resposta para o teste de avião inclinado e a escala do motor matsumoto34. Para medir o peso corporal, os animais foram pesados a cada 4 temporada com uma escala digital.Para o teste de plano inclinado, 20 ratos foram colocados lateralmente contra o eixo longo do plano inclinado para medir o ângulo máximo em que poderiam manter sua posição no plano para 5s. Para avaliar a força de ambas as extremidades, os animais foram colocados no avião inclinado com o lado direito do corpo contra a parte decrescente da superfície inclinada, depois com o lado esquerdo do corpo que desce. Uma pontuação inferior a 70? No teste de avião inclinado, correlaciona-se bem com a aparência da fraqueza muscular em camundongos transgênicos sod1-g93A34. Para determinar a escala do motor MatsumoMoto34, a capacidade dos animais se endireitando foi testada dentro dos anos 30 de ser manipulada em ambos os lados (reflexo de endireitamento). Os ratos que eram capazes de endireitar de ambos os lados foram examinados por sua capacidade de permanecer em sua gaiola de habitação espontaneamente durante 1min. Se eles mostraram pouco movimento em suas gaiolas, eles se mudaram para outra gaiola para ativar a motivação de exploração. Se os ratos não mostraram anomalias de acordo com essas avaliações, eles foram examinados completamente para ver se tinham quaisquer déficits funcionais observáveis, como paralisia das extremidades ou sintomas de fraqueza muscular geral no campo aberto. Uma pontuação de 5 significa que o animal é normal e uma pontuação de 0 é um rato completamente paralisado. A escala do motor de Matsumoto foi mostrada para ser correlacionada com a perda de neurônios da coluna vertebral em um modelo transgênico mutado de SOD1-G93A34
Exame Eletromiográfico
Um eletromiograma de ratos Cella-LCR e ratos não-ela -lcr realizada por dia 82 por um neurologista especialista nesta técnica. A agulha foi inserida nas extremidades dianteira e traseira e nos músculos paravertebrais para tentar encontrar sinais de deservação como atividade de inserção espontânea (ondas positivas, fibrilações ou fascicules). Os ratos foram sedados com isoflurano em 1,5% em oxigênio de 0,7l / min durante o procedimento.
sacrifício de animais
em 20, 45 ou 82 dias após a cirurgia os ratos de cada grupo que eles foram profundamente anestesiados com uma dose de pentobarbital (60mg / kg) e fentanil (0,3mg / kg). Primeiro, 10 μl de corante azul Evans foi injetado através de um cateter ventricular para confirmar o local correto. Os animais foram sacrificados pela perfusão intracadíaca com solução salina a 0,9% seguida de paraformaldeído a 4% tamponada (0,1 m de buffer de fosfato). Após a perfusão, o cérebro e a medula espinhal foram dissecados, lavados com 0,1 m pb e crioprotectados por imersão a 30% de sacarose e compostos de outubro. O material foi armazenado a -80 ° C até o uso. Crioseciones (50μm) do córtex motor e os segmentos cervicais e lombares da medula espinhal (C5-C6 e L3-L5) foram cortados; Os cortes foram colocados em uma solução crioprotecção contendo etilenoglicol e dimetil sulfóxido e é usado para preservação de tecidos cerebrais. Dos 9 ratos no grupo não-ela-lcr, um foi sacrificado até 20, 7 a 45 dias e um dia 82. Dos 15 ratos no grupo CELA-LCR, 4 foram abatidos até 20, 7 Dia 45 e 6 por dia 82 após o implante. Finalmente, dos 4 ratos no grupo de tratamento simulado, um foi sacrificado no século XX, 2 a 45 dias e um a 82days.
Análise de histosco e imunofluorescência
4 cortes de manchas de imunofluorescência foram lavados com PBS, permeabilizados com 0,1% Triton X-100 e bloqueado com 10% de soro normal de cabra. Os seguintes anticorpos primários foram então aplicados durante a noite a 4 ° C: anti-periferina (1: 200, milipore, ab 9282); Anti-S100B (1: 200, Millipore, 04-1054); Anti-Caspase-3 (1: 200, Millipore, 04-1090); Ácido fibrillar glial anti-proteína (GFAP) (1: 500, Dakocitomation, Z0334); Anti-GTL1 (1: 200, Millipore, AB 1783); Anti-Gfap (1: 600, Millipore, MAB360); Anti-Tardbp (1: 200, Abcam, AB42474); anti-ubiquitina (1: 100, abcam ab7780); anti-transferrin-r (1: 200, abcam, ab22391); anti-colin acetiltransferase (1: 100, abcam, ab68779); anti-metallothionein (1: 100, abcam, ab12228); Anti-Stefin (1: 100, Abcam, AB68290); Anti-MHC II (1: 500, ABCAM, AB6403); Anti-IBA-I (1: 1.000, Wako, de 019-19741); Anti Panakt (sinalização de célula 2920S) e anti fosfoakt (sinalização celular 4060). As lâminas foram lavadas em 3Veces de PBS, e os anticorpos primários foram testados com CY3 (1: 1.000, Jackson) ou com anticorpos secundários conjugados Alexa 488, 555 ou 647 (1: 500, Invitrogen). As seções de 3Veces foram lavadas em PBS, contrastadas com DAPI, e montadas com o refluente do reagente (calbiochem).
Quantificação de dados imuno-histoquímicos
As imagens de fluorescência foram adquiridas com um microscópio confocal do Olympus AF1000.Um estudo imuno-histoquímico descritivo foi realizado dentro dos 3 períodos de tempo estabelecidos, uma análise das mudanças observadas em marcadores imuno-histoquímicos ao longo do tempo e comparação entre os grupos de controle e a ela-lcr. Análises histológicas examinaram as áreas intimamente relacionadas à ELA, especificamente o córtex motor, lâmpada espinhal e segmentos da coluna vertebral C5-C6 e L3-L5.
GFAP, IBA1, Caspase-3 e MHC-II
imagens confocais que eram Adquirida com a mesma configuração e distribuição de fluorescência usando o software Confocal Olympus (Olympus Flooview FV1000). A análise quantitativa foi realizada usando a versão 1.42Q do software de análise Imagej (EUA). O número de células de imuno-histoquímica positivas foi contada por levar à aleatoriamente 368μm2 de cada área analisada de 3 a 4 seções diferentes do cérebro coronal.
Periferina, S100B, Panakt, Fosfoakt e Medição de Metalothionein
para medição S100B, Panakt , Fosfoakt, Metalothionein e Periferina, foi seguido uma versão modificada do método físico dissector descrito por Reed, usando o princípio do tijolo imparcial do dissector 3D35. A análise foi realizada por medições de densidade óptica (processamento de imagem binária de preto e branco), obtendo a porcentagem da área do campo analisado. 8 áreas por animal aleatório foram selecionadas por um experimentador cego usando o software ImageJ 1.42 (NIH).
Os dados foram processados usando o software GraphPad Prism 5. Eles foram relatados como valores médios ± padrão erro da média (SEM). Os gráficos dos resultados foram realizados usando o mesmo programa. O critério de significância estatística foi p ,05. Todos os animais sobreviveram ao implante do ICV do minibupo osmótico e nenhum deles mostrou sinais de infecção (abscesso, edema ou descarga purulenta no implante); Nenhum sofreu convulsões, agressão, piloereamento ou prostração. A infusão foi feita durante 20 ou 43dias e o curso temporário dos efeitos do LCR ou da infusão da solução salina foi avaliada em 20, 45 e 82 dias após a implantação da bomba mini-emitic. avaliações clínicas e eletromiográficas
Não foram encontradas diferenças significativas entre os ratos do grupo CELA-LCR e os outros grupos em qualquer uma das avaliações clínicas, incluindo peso corporal, o comportamento durante o teste de plano inclinado e as escamas matsumoto, que eram todas normais. Em relação aos eletromagramas, as ondas agudas foram consideradas positivas nas extremidades traseiras, nas extremidades da frente e nos músculos paravertebrais sem potencial fibrilação ou fasciculação em 6 dos ratos do grupo Cela-LCR para a 82dias após o implante, que não ocorreu no controles, embora um padrão de desnervação não tenha sido observado.
A ativação microglial e expressão do GFAP, S100B, GLT1 e o caspase-3
era óbvia lustrosa reativa, ativação microglial e expressão da Caspase-3 na casca do motor em Os 3 grupos experimentais aos 20 dias após o implante. Esses achados poderiam ser atribuídos a uma resposta inflamatória secundária à intervenção cirúrgica. No entanto, os 45 dias após a cirurgia, houve um aumento significativo na reatividade glial e da resposta microglial em todas as regiões do grupo CELA-LCR (Figs 1 e 2). Nos segmentos da medula espinhal dos animais que receberam CELA-LCR, observou-se que alguns motorionurons foram envolvidos por células microgliais. A quantificação imuno-histoquímica do marcador IB-1 revelou alterações na morfologia da Microglia, passando de um estado de descanso caracterizado por um Microglial Som com processos finos e ramificados para uma microglia ativada com Ramificações escassas. Órgãos celulares alongados foram observados com processos longos e mais espessos para os 20Des após o implante, enquanto as células amebéidas foram encontradas com corpos redondos com processos curtos, grossos e robustos a 45 e 82 dias, indicando uma ativação de células fagocíticas na proximidade do neurônios. Essas células expressam MHC-II, que marca as fases inflamatórias. Em grupos de tratamento simulados e não-ela-lcr, a expressão do MHC-II foi 3 vezes menor do que a observada no grupo CELA-LCR (Figura 3). Um ponto interessante foi a forte expressão de astrócitos e a descoberta de astrócitos hipertróficos que superexpressavam o gfap nas proximidades dos neurônios motor corticos e da medula espinhal. Alterações mais pronunciadas foram observadas aos 45 dias após a cirurgia. Houve também uma expressão de MHC-II, mas a níveis mais baixos, aos 82 dias (Fig. 3). Ao contrário dos dados observados no Grupo CELA-LCR, foi encontrada uma diminuição na expressão do GFAP e do CasPase-3 nos outros 4 grupos, incluindo os 82 dias após a cirurgia.Da mesma forma, observou-se um ligeiro aumento na expressão do transportador de glutamato GTL1, que foi ligado à ELA, e sua expressão é modificada por ELA-LCR36. GTL1 foi encontrado nas proximidades dos neurônios da coluna vertebral do grupo CELA-LCR que se correlaciona com a expressão do GFAP como um marcador de ativação de astrócitos. A sobre-expressão de S100B apareceu aos 45 e 82 dias no grupo Cela para LCR única.
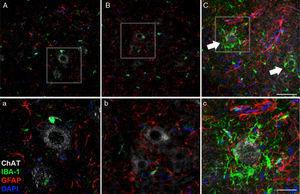
45 dias após a cirurgia, aumento da reatividade glial e resposta microglial No grupo Cela-LCR em todos As regiões do cérebro estudaram, era evidente. Por exemplo, no chifre anterior (segmento lombar) dos ratos da Cella-LCR, encontramos uma maior expressão de GFAP com astrócitos hipertróficos abundantes (Painel C, C); Além disso, uma densidade mais elevada de IB-1 culas positivas foi identificado com processos ampliados, muitas vezes em estreita proximidade com os neurónios motores ou mesmo em torno destes neurónios (setas no Painel C, as setas e detalhe do Painel C). Essas mudanças não foram observadas nos grupos Sham e não-LCR, nos quais as células de microglia isoladas ocasionalmente observadas perto dos neurônios motores. Escala: A-C: 60μm; Detalhes AC:.. 30um
imagem microscopia confocal do córtex motor, exemplificando os dados apresentados em tabelas (diferentes momentos do estude) O aumento das células Positivo do IB-1 e do GFAP nos animais do grupo CELA-LCR (C) é evidente, em comparação com o grupo Sham (A) e o grupo Nola-LCR (B). Camada de casca de motor 4-6, 45dias após a cirurgia. Barra de escala:. 50 um
<. div>
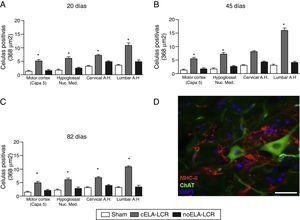
AC) A análise quantitativa da expressão de MHC-II em várias regiões do cérebro e medula espinhal, nos 3 períodos de tempo estudados. O grupo CELA-LCR mostrou um aumento significativo no número de células microgliais, que é uma evidência clara de um estágio neuroinflamatório. D) Imagem representativa de células positivas para MHC-II na região lombar. Estas células também foram observadas nas proximidades dos neurônios motores. Escala: 50 m; * p0.05; Os dados são apresentados como média.
(0.28MB).
expressão de Panakt e Fosfoakt
a fim de entender se o aumento da caspase-3 foi acompanhado por um aumento na expressão da proteína intimamente relacionada com a sobrevivência e a apoptose de resistência, como Fosfoakt e Panakt, foi realizado sua quantificação. Basicamente, o grupo de tratamento simulado e o grupo não-ela-lcr mostraram mudanças significativas em todo o estudo (20, 45 e 82days).No entanto, no grupo CELA-LCR, aumentos significativos em Panakt e Fosfoakt foram encontrados em 45 dias, com uma expressão imuno-histoquímica que era 3 vezes maior do que os níveis observados nos outros grupos, mas a 82 dias após a cirurgia, esses dados eram semelhantes para o grupo de tratamento simulado (Fig. 4).

Panakt Expression (AKTPAN) e FOSFOAKT (AKTFOSFO) em várias regiões do sistema nervoso central do 3 grupos de ratos. A) Imagens de microscopia confocal da expressão de Panakt, Fosfoakt e Periferina (Perip). B) Análise de Fosfoakt e Panakt de quantificação de densidades ópticas. Maiores expressões de AKTPAN e FOSFOAKT foram observadas em 45 dias no grupo CELA-LCR (A e B). Um fenômeno interessante no grupo CELA-LCR foi o aumento da expressão de periférico, Fosfoakt e Panakt em neurônios (A). No dia 82, após a cirurgia, as concentrações de AKT (PAN e FOSFO) foram semelhantes às dos grupos simulados e não a ela-lcr, a expressão havia retornado a níveis semelhantes aos observados nos outros grupos a 82 dias de pós-cirurgia ( B) Cirurgia. Escala: 50μm.
Periferin Expression
Periferina desempenha um papel importante no transporte axonal em neurônios da coluna vertebral. Recentemente, a periférica também tem sido associada a algumas neuropatologias que caracterizam o elo esporádico, uma vez que é encontrada em Bun Rail37. Portanto, consideramos relevantes para analisar os periféricos em neurônios motores, uma vez que sua expressão está relacionada a elams esporádicos. Todas as seções do grupo CELA-LCR mostraram neurônios motorizados com expressão periférica positiva (Figs 5 e 6), mas nos animais abatidos a 45 dias, níveis 4 vezes maior do que naqueles dos outros grupos e os pontos de tempo analisados (FIG . 6). Por outro lado, as células com mais imunorreactividade do periférico também co-expressa com Panakt e Fosfoakt. Essas células mostraram o marcador periférico com um padrão filamentário, que também é observado em condições normais; No entanto, no grupo CELA-LCR, as células contendo o marcador periférico em inclusões citoplasmáticas que lembram estruturas robustas ou granulares também foram observadas, o que pode provocar a formação de precipitados ou inclusões de proteínas (Fig. 5).
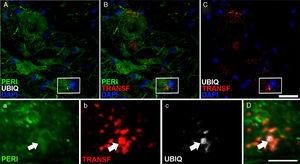
periferina expressão (peri), ubiquitina (ubiq) e transferrina após a infusão de cele- Lcr. Às 45 e 82 dias após a cirurgia, os animais com o tratamento de cessar-lcr, apresentaram inclusões no citoplasma e tinham rotulagem positiva da ubiquitina em neurônios. As inclusões de ubiquitina (flechas) foram colocadas com periférica e, ocasionalmente, com transferrina. Escala A-C: 20μm; AC e D: 2μm.
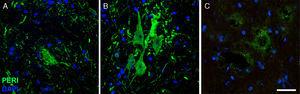
imagens de imunofluorescência mostrando a expressão de periférico (peri) ao longo do estudo do grupo CELA-LCR (A: 20dias, B: 45 dias, C: 82days). Um aumento temporário de periférico foi observado nos neurônios motores no dia 45, que retornou às condições basais por dia 82. O aumento da expressão periférica tem sido associado a eventos de lesão de coluna, enquanto a expressão é baixa sob condições normais Escala: 40μm.
co-expressão de cistatina C, transferrina, ubiquitina e tdp-43
no grupo CELA-LCR, a 45 e 82 dias após as células de cirurgia foram observadas com uma maior expressão de ubiquitina transferrina (Fig. 5) e Cistatinac. Esses dados estão intimamente ligados a formas esporádicas de ELA38. Por outro lado, observou-se que houve uma translocação de TDP-43 no citoplasma dos neurônios motorizados (Fig. 7). Curiosamente, a análise imuno-histoquímica por microscopia confocal revelou inclusões de TDP-43, ubiquitina e cistatina, e essas proteínas foram colocadas no citoplasma dos neurônios motores. O aumento dessas inclusões a 82 dias foi acompanhado por uma diminuição na expressão periférica (Fig. 6).
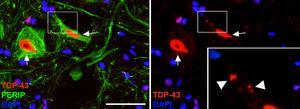
imagens em que se observa que os animais tratados com CELA-LCR apresentaram inclusões citoplasmicas de TDP-43 Nos neurônios da medula espinhal (flechas). Em detalhes, as inclusões são observadas (cabeças de seta). Escala: 40μm.
Metalothioneans
Como alguns estudos sugeriram que a homeostase de cobre e zinco pudesse contribuir para a patogênese do ELA, a expressão da metallothioneina39.40 foi estudada. A expressão de Metalotioneins estava relacionada ao curso temporário das mudanças após a cirurgia (45 e 82 dias) e ocorreu apenas no grupo CELA-LCR, em que foi observado nos neurônios motores que co-expressaram ubiquitina e transferir. O aumento do S100b medido em 45 e 85 dias após a cirurgia estava intimamente relacionado ao aumento dos periféricos nas proximidades dos neurônios motores. As células que expressam S100b corresponderam ao fenótipo de astrócitos (GFAP +) de neutrófilos adjacentes ao neurônio motor. Os astrócitos que expressam S100B estão intimamente relacionados ao equilíbrio de cálcio, zinco e cobre. O S100B é uma proteína de ligação de cálcio expressa exclusivamente por células gliais.
Discussão
O presente estudo tem como objetivo determinar as conseqüências da administração sustentada ELA-LCR em ratos, a fim de entender os efeitos que poderiam ocorrer em pacientes que apresentam citotoxicidade em seu CSF. Isto mostra que a infusão sustentada do ICV da CELA-LCR em ratos produz mudanças cytohistroquímicas no cérebro e na medula espinhal que se assemelha aos encontrados em pacientes com ELA esporádico. Essas mudanças não foram observadas em ratos infundidos com solução salina ou em animais infundidos sem ela-lcr. A infusão foi realizada durante 20 ou 43dias e tecidos foram analisadas em 20, 45 e 82days após a implantação da cânula. Os animais do estudo que foram sacrificados aos 82 dias receberam a infusão durante apenas os primeiros 43Dies.
As alterações relevantes nas células a 45 dias foram uma ativação microglial seguida da astrogliose. A ativação e proliferação de microglia antes do surgimento de sinais clínicos também são produzidos em pacientes com ele41, bem como camundongos transgênicos sod1-g93A42. Além disso, em camundongos transgênicos ELA, a microglia ativada aparece antes da aparência da perda neuronal43. Isto é mantido em conformidade com a observação de que a expressão reduzida do SOD1-G93A nas células microgliais diminui a progressão da doença e prolonga a sobrevivência44. Pelo contrário, as células microgliais que expressam o aumento do SOD1-G93A no aumento da neurotoxicidade e aumento na produção de citocinas, no e MCP-1 após a ativação in vitro45. Essas descobertas apóiam a ideia de que a ativação da microglia pode desempenhar um papel relevante no desenvolvimento de ELA46.47. Para os 45ds após o implante (43 dias de infusão com Ela-LCR) encontramos células de microglia nas proximidades com os neurônios da medula espinhal.Essas células mostraram a morfologia típica da ativação concomitante com maior expressão do MHC-II, que é considerado um marcador da resposta inflamatória dependente do complemento4.49. A astrogliose está claramente presente, embora seu envolvimento na patogênese da ELA seja ainda desconhecido e se aparece antes ou após a ativação microglial. Outro achado notável foi a superexpressão de S100b em astrócitos a 45 e 82 dias. Esta proteína foi correlacionada com a sobrevivência em ELA50.51 e é regulada em astrócitos e neurônios motores da medula espinhal em pacientes52, bem como em ratos infundidos durante 48h com a ELA-LCR53. Astrócitos com inclusões também estão presentes em ratos mutantes sod154. Da mesma forma, observou-se que astrogliose e superexpressão do GFAP apareceram após a ativação da microglia. Isto poderia apoiar a ideia de um mecanismo de neuroinflamação como um evento inicial na patogênese da doença.
Nos últimos anos, a ênfase foi colocada na translocação citoplasmática do TDP-43, uma proteína codificada por O gene cujas mutações de TARDBP foram associadas ao ELA4. Observamos que o TDP-43 é encontrado em inclusões de ubiquitina no ELO esporádico, mas não nos casos SOD1 mutação. A presença citossólica de TDP-43, colocada com a ubiquitina, em 45 e 82 dias no grupo CELA-LCR apoia a ideia de que essas mudanças estão relacionadas ao ELA esporádico. Isto é reforçado por nossas descobertas de que as primeiras mudanças nos neurônios motores incluíram a superexpressão de cistatinaque, transferrina e periférica, 3 proteínas que estão intimamente ligadas a corpos de Buni no ELA37,55.56 esporádico. De fato, as mutações periféricas já foram associadas ao ELA57 esporádico.
Outra variável que foi avaliada foi a via de sinalização PI3K / AKT relacionada à sobrevivência celular58. Encontramos um aumento na expressão de Panakt e Fosfoakt por dia 45 em ratos tratados com CELA-LCR. Esta foi uma descoberta interessante considerando que a Periferina também é um substrato PI3K. Vale a pena notar que o aumento da expressão PI3K, mas não AKT, foi encontrado na medula espinhal dos pacientes com ELA59. No entanto, o aumento do Fosfoakt foi observado em medulas espinhas de ratos SOD1-G93A na fase assintomática60. Por outro lado, os estudos in vitro indicam que o PI3K / AKT é alterado em células de ratos mutados SOD1-G93A61. Portanto, o caminho periférico e pi3k / akt poderia aumentar como uma resposta ao estresse celular causado pela CELA-LCR. O aumento do caspase-3 como um sinal de apoptose nesses ratos é compatível com este ponto de vista e com a descoberta de neurônios motor apoptóticos em ELA62-64.
O último encontro que deve ser mencionado O aumento na expressão da metallothionein em ratos infundidos com a CELA-LCR. Isto está de acordo com níveis mais altos de níveis mais altos de metalotioneanos em camundongos mutados SOD165-67; Um aumento semelhante no seu mRNA também foi descrito nestes mice68. Em consistente com isso, é a observação que em camundongos que vêm do cruzamento de roedores com ele e deficiência de metallotioneína, a progressão da doença68 é acelerada e que sua maior expressão representa uma melhor. Em contraste, a expressão de Metalotionein e seu mRNA diminuiu em ELA70. Malothioneins são proteínas de ligao CU / Zn que reduzem produtos reactivos de oxigênio e a toxicidade de metal neutralizam. Neste contexto, a busca por maior expressão de metallotioneína pode significar que uma reação neuroprotetora é desenvolvida em resposta à infusão crônica de Cela-LCR no rato; Isto é mantido de acordo com a descoberta, aumento da expressão da metallotioneína nos neurônios motores da medula espinhal de camundongos mutados com a ELA, que tenta evitar a perda de neurônios e inibe a progressão da doença71.
Os achados histopatológicos descritos são compatíveis com a hipótese de que a citotoxicidade da CSF em ratos, induziu semanas de infusão prolongada da ICV da Cela-LCR, produz mudanças em uma medula espinhal e na medula espinhal semelhantes às das formas esporádicas da ELA. Nosso estudo mostra algumas limitações. Primeiro, os sintomas clínicos estão ausentes nos 3 períodos estudados (20, 45 e 82 dias). Em ratos SOD1-G93A-ELA, os primeiros sintomas clínicos aparecem em 90-100 dias de idade72, mas roedores com outras mutações podem começar a mostrar sintomas clínicos posteriormente38. Anomalias precoces foram observadas, como a fragmentação de Golgi para a idade de idade73; Também parece possível que mudes sutis ocorram antes daquele idade74. Em ratos com mutações de SOD1, as primeiras alterações aparecem na medula espinhal cervical38.As alterações também foram observadas na medula espinhal cervical e lombar semelhantes às observadas no córtex motor cerebral, o que indica que o efeito prejudicial da Cela-LCR infundiu no ventrículo cerebral se espalhara distalmente para a medula espinhal. Essa observação é compatível com a hipótese de que a progressão da doença poderia ser mediada em parte através do CSF. Em segundo lugar, vários marcadores de proteína ainda foram detectados que são superexpressos a 45dias, embora em pequenas concentrações, para 82dias (ou seja, periférico, gfap, Panakt e Fosfoakt); Nos outros, é superexpressado igualmente a 45 e 82dias (isto é, cistatina, transferrina, ubiquitina e translocação TDP-43), embora com a limitação de que os tamanhos de amostra de grupos de estudo não fossem semelhantes e o número de ratos dos grupos de controle foi baixo . No entanto, a expressão anormal dessas proteínas no grupo CELA-LCR é clara e os resultados diferentes nos grupos de controle confirmam que as mudanças não se devem a artefatos do método. Terceiro, Cela-LCR foi infundido pelo ICV para 43dias, que foi o termo máximo para o volume de minibupo. Apesar do fato de que a CELA-LCR não foi administrada entre o Dia 43 e o Dia 82, os neurônios motor apoptóticos foram observados apenas em animais examinados no Day82. Isso sugere que o processo prejudicial pode permanecer ativo após o dia 43, e, portanto, parece possível que a extensão da infusão de Cela-LCR) além de 43dias e / ou o próximo curso temporário da doença além de 85 dias poderia revelar as manifestações clínicas de um Neurônio motor semelhante à das formas esporádicas de ELA.
Em conclusão, este estudo apresenta as primeiras conseqüências da citotoxicidade de LCR-ELA após semanas de infusão ICV sustentada com o FCR de pacientes com ELA, que anteriormente tinha sido provar que eles mostraram efeitos citotóxicos em uma cultura primária de neurônios motores. Aos 45 e 82 dias após o início da infusão, o córtex motor, o Talloam e a medula espinhal do cervical-lombar mostraram várias mudanças nos marcadores típicos da doença humana da ELA. Esses achados podem melhorar nossa compreensão da patogênese e evolução do ELA e ajudar a encontrar novos alvos terapêuticos úteis para o desenvolvimento de novos compostos que atrasar ou mesmo prender a progressão da doença.
Financiamento
Este estudo foi suportado Por quatro subvenções concedidas a JMG por Mutua Madrileña, Espanha, em 2008 e 2009. Também foi apoiado pelas seguintes subvenções concedidas à AGG por instituições espanholas: 1) NDE07 / 09, a Agência de Laín Entralgo, Comunidade de Madrid; 2) Eugenio Rodríguez Fundación Pascual; 3) Fundação Cien, Instituto de Saúde Carlosii; 4) Renevas-retics-RD06-026, Instituto Carlosiii; 5) SAF de 2010 a 21795, Ministério da Economia e Competitividade, Espanha e 6) MAT2011-28791-C03.
Conflito de interesses
Os autores declaram que não há conflitos de interesse.
Agradecimentos
Os autores querem agradecer à colaboração de Pablo González e M. Cruz Rodríguez para a coordenação dos procedimentos de cuidados de animais, e a Fundação Teófilo Hernando por seu apoio contínuo.