Emplois d’origine
Pancrées indaductal de néoplane papillaires: Résultats cliniques-pathologiques
Neoplasmes mucineux papillaires intracés (IPMN ) Du pancréas: résultats clinico-pathologiques
j. A.-Cienfuegos1, F. Rotellar1, P. Martí Cruchaga1, V. Valentí1, G. Zozaya1, A. Bueno1, N. Pedano1, MD Lozano2, JJ Solo2 et F. Pardo1
2 Service d’anatomie pathologique. Clinic University of Navarra. Pampelune, Navarra
Direction pour la correspondance
Résumé
Introduction: Le néoplasme papillaire mucineux intracintal (NPMI) du pancréas comprend une série de blessures évoluant des blessures bénignes (adénoma) au carcinome canaltal invasif.
Objectif: analyser les résultats cliniques et pathologiques de 15 patients diagnostiqués avec NPMI et intervenaient conformément aux recommandations de la conférence de consensus.
Matériel et méthodes: Analyse rétrospective de 15 patients atteints de NPMI, intervenue entre mars 1993 et septembre 2009; Selon des directives pour les conférences internationales de consensus. Les données démographiques, les tests de diagnostic, le type d’intervention, l’histopathologie et la survie actuarielle ont été collectés avec un suivi entre mois et demi et neuf ans. Résultats: 6 Duodénopancreatectomies, 4 pancréatectomies Total, 2 pancréatectomies Central, 2 pancréatectomies partielles A pancrétectomie distale. Une morbidité de 40% a été enregistrée, sans mortalité opérationnelle, avec un séjour moyen de 10 jours. Dans 5 cas, le NPMI a été mélangé, dans 4 affecté le conduit pancréatique et dans les 6 branches accessoires restantes. Deux patients présentés dans un carcinome in situ et 3 carcinome invasif avec des nœuds lymphatiques négatifs. Un patient, sans carcinome invasif, est mort à 66 mois par le pancréas adénocarcinome. La survie actuarielle jusqu’à la récurrence ou la mort était de 105 133 mois; Avec une gamme de suivi entre mois et demi et 9 ans.
Le NPMI canal et mixte nécessite une résection complète en raison de l’incidence élevée du carcinome invasif ou des blessures précurseurs de malignité. Pour sa nature multifocale, les patients doivent être examinés à long terme. Il existe des controverses dans l’accessoire asymptomatique de type NPMI et moins de 3 cm.
Mots-clés: néoplasme papillaire mucineux intracintal. Facteurs pronostiques Carcinome invasif. Survival.
Résumé
Arrière-plan: Le néoplasme mucineux papillaire intra-matériel (IPMN) montre à une série de lésions qui évoluent de lésions bénignes -Denome-au carcinome invasif. Viser: analyser Résultats cliniques et pathologiques de 15 patients diagnostiqués par le GPMN et des traités chirurgicalement conformément aux lignes directrices de la Conférence internationale de la Conférence.
Matériel et méthode: une analyse rétrospective de 15 porteurs traités chirurgicalement entre mars 1993 et septembre 2009, selon l’Internationale Recommandation de consensus. Les outils démographiques, les outils de diagnostic, le rapport chirurgical, la base de données pathologiques et la survie actuarielle ont été analysés avec un suivi d’un mois et demi à neuf ans. Résultats: 6 Patatifs ont subi des pancréatsoCoduodénectomies, 4 pancréatectomies centrales 2 pancréactomies partielles (énucléation ) et 1 pancrétectomie distale. Une morbidité de la mortalité hospitalière de 46 et 0% a été évaluée, avec un séjour à l’hôpital médian de 10 jours. Dans cinq cas, l’IPMN était composé de type combiné (les conduits pancréatiques principaux et de la branche Invold) dans quatre types de conduits de canalisations principaux et de canalisations de branche dans les six autres. Plusieurs atypiques (carcinome IPMN à Sitión) ont été observés dans 2 portants et carcinome invasif avec des ganglions lymphatiques négatifs ont été identifiés dans 3 portants. Un patient sans carcinome invasif mordait à 66 mois de suivi pour le pancréas adénocarcinome. La survie actuarielle jusqu’à la récurrence ou la mort était de 105 133 mois avec une gamme de suivi de 1 mois et demi jusqu’à 9 ans.
Conclusions: le conduit principal de l’IPMN ou le type mixte garantissent une résection complète due à son incidence de carcinome invasif ou Les lésions précurseurs de malignité aussi. En raison de son motif multifocal, les patients doivent être suivis dans la surveillance à long terme. La gestion de la branche de type IPMN asymptomatique inférieure à 3 cm est controversée.
mots clés: néoplasme mucineux papillaire pratique intracée. Facteurs de pronostic. Carcinome invasif. Survival.
Introduction
Le pancréas endressif néoplasia papillaire (NPMI) comprend un spectre de lésions avec des caractéristiques biologiques et cliniques qui ont suscité un grand intérêt au cours de la dernière décennie (1-6).
La première série de cas cliniques de NPMI a été décrite par Ohhashi en 1982 et a reçu son nom de Sessa en 1994 (7,8).Le fait que 20-30% des NPMI soient multifocaux et que 5 à 10% peuvent affecter l’ensemble de la glande, a généré plusieurs controverses en traitement chirurgical et suivi de ces patients (1-5).
Les faits les plus significatifs de la NPMI sont leurs formes de présentation -Vanitor ductalité, d’accessoires de conduits pancréatiques et de progression mixte et séquentielle des lésions naissantes, telles que l’adénome au carcinome in situ et au carcinome invasif; Il devrait donc être considéré comme une blessure précurseur du cancer du pancréas, en particulier dans les lésions du conduit pancréatique principal (9-13).
Afin de clarifier les controverses susmentionnées, plusieurs réunions de consensus concernant le diagnostic et le traitement . L’objectif de ce travail est d’analyser les résultats du traitement chirurgical de la NPMI et de son accord avec les recommandations de conférences de consensus (14-16).
matériau et méthodes
entre Mars 1993 et septembre 2009, 38 patients ont été intervenus par des tumeurs de quistum du pancréas, dont 15 ont été diagnostiqués avec du néoplasme papillaire mucineux mucineux intractif (NPMI), objet de cette étude.
Une analyse rétrospective des histoires cliniques, Objectiver les principaux symptômes, ceux liés à la chirurgie, à l’histopathologie, au schéma de survie et de récurrence. L’indication chirurgicale a été établie dans une session interdisciplinaire, basée sur des tests d’image différents: tomographie informatisée multicort (TC), ultrasonographie endoscopique (utilisation) avec une pince à aiguilles fines (PAAF), colangiopancétographie de résonance magnétique (CPRM) et cytologie selon les lignes directrices du consensus Réunions mentionnées.
Dans les lésions situées dans la tête du pancréas, le processus non annulé et le corps du pancréas, la duodénopancrate de la duodénopancancancétomie (Krauss-Whipple) a été réalisée. Dans les lésions centrales, la pancrétectomie centrale a été réalisée et dans les blessures au corps et à la queue, le débit ou la pancréatectomie distale a été réalisée. Chez les patients ayant une implication de tout le conduit WirSung, une pancréatectomie totale a été réalisée. Dans tous les cas, une étude intraopératoire des bords de résection pancréatiques a été réalisée.
Le diagnostic de NPMI a été réalisé conformément à la nomenclature établie par l’Organisation mondiale de la santé (OMS) (17) et la Conférence de consensus tenue à Osaka en 2004 (15). Les tumeurs ont été exclues qui présentaient un motif similaire au stroma ovaraire et qui ont été diagnostiqués sous la forme de tumeurs chimiques mucineuses (17).
Le NPMI a été classé dans trois catégories: celles qui ont affecté le conduit pancréatique principal, ceux qui ont été accessoires. branches et néoplasmes mixtes lorsqu’ils ont affecté les deux composants. Les tumeurs ont été classées dans NPMI non invasif et NPMI envahissantes; Selon les critères de l’OMS et ceux publiés par la suite par Singh et Maitra (9,17).
Les bords de résection ont été étudiés conformément aux normes AJCC (Manuel de mise en scène du cancer) (18). La marge de résection pancréatique a été considérée comme positive chaque fois qu’un degré de NPMI a été identifié de manière microscopique.
La mortalité opérationnelle a été définie comme la mort dans le même revenu hospitalier ou dans les 30 premiers jours de la période postopératoire. La fistule pancréatique a été définie lorsque les concentrations d’amylase étaient trois fois supérieures à la valeur plasmatique dans le drainage percutané (19). La récurrence a été définie comme « locale » sur le lit pancréatique, « régional » dans la cavité péritonéale et « à distance » si elle s’est produite dans le foie, le poumon, les os, etc. Les intervalles de confiance ont été calculés avec le programme EPI Info 6.0, 4C. La survie actuarielle a été calculée selon la méthode Kaplan-Meier, avec le programme SPSS, version 15.0.
résultats
dans le tableau I Sommaire les caractéristiques cliniques les plus pertinentes de la série. L’incidence était similaire chez les deux sexes et avec une période d’âge entre 33 et 79 ans (médiane de 61 ans, moyenne de 63,2 ans); Limite de confiance (LC): 95%; 55.95-70.44.
Les symptômes de la présentation étaient généralement anodyne, bien que cinq patients ont étudié avec des symptômes spécifiques, tels que la jaunisse, la fièvre, les épisodes précédents de la pancréatite et du syndrome constitutionnel.
Le plus Le test de diagnostic utilisé était le CT-abdominal avec une ultrasonographie endoscopique (utilisation) et une ponction d’aiguille fixe. La cytologie a été positive pour la tumeur mucineuse dans 8 des 9 cas dans lesquels elle a été réalisée (88,8% de sensibilité). Chez deux patients, des matériaux insuffisants ont été obtenus.
huit des néoplasmes étaient situés dans la tête du pancréas, sur trois patients, il diffuse de manière diffuse au canal pancréatique principal et dans le reste du corps atteint du NPMI. -Cola, processus non conçu et dans deux cas au corps du pancréas.Six DuodenopancRéectomies ont été effectués, quatre pancréatectomies totales, deux pancréactomies centrales, deux pancréopomies partielles et une pancréatectomie distale.
Complications ont été enregistrées chez 6 patients (40%). Quatre « collections dans le lit chirurgical », dont 3 nécessitent un drainage transgastrique en utilisant. Une personne malade, qui a été pratiquée une énucléation, a développé une fistule pancréatique à quatre jours de la décharge et a été traitée avec un drainage percutané. Un autre patient a développé une vidange gastrique retardée. Le séjour moyen de l’hôpital était de 10 jours (portée 4-22 jours). Il n’y avait pas de mortalité opérationnelle.
Dans cinq cas, le NPMI a été mélangé et dans quatre NPMI affectait le conduit pancréatique principal (Figure 1). Dans les six restants, les branches d’accessoires pancréatiques atteintes de la NPMI affectées (Fig. 2). Dans trois cas, une légère dysplasie a été décrite dans la marge de résection pancréatique et la résection n’a pas été étendue.
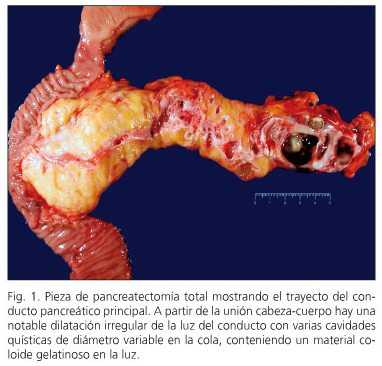
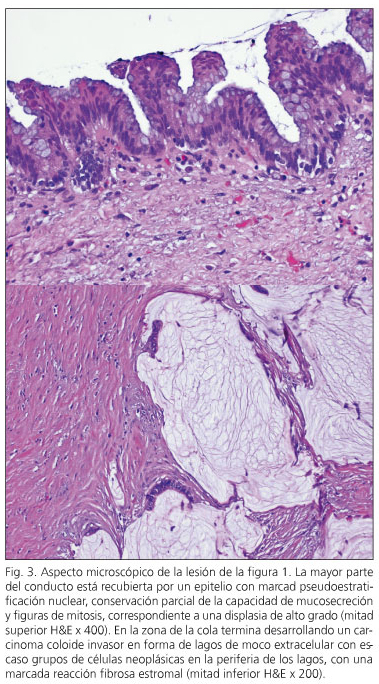
sur trois patients, la néoplasie intraépithéliale pancréatique (« Panin » a été détectée. Dans deux cas, c’était le type PANIN-1A, les lésions plates avec une atypie minimale et une lésion panin-2 avec atypique modérée. Deux patients avaient une NPMI avec dysplasie de haute qualité -carcinome dans Situ- (cas 6 et 10) et trois autres patients (cas 1, 2 et 3) présentaient un carcinome invasif avec des ganglions lymphatiques négatifs (Figure 3). Deux d’entre eux sont exempts de maladie à huit ans et neuf ans de suivi, tandis que l’un est exempt de maladie à trois ans de pancréatectomie et après avoir été réintéroplé d’une récurrence régionale à 15 mois de pancréatectomie.
Un patient (cas 4) est décédé à cinq ans et demi d’une récurrence de ganglions de pancréque de pancréas adénocarcinome. Le reste des patients reste vivant et exempt de maladie. Tous les patients ont été examinés avec une gamme de suivi entre un mois et demi et neuf ans; Obtenir une survie actuarielle de 105 133 mois avec un indice de confiance de 95% (86 264-124,003) et une survie à la récurrence ou à la mort de 98,355 mois (intervalle de confiance: 76 761-119 949). Sur la figure 4, la survie actuarielle est collectée jusqu’à la présence de la récurrence ou de la mort.
Discussion
La première série de NPMI a été décrite par Ohhasi en 1982 (7,20). Par la suite Sessa et al. Ils ont caractérisé la lésion avec le terme actuellement employé (8).
Enfin, l’Organisation mondiale de la santé (OMS) en 1996, à l’occasion d’une classification de l’exocrine du pancréas, définissait le NPMI comme papillaire Prolifération d’un ÉLugGocardeur ÉLUGMECIAIRE ÉPITHELIEN dans le conduit principal ou dans les accessoires de conduits pancréatiques (17). Ladite classification a clarifié une série de termes déroutants qui ont entravé pour connaître leur évolution naturelle et effectuer des évaluations comparatives entre différents auteurs (5,6).
Au cours de la dernière décennie, la prolifération de publications a été référée. À la NPMI et on estime qu’entre 8 et 20% des résections pancréatiques dans des centres de référence sont dues à cette entité (22-24). L’un des aspects les plus uniques constitue leurs formes de présentation – une branche-coffre et une succursale mixte, et celle considérée comme une préjudice préalable, dans laquelle le dysplasie de séquence légèrement in situ, carcinome invasif est bien établi. Dans les morceaux de résection pancréatiques, une néoplasie intraépithéliale pancréatique (PANIN) ont été décrites, divisées à leur tour en différents degrés de téléphone portable (Panin-1, Panin-2, Panin-3). Les lésions PANIN-1, à leur tour, sont subdivisées en type plan (PANIN-1A) et de type papillaire (PANIN-1B).
En raison de controverses différentes, plusieurs réunions de consensus et émises ont eu lieu des guides acteurs sur ceci (14-16). Bien que notre série soit limitée, elle représente la seconde dans la littérature espagnole et exprime toutes les lésions NPMI, de sa forme la plus bénigne au carcinome invasif. Le profil démographique est similaire à celui des autres séries, se présentant à des âges relativement avancés (70 à 80 ans); Ce qui a été capable d’élever une attitude « nihilista » concernant le traitement chirurgical de ces patients.
L’emplacement le plus fréquent dans la tête et le corps du pancréas (9 des 15 cas) et les symptômes de la présentation , coïncide avec ceux décrits dans d’autres œuvres (3 2125). Dans notre série, les quatre cas avec des signes de malignité -Carcinome in situ ou de carcinome envahissant – étaient ceux qui ont affecté le conduit principal ou mixte, un fait qu’il convient avec la majorité des auteurs (24 26-29).
Un patient est mort à 66 mois, d’une récurrence ganglion d’un pancréas adénocarcinome (cas 3) et présenté le type d’affectation mixte, modèle morphologique avec une incidence plus élevée de lésions envahissantes dans la plus grande série (24 , 26-30). La récurrence possible ou la tumeur « de novo » pancréatique est apparue à cinq ans et demi, qui est la durée estimée (5-7 ans) pour compléter l’évolution de l’adénome au carcinome (9,11,12,24,27). Dans une série très similaire à la nôtre, Adsay et al. Ils décrivent deux patients atteints d’une NPMI non invasive décédée à 65 mois de la chirurgie de diffusion locorégionale d’un pancréas adénocarcinome (21). Dans l’un des patients et du carcinome invasif (cas 13), il y avait une récurrence de péritoine à 15 mois de pancrétectomie totale. A déclaré que les malades restent vivants et exempts de maladie à 3 ans après avoir été réintéroplé.
La participation multifocale dans le pancréas a été décrite jusqu’à 30% des patients – avec une variante « conduite accessoire » – et elle a publié 10 % Recurrence chez les patients atteints de NPMI non invasifs, soumis à des pancréectomies partielles et à des marges négatives (31,32). L’adénocarcinome de pancréas synchrone ou métrachronique a été décrit chez 9,2% de 76 patients de NPMI (33). Trois des patients ont présenté une affectation de la marge de résection pancréatique avec une dysplasie légère. Existe acuerdo en que no es necesaria una resección más amplia del páncreas (11,16,15,32,34).
El resto de los pacientes permanecen libres de enfermedad con un rango de seguimiento entre 6 meses y 8 années. Il n’existait aucune mortalité opérationnelle et la morbidité de 40% se trouve dans la gamme mentionnée par des centres accrédités avec une expérience des résections pancréatiques (35,36). L’hospitalisation moyenne était de 10 jours, avec une gamme de 5 et 22 jours. De l’expérience publiée, il est conclu que les NPMI d’affectation des canaux et mixtes doivent être suspendues chirurgicalement avec la confirmation intraopératoire de l’absence d’invasion de la résection pancréatique, estimée à une survie de 80% à cinq ans dans le cas de NPMI envahissantes et 30 % dans les cas avec carcinome invasif. Dans le tableau II, nous présentons l’expérience récente de la grande série (26,31,37-41).
Nous avons déjà commenté que l’incidence du carcinome invasif est plus fréquente dans les lésions du conduit principal de la pancréas (75%), qui, dans les lésions provenant des conduits accessoires (25%) (15,24, 30,42,43). Ces arrière-plans justifient l’étude de Salvia et al. Dans lequel ils ont effectué 89 patients atteints d’un accessoire de branche de type NPMI, asymptomatique, d’une taille inférieure à 3,5 cm et de valeurs normales CA-19.9. Dans ladite étude, seuls cinq patients (6%) ont développé une augmentation de la taille et ont été réséqués sans signes de malignes (44,45). Des résultats similaires ont été publiés par Tanno et al., Au suivi de 81 patients pendant 61 mois (46).
À la suite de cette étude – Qualité des preuves 3- Directives pratiques recommandant le suivi de Ces blessures affectent exclusivement les accessoires asymptomatiques de conduits pancréatiques, de moins de 3 cm de diamètre et qui ne présentent pas de nodules à l’intérieur (15,44,47,48). L’intervalle de suivi – CT et EUS – ne doivent pas dépasser six mois; En raison de l’incidence la plus élevée d’adénocarcinome pancréen méthaconique dans le reste de la glande pancréatique (49,50).
sur la base des expériences précédentes, nous pouvons conclure que le NPMI avec son principal conduit et son type mixte est due à la résecréate avec confirmation histologique de l’absence d’invasion des arêtes de résection. En cas de NPMI non invasive, une survie est estimée à 5 ans de 80% et 30% dans les cas présentant un carcinome invasif. Tabla II résume l’expérience de la série la plus importante.
![]() Gestion de la correspondance:
Gestion de la correspondance:
Javier A. Cienfuegos.
Département de la chirurgie générale.
Clinic University of Navarra.
Avda. Pie XII, 36. 31008 Pampelune, Navarra.
e-mail: [email protected]
reçu: 24-11-09. Accepté: 09-02-10.
bibliographie
1. Garcea G, Ngo SL, Rajesh A, NEAL CP, Pollard CA, Berry DP, et al. Lésions kystiques du pancréas. Un dilemme de diagnostic et de gestion. Pancréatologie 2008; 8: 236-51.
2. Goldsmith JD. Néoplasmes kystiques du pancréas. Am j clin pathol 2003; 119 (1): S3-S16.
3. Basturk ou, Coban I, Adsay NV. Cysts pancréatiques: classification pathologique, diagnostic différentiel et implications cliniques. Arch Pathol Lab Med 2009; 133: 423-38.
4. Adsay nv. Lésions kystiques du pancréas. Pathologie moderne 2007; 20: 571-93.
5. I Seixo Ríos S, Lariño Nonia J, Églises García J, Lozano León A, Domínguez Muñoz Je. Tumeur papillaire mucineuse et intractive: approche diagnostique et thérapeutique. Gastroenterrol Hepatol 2008; 31: 92-7.
6. Fernández-ESPRACH G, Pellisé M, Ginès A.Tumeur Mucinoso Papilar Intraductal Del Pánceas: UNA ENTIDAD MÁS DESCONCIDA QUE INFRACUENTE. Gastroenterol Hepatol 2003; 26: 562-70.
7. Ohhashi K, Murakami Y, Takekoshi T. Quatre cas de cancer du pancréas sécrétant de muqueuses (ABSTR). PROG DIAG DIAG ENDOSS 1982; 20: 348-51.
8. Sessa F, Solcia E, Capella C, Bonato M, Scarpa A, Zamboni G, et al. Les tumeurs papillaires papillaires intra-mucineuses représentent un groupe distinct de néoplasmes pancréatiques: une enquête sur la différenciation des cellules tumorales et les anomalies K-RAS, P53 et C-ERBB-2 chez 26 patients. Virchows Arch 1994; 425: 357-67.
9. Singh m, Maitra A. Les lésions précurseurs de cancer du pancréas: pathologie moléculaire et implications cliniques. Pancréatologie 2007; 7 (1): 9-19.
10. Hruban RH, MAIRA A, KERN SE, Goggins M. Précurseurs du cancer du pancréas. Gastroenterol Clin Nord AM 2007; 36: 831-49.
11. Maitra A, Fukushima N, Takaori K, Hruban Rh. Précurseurs du cancer du pancréas invasif. AVV Anat Pathol 2005; 12: 81-91.
12. Maittra A, Hruban Rh. Cancer du pancréas. Annu Rev Pathol Mech Dis 2008; 3: 157-88.
13. Serikawa M, Sasaki T, Fujimoto Y, Kuwahara K, Chayama K. Gestion de la néoplasme Papillary-Mucineux intraducté du pancréas: stratégie de traitement basée sur la classification morphologique. J Clin Gastroenterol 2006; 40: 856-62.
14. Furukawa T, Klöppel G, Volkan Adsay N, Albores-Saavedra J, Fukushima N, Horii A, et al. Classification des types de néoplasme papillaire papillaire intra-mucineux du pancréas: une étude de consensus. Virchows Arch 2005; 447: 794-9.
15. Tanaka M, Chari S, Adsay V, Fernandez-del Castillo C, Falconi M, Shimizu M, et al.; Association internationale de la pancréatologie. Directives internationales de consensus pour la gestion des néoplasmes mucineux papillaires et des néoplasmes kystiques mucineux du pancréas. Pancréatologie 2006; 6: 17-32.
16. Hruban Rh, Takaori K, Klimstra Ds, Adsay Nv, Albores-Saavedra J, Biankin Av, et al. Un consensus illustré sur la classification de la néoplasie intraépithéliale pancréatique et des néoplasmes mucineux papillaires intraductiques. Am j pathol 2004; 28: 977-87.
17. Kloppel G, Solcia E, Longnecker Ds, Capella C, Sobin Lh. Typage histologique des tumeurs du pancréas exocrinien. Dans: Organisation mondiale de la santé Classification internationale des tumeurs. 2ème éd. Berlin: Springer; 1996. p. 11-20.
18. Edge SB, BYRD Dr, Compton EC, Fritz AG, Greene FL, Trotti A, Editors. Pancréas exocrine et endocrinien. EN: AJCC. Manuel de mise en scène du cancer. 7ème éd. New York: Springer-Verlag; 2010. p. 241-9.
19. BASSI C, DERVENIS C, BUTURRINI G, DINGHTHUT A, YEO C, IZBICKI J, ET AL.; Groupe d’étude international sur la définition de la fistule pancréatique. Fistule pancréatique postopératoire: en tant que groupe d’étude international (ISGPF). Chirurgie 2005: 138: 8-13.
20. Ohhashi K, Takagi K. ERCP et diagnostic de l’imagerie du cancer du pancréas (ABSTR). Endoscopie 1980; 77: 1493-5.
21. Adsay NV, Conlon KC, Zee Sy, Brennan Mf, Klimstra DS. Les néoplasmes papillaires papillaires intra-mucineux du pancréas: une analyse des carcinomes in situ et envahissants chez 28 patients. Cancer 2002; 94: 62-77.
22. Raut CP, Cleary Kr, Staerkel Ga, Abbruzzesse JL, Wolff Ra, Lee JH et al. Néoplas mucineux papillaires intracés du pancréas: effet de l’invasion et du statut de marge pancréatique sur la récurrence et la survie. Ann Surg Oncol 2006; 13: 582-94.
23. Ubiña Aznar E, Rivera Irigoin R, Méndez Sánchez I, Fernández Moreno N, García Fernández G, Sánchez Cantos A. Des signes endoscopiques de tumeur mucineuse du pancréas. REV ESP ENFERM DIG 2007; 7: 413-4.
24. Sohn Ta, Yeo CJ, Cameron JL, Hruban Rh, Fukushima N, Campbell Ka, et al. Neoplasmes mucineux papillaires intracés du pancréas: une expérience mise à jour. Ann Surg 2004; 239: 788-97.
25. Marín Serrano E, Macías Rodríguez Ma, Rendón Uncème P, Pérez Requena J, Guillén Mariscal P, Martín Herrera L. Pancréatique Papillaire Papillary Mucuineuse Tumeur. REV ESP ENERM DIG 2005; 11: 836-7.
26. Schnelldorfer T, Sarr Mg, Nagorney DM, Zhang L, Smyrk TC, Qin R, et al. Expérience avec 208 résections pour le néoplasme mucineux papillaire intraductal du pancréas. Arch Surg 2008; 143: 639-46.
27. Salvia R, Fernández-del Castillo C, Bassi C, Thayer Sp, Falconi M, Mantovani W, et al. Néoplasmes mucineux papillaires Papillaires principaux du pancréas: prédicteurs cliniques de la malignité et de la survie à long terme suivant la résection. Ann Surg 2004; 239: 678-85.
28. Yang Ad, Melstrom LG, Bentrem DJ. Résultats après pancréatectomie pour les néoplasmes mucineux papillaires intraducts du pancréas: une expérience institutionnelle. Chirurgie 2007; 142: 529-34.
29. D’Angelica M, Brennan Mf, Suriawinata AA, Klimstra D, Conlon KC. Neoplasmes mucineux papillaires intracés du pancréas: analyse des caractéristiques clinicopathologiques et des résultats. Ann Surg 2004; 239: 400-8.
30. Rodríguez JR, Salvia R, Crippa S, Warshaw Al, Bassi C, Falconi M, et al.Néoplasmes mucineux papillaires papillaires intra-produits: observations chez 145 patients qui ont subi une résection. Gastroentérologie 2007; 133: 72-9.
31. Blanc r, d’angelica m, katabi n, tang l, klimstra d, fong y, et al. Destin du pancréas restant après la résection du néoplasme mucineux papillaire intraducté non invasif. J amoll Surg 2007; 204: 987-93.
32. Chari St, Yadav D, Smyrk TC, Dimagno EP, Miller LJ, Raimondo M, et al. Étude de la récurrence après la résection chirurgicale de la néoplasme mucineuse papillaire papillaire intraducté du pancréas. Gastro-entérologie. 2002; 23: 1500-7.
33. Yamaguchi K, Ohuchida J, Ohtsuka T, Nakano K, Tanaka M. Tanaka M. Tumeur Papillary-Mucineux du Pancréas Concomitant avec le carcinome canaltré du pancréas. Pancréatologie 2002; 2: 484-90.
34. Anda a, Sarkar F, Adsay Vn. Corrélates clinicopathologiques de néoplasie intraépithéliale pancréatique: une analyse comparative de 82 cas avec et 152 cas sans adénocarcinome canalatique pancréatique. Mod Pathol 2003; 16: 996-1006.
35. Joseph B, Morton JM, Hernandez-Boussard T, Rubinfeld I, Faraj C, Velanovich V. Relation entre le volume hospitalier, les ressources cliniques du système et la mortalité dans la résection pancréatique. J amoll Sur ch 2009; 208: 520-7.
36. Van Heek NT, Kuhlmann Kf, Scholten RJ, de Castro SM, Busch ou, Van Gulik TM, et al. Volume et mortalité hospitalière après résection pancréatique: examen systématique et évaluation de l’intervention aux Pays-Bas. Ann Surg 2005; 242: 781-8.
37. Wada K, Kozarek Ra, Traverso W. Des résultats suivant la résection de néoplasmes mucineux papillaires intraducts intra-invasifs du pancréas. Suis JURG 2005; 189: 632-7.
38. Raut CP, Cleary Kr, Staerkel Ga, Abbruzzesse JL, Wolff Ra, Lee JH et al. Néoplas mucineux papillaires intracés du pancréas: effet de l’invasion et du statut de marge pancréatique sur la récurrence et la survie. Ann Surg Oncol 2006; 13: 582-94.
39. Nakagohri T, Kinoshita T, Konishi M, Takahashi S, Gotohda N. Résultat chirurgical des néoplasmes mucineux papillaires intracés du pancréas. Ann Surg Oncol 2007; 14: 3174-80.
40. Nara S, Shimada K, Kosuge T, Kanai Y, Hiaoka N. Invasive Papillary Carcinome Papillary-Mucineux de la pancréas: étude clinicopathologique de 104 néoplasmes papillaires papillaires intra-mucineux. Am j pathol 2008; 32: 243-55.
41. Nagai K, Doi R, Kida A, Kami K, Kawaguchi Y, Ito T, et al. Néoplas mucineux papillaires intracés du pancréas: caractéristiques clinicopathologiques et suivi à long terme après résection. Monde J Surg 2008; 32: 271-8.
42. Terris B, Ponsot P, Paye F, Hammel P, Sauvanet A, Molas G, et al. Les tumeurs mucineuses papillaires pratiques des pancréas confinées aux conduits secondaires montrent des caractéristiques pathologiques moins agressives par rapport à celles impliquant le conduit pancréatique principal. Am j pathol 2000; 24: 1372-7.
43. Kobari M, Egawa S, Shibuya K, Shimamura H, Sunamura M, Takeda K, et al. Les tumeurs mucineuses papillaires pratiques du pancréas comprennent 2 sous-types cliniques: différences de caractéristiques cliniques et de gestion chirurgicale. Arcade de 1999; 134: 1131-6.
44. Salvia R, Crippa S, Falconi M, Bassi C, Guarise A, Scarpa A, et al. Les néoplasmes mucineux papillaires papillaires intra-conduits du pancréas: pour fonctionner ou ne pas fonctionner? Gut 2007; 56: 1086-90.
45. GLANEH P, JJ de Neoptolemos J. Une nouvelle approche de la gestion des néoplasmes pancréatiques mucineux papillaires intracés. Gut 2007; 56: 1041-4.
46. Tanno S, Nakano Y, Nishikawa T, Nakamura K, Sasajima J, Minoguchi M, et al. Histoire naturelle de la conduite de succursale Papillary-Mucineux-mucineux-mucineux du pancréas sans nodules murales: résultats de suivi à long terme. Gut 2008; 57: 339-43.
47. BASSI C, SARR MG, LILLEMOE KD, REBER HA. Historique naturel des néoplasmes mucineux papillaires intradoliques (IPMN): preuve actuelle et implications pour la gestion. J gastro-intestinest le Surg 2008; 12: 645-50.
48. Woo sm, ryu jk, lee sh, yoon wj, kim yt, yoon yb. Des néoplasmes mucineux papillaires papillaires intra-produits dans une série rétrospective de 190 patients. BR J Surg 2009; 96: 405-11.
49. Tanno S, Nakano Y, Koizumi K, Sugiyama Y, Nakamura K, Sasajima J, et al. Adénocarcinomes canalatiques pancréatiques chez les patients de suivi à long terme avec des néoplasmes mucineux papillaires de conduits de conduits. Pancreas 2010; 39: 36-40.
50. Belysaev o, Seeling MH, Muller Ca, Tannapfel A, Schmidt Nous, UHL W. Les néoplasmes mucineux papillaires intraducts du pancréas. J Clin Gastroenterol 2008; 42: 284-94.