Observation clinique
Patière masculine de 56, sans habitudes toxiques déclarées, avec la seule histoire pathologique de l’hypertension dans le traitement alimentaire et une hyperplasie de la prostate béninale. Il a été renvoyé au service digestif à effectuer par l’étude d’une masse de 5 cm de diamètre maximum entre la face antérieure de l’estomac et le lobe hépatique gauche, d’où il n’avait pas été possible de spécifier son origine et celle qui avait été découvert sous une forme accessoire dans un scanner (Fig. 1) lors de l’étude de la dysfonction de la souris.
image d’une section de scanner Lorsqu’une masse qui semble dépendre du foie et perd des plans avec la courbure mineure de l’estomac.
(0,09 Mo).
Le patient était asymptomatique du point de vue digestif et, dans l’analyse, à la fois l’hémogramme Comme la biochimie étaient strictement normales. Pour approfondir l’étude de la lésion, une échographie du foie a été effectuée qui a été réalisée qui rapportait une masse sous-hépatique adjacente au lobe hépatique à gauche, solide de 58 × 44 × 25mm, qui après l’administration des valeurs de signaux se comportait comme une blessure hypervasculaire dans l’artère. phase et qui indiquait cela dépendent de la paroi gastrique. Une gastroscopie a été réalisée dans laquelle, à la hauteur du corps gastrique, une image indicative de lésion sous-muqueuse ou de compression extrinsèque avec une muqueuse de supracy normale a été observée. Les biopsies n’ont révélé aucune blessure muqueuse. Enfin, une ultrasonographie endoscopique (utilisation) a été réalisée, qui a montré une zone hypoechoique mal délimitée, avec des zones kystiques à l’intérieur et la perte d’avions de séparation avec le parenchyme hépatique dans la relation intime avec la paroi gastrique (Fig. Deux). Fine aiguille-Aspiration-aspiration de la lésion s’est avérée négative pour la malignité sans spécifier le diagnostic.
a) Image de l’ultrasonographie endoscopique où une hypoéchoïque, hétérogène Et la lésion mal délimitée de 4,3 × 1,3 cm est appréciée, avec une zone kystique millimétrique en contact intime avec le parenchyme du foie. Conseil arrow: perte de plan de séparation par rapport au parenchyme hépatique. Flèche: Mur gastrique. Notez que peut être différencié à la couche séreuse du mur. B) Image d’ultrasonographie endoscopique linéaire où l’entrée de la fine aiguille (22g) est appréciée dans la lésion.
Compte tenu de l’absence de diagnostic et de la taille de la lésion (supérieure à 5 cm), de chirurgie complète L’exerèse a finalement été décidée par la laparoscopie. Il y avait une tumeur polyilobulée, située dans le mineur OM, sans adhérences aux organes adjacents. L’analyse de la pièce histologique a révélé des cellules morphologiques fusiformes sans chiffres de mitose. L’analyse immunohistochimique d’Actine, Desmin, S-100 et CD-117 (Kit CD-117 (CD-117) était négative, tandis que les marqueurs CD-34 et Vimintin ont révélé une forte positivité (Figure 3). Le diagnostic final était solitaire tumeur fibreuse péritonéale.
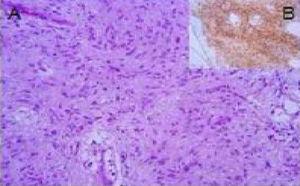
a) Image de l’hématoxyline-EOSIN montrant la prolifération des éléments de cellules fusiformes, sans images mitotiques. B) Image d’immunohistochimie qui exprime la positivité du CD 34.
Discussion
La tumeur fibreuse solitaire est une néoplasme mésenchymatoire initialement décrite sur la surface séreuse du poumon; L’emplacement abdominal est peu fréquent1,2. Dans ce dernier, les cas isolés d’emplacement du foie3, Renal4, rétropéritonéal5 ou pancréatic6 ont été décrits.
cliniquement, dans sa présentation intra-abdominale sont généralement des tumeurs asymptomatiques et la chose habituelle est qu’elles sont diagnostiquées par hasard par des tests d’image demandés par une autre raison ou des symptômes non spécifiques comme plénitude, clinique obstructive ou même hypoglycémie7.
Comme dans la plupart des tumeurs extensibles mésenchymateuses, les tests d’image ne sont pas diagnostiques, bien qu’ils soient utiles pour exclure l’invasion et établir leur relation avec les structures voisines. Dans notre cas, ni après une anamnèse correcte et une série complète de tests de diagnostic pourraient être établies l’origine exacte de la blessure.
Selon les résultats ultrasonographiques et tomographiques, le diagnostic différentiel a été soulevé avec les entités définies Dans le tableau 1. Une fois que l’origine hépatique de la lésion est exclue, l’utilisation est la technique de choix du diagnostic différentiel des lésions qui provoquent une compression extrinsèque gastrique et des tumeurs subpithéliales, fondamentalement de Mesenquimal Origin8. Dans les tumeurs mésenchymateuses de la cavité abdominale, les plus fréquentes sont les tumeurs du stroma gastro-intestinal (gist). De manière caractéristique, bien qu’elles puissent être situées dans n’importe quelle couche de la paroi gastrique, elles sont plus fréquentes dans la couche musculaire de la mucosa (deuxième couche par utilisation) ou dans la couche musculaire de son propre (quatrième couche). Dans notre cas, l’absence de croissance a été observée à partir de ces couches et pourrait être confirmée qu’il s’agissait d’une compression extrinsèque, mais pas d’origine épiploïque. Cependant, il est pratique de commenter que, bien que la plupart des gis sont situés sur la paroi du tractus gastro-intestinal, jusqu’à 5% peuvent être situés dans la mésentère, omento ou le rétropéritoine, donc uniquement par l’emplacement de la blessure qu’un GIST9 ne peut pas être jeté complètement. Une seule étude a été publiée avec les caractéristiques échoendoscopiques de cette tumeur dans l’abdomen, notamment dans le pancréas, et l’a décrit comme une blessure bien définie et hyperecoica7. Dans notre cas, cette blessure était hypoéchoïque et mal délimitée, nous ne pouvons donc pas établir de caractéristique de modèle ultrasononographique par cette technique d’image.
Diagnostic différentiel de masse dans l’hémiabomen supérieure
gist: tumeur stromale gastro-intestinale; HNF: Hyperplasie nodulaire focale; LNH: lymphome non-hodgkin.
Le diagnostic final de ce type de lésions non spécifiques par imagerie tests10 est soutenu par l’analyse anatomopathologique et immunohistochimique de la partie chirurgicale11. Bien que le diagnostic préopératoire d’aspiration d’aspiration nécessaire à une aspiration fine soit difficile en raison de la cellularité rare de ces tumeurs12, le diagnostic cytologique et l’immunohistochimical13 sont parfois atteints. On ignore si l’aiguille de type trucut augmenterait la rentabilité de diagnostic de l’utilisation. La présence de cellules morphologiques fusiformes dans un trait riche en collagène est typique de ces tumeurs. Cependant, ces résultats ne sont pas spécifiques et communs à d’autres tumeurs mésenchymateuses, il est donc nécessaire de procéder à une large série de tests immunohistochimiques14 comme dans le cas présenté pour jeter les gis, les léomyomas ou les swanomes, entre autres.Le diagnostic différentiel avec ces lésions est d’une grande pertinence, car les obstacles sont considérés comme des sarcomes de faible qualité avec un risque potentiel de diffusion locale et de diffusion hématogène. Dans notre cas, les marqueurs CD-117, S-100 ainsi que Actine et Demina se sont révélés négatifs. D’autre part, l’expression des anticorps CD-34 et contre Vimiment est typique de ces tumeurs16. Bien que la plupart des cas aient un comportement bénigne, certains ont une phrase cellulaire et une activité mitotique élevée2,17 ainsi que du potentiel métastatique1818, de sorte que le diagnostic est dans la majorité difficile sans histologie, le traitement recommandé est le chirurgical avec des marges de résection larges à Éviter la récurrence.
En résumé, la tumeur fibreuse solitaire intra-abdominale est une néoplasme, même aujourd’hui et avec tout le diagnostic arsenal que nous avons, de diagnostic préopératoire difficile en raison de sa faible prévalence, de la non-spécificité des tests d’image et étude cytologique engagée. Cependant, son emplacement intrabdoyal, parfois capricieux, dans le foie et la chambre gastrique, nécessite dans de nombreuses possibilités d’élever le diagnostic différentiel avec d’autres entités qui, au contraire, ne sont pas toujours de type bénin.
Conflit d’intérêts
Les auteurs déclarent ne pas avoir de conflit d’intérêts.