Originali
Studio delle reazioni avverse relative a Paclitaxel Infusion e Docetaxel
Studio sul Pubblica reazioni relative a Paclitaxel e Docetaxel Infusion
i. J. Castro1, M. Pons Busom1, GI Ballesteros Cabañas1, E. Ramió Montero1, A. Álvarez Méndez2, R. de Castro Chivato3, M. Centels Ruiz4
1service of Pharmacy, Capio Hospital Universitari Sagrat Cor, Barcellona, Spagna.
2nfermera Pharmacy Service, Capio Hospital Universitari Sagrat Cor, Barcellona, Spagna.
3Enfermera Day Hospital, Capio Hospital Universitari Sagrat Cor, Barcellona, Spagna.
4sungologia, ospedale del Capio Universitari Sagrat Cor, Barcellona, Spagna.
Questo lavoro è stato parzialmente presentato come una comunicazione poster nel 56 ° Congresso nazionale della società di farmacia spagnola che si è tenuta a Santiago di Compostela Dal 18 al 21 ottobre 2011.
Gestione per corrispondenza
Riepilogo
Obiettivo: determinare l’incidenza delle reazioni all’infusione di Paclitaxel e Docetaxel, e le possibili cause che possono attivarle.
Metodo: Cohort Studio di PACLITAXEL INFusioni e Docetaxel eseguiti in un ospedale di terzo livello, da luglio 2010 a dicembre 2011 (18 mesi). Per ogni infusione, sono stati registrati i dati clinici del paziente e coloro che si riferiscono al taxano gestito. Dato l’aspetto di una reazione durante l’infusione, è stato specificato: tipo, gravità e se ha costretto la sospensione del trattamento. Sono state consultate storie cliniche e ordini medici. Il follow-up delle infusioni è stato condotto contattando le infermiere dell’ospedale del giorno. Uno studio descrittivo delle variabili più rilevanti incluso nel follow-up è stato effettuato e analizzato se qualcuno di loro potrebbe influenzare l’aspetto delle reazioni.
Risultati: Durante il periodo di studio, 357 infusioni di Paclitaxel e Docetaxel sono state somministrate a 92 pazienti: età media 61,4 anni (da 11,1), 50,0% donne. 9 reazioni infusionali sono state rilevate che hanno interessato 8 pazienti, tutti causati da Docetaxel (χ2 = 8.3, P = 0,004); 14,5% dei pazienti che lo prese e sempre durante il primo o il secondo ciclo di trattamento. Le variabili significativamente associate all’aspetto delle reazioni erano: Neoplasma polmonare (P < 0.005), schema Docetaxel-cisplatin (P < 0.005) , Ricevi il farmaco sulla prima riga (p = 0,021) e la malattia inconsapevole (p = 0,014).
conclusioni: Nel nostro centro ospedaliero, Docetaxel è il taxano che ha causato più problemi di sicurezza durante la tua infusione.
Parole chiave: Paclitaxel; Docetaxel; Reazione di ipersensibilità.
Astratto
Obiettivo: determinare l’incidenza dei reati associati a infusione di paclitaxel e docetaxel e le probabili cause che potrebbero innescarle.
Metodo: Cohort Studio dei PACLITAXEL e Docetaxel Infusioni effettuate in un ospedale terziario da luglio 2010 a dicembre 2011 (18 mesi). Per ogni infusione, i dati clinici e i dati relativi al farmaco sono stati registrati. Quando si è verificata una reazione durante l’infusione, i seguenti dati sono stati specificati: tipo, gravità, se il ritiro del trattamento era necessario. I grafici clinici e gli ordini di trattamento sono stati esaminati. Il follow-up delle infusioni è stato fatto contattando le infermiere ospedaliere diurna. Uno studio descrittivo è stato fatto per le variabili più rilevanti incluse nel follow-up e abbiamo analizzato se qualcuno di essi avrebbe potuto avere un’influenza sul verificarsi delle reazioni.
Risultati: Durante il periodo di studio, 357 PACLITAXEL e Docetaxel infusioni sono stati somministrati a 92 paganti: età media 61,4 anni (SD 11.1), il 50,0% era femmina. 9 Reagisce per infusione che riguardano 8 paganti si sono verificati, tutti causati da Docetaxel (χ2 = 8.3, P = 0,004); 14,5% dei pazienti che lo rendono e sempre durante il primo o il secondo ciclo di trattamento. Le variabili significativamente associate all’occorrenza della reazione: cancro del polmone (P < 0.005), regime Docetaxel-cisplatin (P < 0.005) , Ricevendo il farmaco come prima linea (p = 0,021) e malattia non avanzata (p = 0,014).
concerti: Nel nostro ospedale, Docetaxel è il taxano che ha provocato i problemi di sicurezza più frequenti durante l’infusione.
Parole chiave: Paclitaxel; Docetaxel; Reazione di ipersensibilità.
Introduzione
Durante alcuni decenni fa, i taxan Paclitaxel e Docetaxel hanno dimostrato di essere efficaci in una varietà di tumori. Pacliblitaxel è approvato per il trattamento del seno, del polmone (cellule non piccole) e dei neoplasmi dell’ovaia; e docetaxel per seno, polmone (cellule non piccole), testa e collo, adenocarcinoma gastrico e prostata1,2.L’azione citotossica del taxana è sostenuta nella stabilizzazione della tubulina e della successiva formazione di microtubuli non funzionali che innescano una mitosi errata, in modo che le cellule tumorali smettino di dividere e terminate da Dying1-3. Negli studi preclinici, Docetaxel ha dimostrato di essere più efficace di Paclitaxel poiché si unisce a Tubulin con una maggiore affinità, presenta un’azione diretta antitumorale mediante attivazione di percorsi apoptotici e maggiore ritenzione nelle cellule tumorali4.
Uno degli svantaggi presentati Con queste sostanze è la loro scarsa solubilizzazione, quindi richiedono l’uso di veicoli tensioattivi non ionici per la loro formulazione. Il cremoforo, derivato polioxyetilato di olio di ricino, è il solubilizzante utilizzato per Paclitaxel e Polysorbate 80 (Tween 80), un altro derivato polioxyetilato, è per Docetaxel. Questi due veicoli aumentano le interazioni farmacologiche con altri antineoplastici (ad es. Antracicline) e possono modificare la farmacocinetica dei farmaci con cui sono formulati, predisposti a una tossicità maggiore, specialmente nel caso di Paclitaxel con la sua farmacocinetica non lineare4-6. Per ridurre al minimo le reazioni avverse, evitare la premedition e diminuire i tempi di amministrazione Paclitaxel e Docetaxel, sono state sviluppate le nuove strategie di formulazione come albumino nanoparticelle, polglutamati, prodrug, emulsioni o liposomi55. Ad oggi, solo la nuova formulazione Paclitaxel basata su nanoparticelle di albumino (Abraxane®) è stata commercializzata in Spagna.
Il profilo di sicurezza di questi agenti antiutumori è divergente; Mentre Paclitaxel è più associato a neuropatie periferiche, myalgias e artralgia, Docetaxel è alla ritenzione di liquidi (aumento di peso, infiammazione delle caviglie o zona addominale) 5.7. Approssimativamente con la stessa frequenza, i due farmaci possono causare reazioni all’infusione (disspnea, dolore toracico, angioedema, ipotensione, orticaria e eruzione cutanea) che dipendono dalle caratteristiche del taxano, del solvente o di entrambi, sia il cui aspetto è dovuto , tra le altre cause, alla rapida infusione di questi preparativi8,9. Queste reazioni, spesso chiamate anche reazioni di ipersensibilità, di solito si verificano durante i primi minuti di infusione e generalmente nella prima o seconda dose, essendo in grado di apparire anche con adeguata premedicazione basata su corticosteroidi e antistaminici8.10.
Tutto Ciò ha motivato il nostro interesse a determinare l’incidenza delle reazioni avverse relative all’infusione dei taxani Paclitaxel e Docetaxel nel nostro centro e le possibili cause che possono attivarle.
Metodo
Studio osservativo, longitudinale e prospettico di tutti gli infusioni di Paclitaxel o Docetaxel da luglio 2010 a dicembre 2011, in un ospedale universitario di livello 3 senza trapianti.
I pazienti trattati con Paclitaxel hanno ricevuto premedicazione orale con Desametasone 8 mg il giorno precedente alla chemioterapia, e nello stesso giorno per via endovenosa: Ondansesterrtron 8 mg, Desameton 8-12 mg, Deschlorofeniramina 5 mg e ranitidina 50 mg, 30 minuti OS prima della tua amministrazione. La premedicazione utilizzata per Docetaxel consisteva in DEXAMETHASONE ORALI 8MG due volte al giorno per tre giorni, a partire da un giorno prima della chemioterapia, e anche lo stesso giorno per via endovenosa: Ondansesterrtron 8 mg e Desametasone 8-12 mg, 30 minuti prima della tua amministrazione.
I marchi utilizzati erano Paclitaxel Hospira® nel caso di Paclitaxel e TaxoTere® e Docetaxel Hospira® per Docetaxel. Docetaxel è stato somministrato in siero fisiologico di 250 ml per 60 minuti e Paclitaxel in siero fisiologico di 500 ml in 180 minuti di infusione. In polyquimioterapia, i taxani sono stati sempre somministrati prima, quindi le reazioni che potrebbero apparire durante i primi minuti di infusione potrebbero essere attribuite solo a loro.
Un follow-up giornaliero è stato effettuato da tutte le amministrazioni dei taxi e Sono state registrate le seguenti variabili:
• Dati del paziente: età, sesso, numero di storia clinica e oncologo responsabile.
• Clinico Dati: Neoplasia, stadio, storia patologica, allergie, farmaci abituali e precedenti trattamenti chemioterapici nel caso in cui ci fossero.
• Dati relativi al trattamento oncologico: taxan tipo (incluso nome commerciale), dose, frequenza, ciclo, concomitante Chemioterapia e premedicazione.
• Aspetto di qualsiasi reazione avversa del farmaco (RAM) durante l’infusione taxana, specificando il tipo e la gravità secondo la classificazione NCI-CTCAe V.3.0 2006 del cancro nazionale insiblitario11 .
Per registrare i dati relativi al paziente, i record medici sono stati consultati.I dati che si riferiscono al trattamento oncologico sono stati ottenuti dalla prescrizione tramite il ciclo del paziente e del trattamento. Il follow-up di ciascuna infusione è stata effettuata dal farmacista responsabile per l’area di citostatica e il farmacista residente contattando l’infermiere dell’ospedale del giorno incaricato di somministrare il taxano. Il rapporto di causalità delle reazioni è stato determinato dall’algoritmo Karch-Lasagna modificato12.
L’analisi statistica delle variabili qualitative e quantitative è stata effettuata con il programma SPSS V.15.0. È stato valutato se la variabile dicotomica della RAM principale no, è stata significativamente associata a ciascuna delle variabili indipendenti. Il test chi-quadrato è stato utilizzato per le variabili categoriali e lo studente T per il confronto dei mezzi in campioni indipendenti, prendendo P < 0,05 come rapporto statisticamente significativo.
Lo studio è stato approvato dal comitato etico della ricerca clinica ospedaliera e richiedeva per la sua attuazione l’azienda di consenso informato da pazienti che ha soddisfatto i criteri di inclusione.
Risultati
Durante i 18 mesi di studio , 4.689 droghe oncologici erano infuse, di cui il 7,6% corrispondeva ai taxani inclusi nel follow-up. In totale 357 infusioni di Paclitaxel e Docetaxel somministrati a 92 pazienti (50,0% donne), di età compresa tra 36 e 79 e un’età media di 61,4 anni (da 11,1). Docetaxel era il taxano più comunemente usato in numero di pazienti (n = 55, 57,3%) e infusioni (n = 188, 52,7%). Non sono state trovate differenze significative nelle variabili basali di entrambe le coorti, ad eccezione della distribuzione di neoplasie (tabella 1): l’indicazione più comune per Docetaxel era il cancro al seno (47,3%), mentre per Paclitaxel era il polmone (53,7%). Più della metà dei pazienti ha ricevuto il trattamento sulla prima riga (62,5%).
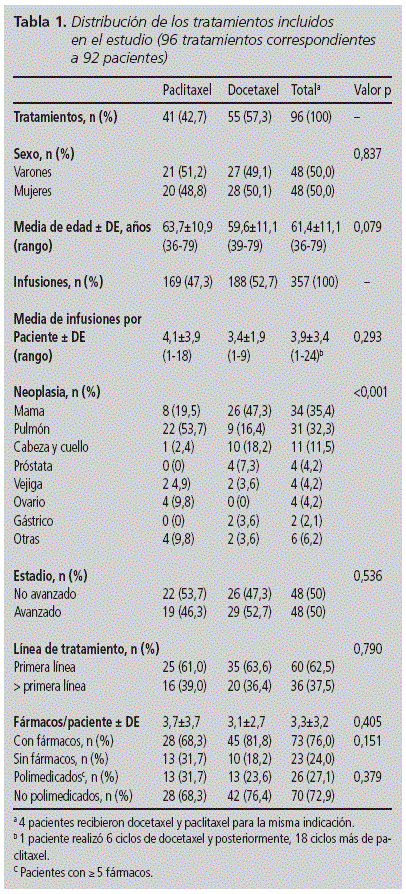
Un totale è stato utilizzato da 36 Protocolli chemioterapici, essendo lo schema più utilizzato sia per Docetaxel che per Paclitaxel la combinazione con carboplatina (testa e collo e cancro del polmone rispettivamente) (Tabella 2).
9 Reazioni infusionali corrispondenti a 8 pazienti (8,7% di Il totale), tutto causato da Docetaxel (χ2 = 8.3, P = 0,004) e sempre durante il primo o il secondo ciclo di trattamento. Pertanto, il 4,8% delle infusioni di Docetaxel ha causato una reazione, il 66,7% (n = 6) è apparso nel secondo ciclo di trattamento e ha finito per il 14,5% dei pazienti che avevano ricevuto questa chemioterapia. Se sono selezionate solo le infusioni di Docetaxel somministrate durante il primo o il secondo ciclo, l’incidenza delle reazioni aumenta fino al 10,5% delle amministrazioni. In tutti i casi, le reazioni sono apparse in pazienti con un’età inferiore a 65 anni (56,3 anni di 4.1), non polmeedicate, senza conosciute allergie precedenti e sulla prima riga di trattamento.
Il 66,7% ( n = 6) delle reazioni sono state considerate moderate secondo NCI-CTCAE V.3.011. In uno dei casi, la reazione è stata considerata molto seria poiché erano necessarie misure di sostegno vitali. Questo è stato l’unico caso in cui la reazione ha motivato la sospensione del trattamento. In 6 pazienti, il ritiro di Docetaxel è stato tollerato senza problemi e in due pazienti è stato somministrato Paclitaxel successivamente senza incidente (Tabella 3). Secondo l’algoritmo di Karl-Lasagna modificato12 tutte le reazioni sono state classificate come probabili.
Nel gruppo di maschi 5 reazioni apparvero come un comune denominatore tumore polmonare e schema docetaxel 75 mg / m2 + cisplatin 75mg / m2 C / 21 GIORNI. Questo schema è stato somministrato a un totale di 6 pazienti, quindi l’83,3% di coloro che hanno ricevuto questo protocollo hanno presentato una reazione all’infusione. Nelle 3 reazioni che sono apparse nelle donne, l’unico neoplasma coinvolto era il seno, ei protocolli chemioterapici erano 2 volte la combinazione con Trastuzumab e in uno con la carboplatina.
In questo studio le variabili che sono correlate Statisticamente con l’aspetto delle reazioni a Docetaxel Infusion erano: Neoplasma polmonare (P < 0.005), schema Docetaxel-cisplatin (P < 0.005) , Ricevi il farmaco sulla prima riga (p = 0,021) e in malattia non avanzata (p = 0,014). Tuttavia, tale correlazione non è stata osservata con sesso, età e variabili di farmaci abituali.
Discussione
L’efficacia dei taxani può essere compromessa dall’apparenza delle reazioni di ipersensibilità durante la sua infusione. A volte questi possono costringere a sospendere il trattamento con ricorrere ad altri schemi che potrebbero essere meno efficaci.
Nella letteratura scientifica è descritto che Docetaxel e Paclitaxel causano reazioni di ipersensibilità con una frequenza vicina al 30%, ma diminuisce fino al 2-5% se il pretrattamento viene eseguito con corticosteroidi e antistaminici, e se lo è ridotto la velocità di perfusione1,2,8,13,14. Nel nostro studio, Paclitaxel non ha causato alcuna reazione con la premedicazione utilizzata e infondendola per 3 ore2. Tuttavia, 9 episodi sono apparsi con Docetaxel (14,5% dei pazienti) che lo somministrano per un’ora ed esperti in ospedale del giorno la premedicazione raccomandata sulla cassaforte tecnica1. La maggior parte delle reazioni (6) è stata risolta rinforzando la premedicazione e riducendo la velocità di amministrazione di 250 ml / h a 125 ml / h e successivamente aumentando la velocità progressivamente. Alcuni autori, a parte la riduzione della velocità di amministrazione raccomandano anche altre opzioni come la riduzione della concentrazione di farmaco da somministrare o considerare l’applicazione dei protocolli di desensibilizzazione aumentando le dosi15 perfusioni. Ci sono studi che sostengono anche di cambiare un taxano da un altro quando una reazione di ipersensibilità appare a uno di questi19-21. Certamente, cambiando l’un l’altro può favorire la continuazione del trattamento, tuttavia vi sono polemiche in tal senso da altri autori come Dizon et al.14 ritengono che ciò non sia possibile a causa dell’esistenza di una reattività incrociata tra i taxi. Nel nostro follow-up non c’era alcuna reattività incrociata, dal momento che due pazienti che hanno presentato una reazione infusionale a Docetaxel hanno ricevuto Paclitaxel senza incidente. In 6 pazienti il ritiro Docetaxel è stato ben tollerato, tuttavia, c’era un paziente che dopo aver presentato una moderata reazione al docetaxel, ri-ricevere questa taxana e ha nuovamente presentato una reazione, questa volta considerata grave e che ha causato la sospensione definitiva del trattamento. In ogni caso, ciò che è chiaro è che la somministrazione di qualsiasi taxana è controindicata se la reazione di ipersensibilità causata da nessuno di esse è grave (grado 3-4) 1.2.
sintomi correlati con queste reazioni, di solito Appai nella prima o nella seconda infusione della chemioterapia e, in generale, in alcuni minuti dall’inizio, come è successo nei 9 pazienti affetti nel nostro follow-up. Pertanto, è necessario prestare particolare attenzione nelle prime amministrazioni taxane, organizzando in ogni momento di personale esperto e il sostegno di un team di rianimazione nel caso in cui vi fosse una reazione che minaccia la vita del paziente22. Altre cure che potrebbero essere eseguite sono il monitoraggio della pressione sanguigna e dell’osservazione del paziente fino a 2 ore dopo la somministrazione taxana.
Nel nostro studio, la sintomatologia del paziente che aveva una reazione infusionale a Docetaxel è stata caratterizzata da cianosi , Perdita di coscienza, crisi, insufficienza respiratoria e ipotensione. L’immagine è stata invertita rapidamente dopo aver fermato l’infusione e con l’aiuto di corticosteroidi, ossigenoterapia e fluidoterapia; Questa reazione è stata notificata al centro di farmacovigilanza regionale. Negli altri minimi casi, le reazioni consistevano in eritema cutaneo, arrossire facciale, dolore lombare, tachicardia e in alcuni casi brividi, ipotensione e vertigini. In nessuno di loro c’erano disspnea o broncospasmo.
Due dei pazienti che hanno presentato una reazione di docetaxel ipersensibilità riconosciuta non avendo correttamente preso il desametasone programmato il giorno prima della chemioterapia (pazienti 1 e 2, Tabella 3). Non vi è alcun dubbio, che per ridurre il rischio di verificarsi di questi eventi è quello di aumentare i pazienti da un’adeguata presa di premedicazione che viene pagata. Amministrazione di una premedizione basata su antistaminici e corticosteroidi prima della taxana è di scelta poiché ha dimostrato di ridurre l’incidenza e la gravità della ritenzione del fluido, nonché la gravità delle reazioni di ipersensibilità1,2,7. Inoltre, evita le interruzioni nel trattamento e consente di aumentare le dosi cumulative dei taxanes8.
Non è noto se queste reazioni dipendono dal solvente o dal taxi o da entrambi i componenti. Né è il meccanismo per il quale appaiono per entrambi. Si pensa che possano essere mediati dall’attivazione del complemento, rilascio non specifico di istamina, produzione di ossido nitrico o dal rilascio di citochine. Contrariamente a ciò che accade con i derivati del platino, in linea di principio non si riferisce il suo aspetto con un meccanismo mediato da IGE, poiché le reazioni solitamente appaiono in pochi minuti dall’invio dell’infusione durante il primo o il secondo ciclo di trattamento, ciò che suggerisce che non ci siano bisogno per pre-sensibilizzazione23-25.Un altro aspetto da tenere in considerazione, e che con la bibliografia consultava non è stato chiarito con accuratezza8,26, è quello di determinare se ci sono aspetti clinici o soggettivi che potrebbero predisporre il paziente a una reazione di ipersensibilità acuta o qualsiasi altra ram.
Nel nostro studio, i fattori che erano strettamente correlati alla comparsa di reazioni infusionali erano: neoplasia polmonare, schema docetaxelcisplatin, riceve il farmaco sulla prima linea e la malattia inconsapevole. Di questi fattori, in letteratura consultati solo per ricevere Docetaxel nella prima o seconda linea è stato considerato una variabile decisiva nell’aspetto di queste reazioni.
D’altra parte, è possibile che il concomitante L’uso di paclitaxel o docetaxel con altri antinetoplastici come Trastuzumab, carboplatino o cisplatin, può migliorare l’aspetto delle reazioni di ipersensibilità, poiché loro stesse possono anche originarli. Trastuzumab, come i taxani, di solito causano queste reazioni nel primo o nel secondo ciclo, ma queste non vengono presentate in pochi secondi dall’inizio dell’infusione27. Al contrario, le reazioni dei derivati del platino si verificano principalmente dal sesto ciclo, durante o successivamente alla loro infusione25,28. Nel nostro studio, tutte le reazioni sono apparse in pazienti in trattamento poliquimiotico con questi farmaci: 6 in combinazione con cisplatin, 2 con carboplatina e 1 con Trastuzumab. Tuttavia, solo la relazione può essere trovata in coloro che si sono verificati durante il secondo ciclo, che è in cui la combinazione di farmaci è stata precedentemente ricevuta (in 6 delle 9 reazioni nel nostro studio). Pertanto, in uso combinato sarebbe consigliabile utilizzare una premedition completa, monitorare attentamente i pazienti e sapere come differenziare le reazioni di ipersensibilità prodotte da ciascun farmaco, per determinare l’agente causale.
Riferimento a possibili pregiudizi o limitazioni di possibili pregiudizi o limitazioni Lo studio, probabilmente l’incidenza delle reazioni avrebbe potuto essere maggiore perché la sua valutazione costituisce una variabile soggettiva o morbida che dipende dalla percezione dell’osservatore. Pertanto, questa circostanza potrebbe aver causato una minoranza di reazioni lieve perché potrebbero essere andate inosservate. Un altro pregiudizio da evidenziare, è stato l’uso di due diversi marchi commerciali di Docetaxel in diverse fasi dello studio (TaxoTere® e Docetaxel Hospira®), nonché un cambio di formulazione nel caso di TaxoTere®. Questa stessa preparazione commerciale era quella che ha presentato tutte le reazioni infusionali (due di loro con l’antica formulazione), sebbene sia vero che era il più utilizzato (il 91,5% delle infusioni). Gli eccipienti di entrambi i marchi sono: etanolo, polisorbazione 80 e acido citrico, e nel caso di taxotre® inoltre macrogol 300. La composizione quantitativa degli eccipienti non può essere ottenuta dai fogli tecnici, quindi non sappiamo se il marchio oi suoi eccipienti potrebbero influenzare l’aspetto delle reazioni. Un’importante limitazione dello studio, e che deve essere presa in considerazione per il lavoro successivo, i test non prolungati sono stati i test non provocatibili responsabili del servizio di allergia per poter distinguere se le apparenze apparivano sono state causate dal principio attivo o dal principio attivo.
Infine, con i risultati ottenuti in questo studio, le misure adottate nel nostro centro sono state per rafforzare la premediazione del docetaxel e fare una lenta somministrazione di farmaci (2-3 ore) nel primo e Secondo ciclo di trattamento. Con Paclitaxel è stato deciso di continuare con la stessa metodologia di lavoro, come indicato sulla scheda tecnica.
Conclusioni
Docetaxel è il taxano che è stato correlato a un numero maggiore nel nostro ambiente di reazioni avverse durante la tua infusione, superiore ai dati descritti nella letteratura.
Una premedizione adatta in entrambi i giorni e la casa del paziente, è cruciale per ridurre l’incidenza di questi.
È essenziale fare più studi per essere in grado di sapere esattamente l’eziologia di queste reazioni e quindi essere in grado di applicare misure efficaci che evitano il loro aspetto.
Conflitto di interessi
Gli autori Dichiarare di non avere alcun conflitto di interessi.
Bibliografia
1. Scheda tecnica Docetaxel (TaxoTere®) (Accesso giugno 2010). Disponibile su: www.agemed.es
2. Scheda tecnica Paclitaxel (Taxol®) (Accesso giugno 2010). Disponibile su: www.agemed.es
3. Bagnall A-M, Forbes c, Lewis R, Golder S, Kleijnen J. Un aggiornamento di una revisione rapida e sistematica dell’efficacia e dell’efficacia dei costi dei taxani utilizzati nel trattamento del cancro al seno avanzato. L’Istituto nazionale per l’eccellenza clinica (Centro NHS per le recensioni e la diffusione). Università di York, aprile 2001 (Accesso giugno 2010). Disponibile su: www.nice.org.UK / NICEMEDIA / LIVE / 11435/32235 / 32235.pdf
4. GLIGOROV J, LOTZ J-P. Farmacologia preclinica dei taxani: implicazioni delle differenze. L’oncologo. 2004; 9 (SUPL 2): 3-8.
5. Hennenfent K L, Govindan R. Novel Formulations of Taxanes: una recensione. Vecchio vino in una nuova bottiglia? Annali di oncologia. 2006; 17: 735-49.
6. Dieci Tije AJ, Verweij J, Loos WJ, Sparreboom A. Effetti farmacologici dei veicoli di formulazione: implicazioni per la chemioterapia del cancro. Clin Pharmacokinet. 2003; 42 (7): 665-85.
7. Markman M. Gestione di tossicità tassana. Supporto carcinoma di cura. 2003; 11 (3): 144-47.
8. Aggiornato. Base de Datos. Reazioni per infusione alla chemioterapia sistemica; Octubre 2009 (ACCESO MARZO 2010). Disponibile IT: http://www.uptodate.com/contents/infusion-reactions-to-systemicchemotherapy
9. MICHAUD LB. Metodi per prevenire le reazioni secondarie al cremofolo el. Ann Pharmacother 1997; 31: 1402-4.
10. Weiss RB, Donehower RC, Winik Ph, et al. Reazioni di ipersensibilità da taxol. J Clin Oncol. 1990; 8: 1263-8.
11. Istituto nazionale del cancro Criteri di tossicità comuni per eventi avversi (CTCAE) V3.0; AGOSTO 2006. (ACCESO MARZO 2010). Disponibile IT: http://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcaev3.pdf
12. NARANJO CA, BUSTO U, VENDITORI EM, SANDOR P, Ruiz I, Roberts EA, et al. Un metodo per stimare la probabilità di reazioni avverse al farmaco. Clin Pharmacol ther. 1981; 30: 239-45.
13. Serie di assistenza sanitaria MICROMEDEX. Database di farmaci. Thomson Series (ACCESO MARZO 2010). Disponibile IT: www.thomsonhc.com
14. Dizon DS, Schwartz J, Rojan A, Miller J, Pires L, Disilvestro P, et al. Sensibilità incrociata tra Paclitaxel e Docetaxel in un programma di cancro femminile. Gynecol Oncol. 2006; 100 (1): 149-51.
15. Markman M, Kennedy A, Webster K, et al. Reazioni di ipersensibilità associate a Paclitaxel: esperienza del programma di oncologia ginecologica del Cleveland Clinic Cancer Center. J Clin Oncol. 2000; 18 (1): 102-5.
16. Castells MC, Tennant Nm, Sloane de, Ida Hsu F, Barrett na, Hong di, et al. Reazioni di ipersensibilità alla chemioterapia: esiti e sicurezza della desensibilizzazione rapida in 413 casi. J Allergy Clin Immunol. 2008; 122: 574-80.
17. Feldweg Am, Lee CW, Matulonis UA, Castells M. Desensibilizzazione rapida per reazioni di ipersensibilità a Paclitaxel e Docetaxel: un nuovo protocollo standard utilizzato in 77 trattamenti di successo. Gynecol Oncol. 2005; 96: 824-49.
18. Syrigou E, Dannos I, Kotteas E, Makrilia N, Tourkantonis I, Dilana K, et al. Reazioni di ipersensibilità a Docetaxel: valutazione retrospettiva e sviluppo di un protocollo di desensibilizzazione. Int Arch Allergy Immunol. 2011; 156 (3): 320-4.
19. J Lokich J, Anderson N. Paclitaxel Ipersensitivity Reactions: un ruolo per la sostituzione del docetaxel. Il centro di cancro di Boston. Annali di oncologia. 1998; 9: 573-4.
20. Luna C, Verschraegen CF, Bevers M, Freedman R, Kudelka AP, Kavanagh JJ. Uso di Docetaxel (taxotere) in pazienti con ipersensibilità di Paclitaxel (Taxol). Droghe antitumorali. 2000; 11 (7): 565-8.
21. Bernstein BJ. Docetaxel come alternativa a Paclitaxel dopo le reazioni di ipersensibilità acute. Ann Pharmacother. 2000; 34 (11): 1332-25.
22. Baker J, et al. Effetti collaterali legati al docetaxel e la loro gestione. Journal europeo di infermieristica oncologica. 2009; 13: 49-59.
23. Lee c, Gianos M, Klaustermeyer WB. Diagnosi e gestione di reazioni di ipersensibilità relative a agenti di chemioterapia del cancro comuni. Ann Allergia Asma Immunol. 2009; 102 (3): 179-87.
24. Ardavanis A, Tryfonopoulos D, Yiotis I, Gerasimidis G, Baziotis N, Rigatos G. Natura non allergica delle reazioni acute dell’iperensibilità acuta indotta da Docetaxel. Droghe antitumorali. 2004; 15 (6): 581-5.
25. Sánchez-Muñoz A, Mediola Fernández c, Poza Gudes P, Canto Diez G, Bezares Montes S, Cortés Funes H. H. Hipersensibilidad A Carboplatino y Paclitaxel: Revissión y Recomendaciones Clínicas. Rev oncol. 2002; 4 (2): 68-71.
26. Cortijo-Cascajares S, Jiménez-Cerezo MJ, Herreros de Tejada A. Revissión de las Reacciones de Hipersensibilidad a Antineoplásicos. Azienda agricola. 2012; 36: 148-58.
27. Chung ch. Gestione delle premedicazioni e il rischio di reazioni alla terapia anticorpale monoclonale infusionale. Oncologo. 2008; 13: 725-32.
28. Markman M, Kennedy A, Webster K, et al. Caratteristiche cliniche delle reazioni di ipersensibilità alla carboplatina. J Clin Oncol. 1999; 17 (4): 1141-5.