Revisione Articolo
Immunopatogenesi della malattia ipertensione Gravidic
Patogenesi immune-patogenesi dell’ipertensione incinta
Alaín Alonso-Remedios, Maité Pérez-Cutiño, Dania F. de León Delgado
Università di Scienze mediche di Cienfuegos. Cuba.
Riepilogo
La malattia ipertensiva Gravidic costituisce una patologia ostetrica relativamente frequente. Negli ultimi anni i progressi sono stati fatti nella comprensione della patogenesi della malattia, essendo il sistema immunitario uno degli attori dell’importanza vitale nell’aspetto di questo disturbo. Le cellule killer naturali di deciduo sono una componente fondamentale nella rimodellatura vascolare durante la formazione della placenta. Quando ci sono alterazioni in questa popolazione cellulare, un’ischemia placentare che promuove il rilascio di fattori vascolari e mediatori di infiammazione che promuovono danni sistemici con l’emergere dei sintomi della malattia è indotto.
Parole chiave: preeclampsia; sistema immunitario; patogenico.
Astratto
L’ipertensione incinta è di frequente disturbo di promnancy. I ricercatori hanno recentemente avanzato nella comprensione della malattia della malattia. Il sistema immunitario svolge il ruolo chiave in questo esordio di progettazione. Le dolci cellule killer naturali sono componenti fondamentali nella rimodellatura vascolare durante lo sviluppo placento. Quando si verifica modifiche in questa popolazione cellulare, l’ischemia placentale è indotta a promuovere il rilascio di fattori vascolari e meccanismi di infiammazione che causano questi sintomi della malattia.
Parole chiave: preeclampsia; Sistema immunitario; patogenesi
Introduzione
La gravidanza è considerata come un evento fisiologico ed è ricevuto, nella maggior parte dei casi, come regalo concesso a sesso femminile.1 Tuttavia, in questa fase ci sono numerose condizioni che costituiscono una causa di morbilità materna e mortalità.
Prehelampsia / Eclampsia è una malattia sconosciuta eziologia in cui un ipossia del tessuto generalizzato appare, in particolare, con un impatto multisystemico che colpisce in particolare il rene, il fegato, i vasi sanguigni e il sistema nervoso centrale. Ipossia, per altri motivi (ipossossi, anemici), aggravare ulteriormente la situazione del paziente aumentando il danno a microcircolazione.2
Ci sono stati circa 2.000 anni dopo che Paracelso ha descritto la malattia per la prima volta; Tuttavia, i progressi nella comprensione della pre-eclampsia sono stati lenti e solo negli ultimi 10 o 15 anni ha cambiato la conoscenza di questo disturbo.3
L’immagine clinica è caratterizzata da la figura di pressione sistolica raggiunge 140 mmHg o più e la pressione diastolica di 90 mmHg o più, accompagnata da proteinuria; È comuni che sia anche cefalea, tinni, fosfens, edema, dolore addominale e / o alterazioni di laboratorio. È noto come Eclampsia quando inoltre, i pazienti con malattia gravida ipertensiva presentano convulsioni o status di virgola in assenza di altre cause.4
Tra i fattori di rischio noti che predispongono a preeclampsia sono: nulliparity, adolescenza, donne Oltre 35, obesità, ipertensione arteriosa precedente, gravidanza multipla, malattie croniche come diabete mellito, storia di preeclampsia / eclampsia in gravidanza, storia familiare di preeclampsia e / o dopo aver sofferto Eclampsia, tra gli altri fattori. 4
È stato recentemente dimostrato che durante la gravidanza c’è un rimodellamento delle arterie a spirale uterina con invasione di cellule trofoblastiche, che è indispensabile per una corretta irrigazione placentare. Quando questo fenomeno è carente, viene ottenuta una placenta ischemica come risultato, che costituisce un fattore centrale nell’etiopatoogeno di preeclampsia.5.6
componenti del sistema immunitario come macrofagi e cellule killer uterini (DNK di Il killer di inglese naturale deciso) è coinvolto nel processo di collocazione. Vi sono prove che mirano a un rapporto diretto tra le popolazioni di cellule immunitarie della placenta, l’ambiente citochino prodotto da queste cellule e l’emergere di malattie associate alla crescita intrauterina incinta, agli aborti e alla malattia ipertesa gestazionale.5,7
Sulla base delle solide evidenze che indicano un ruolo importante nel sistema immunitario nella patogenesi della malattia gravida ipertensiva abbiamo deciso di effettuare questa revisione con lo scopo di descrivere i principali meccanismi immunologici coinvolti nella patogenesi della pre-eclampsia Attraverso il riassunto dei dati forniti dagli articoli pubblicati sull’argomento negli ultimi 10 anni.
Metodi
Una revisione bibliografica è stata eseguita nel database PubMed / Medline, utilizzando i descrittori: pre-eclampsia, pre-eclampsia e infiammazione, pre-eclampsia e sistema immunitario, pre- Eclampsia e citoquinas. Tutti gli articoli pubblicati sul Journal Apri Access La cui data di pubblicazione non ha impedito il 2005. Apparvendo un totale di 225 articoli, di cui 30 opere sono state selezionate nei cui riepiloghi troviamo aspetti relativi allo scopo della nostra ricerca. Inoltre, la rivista cubana di ginecologia e ostetrica è stata rivista laddove i descrittori sono stati utilizzati: pre-eclampsia, etiopatogenico della pre-eclampsia da cui 4 articoli pubblicati dal 2005 sono stati selezionati fino ad oggi.
Immunopatogenesi
Sistema immunitario in placenta normale
La placenta è l’organo di scambio fetale, oltre a prendere in carico la produzione di ormoni. Verso il quarto mese consiste in due componenti; Una fetale del frondoso e una materna, la decidenza basale. Le cellule tropheblastiche e decidue sono mescolate nella zona dell’Unione. Tra il foglio coronico e deciso è lo spazio intermedio occupato da sangue materno.8 L’interfaccia materna-fetale è formata negli spazi intermedi e nella decidenza basale (figura 1) .9
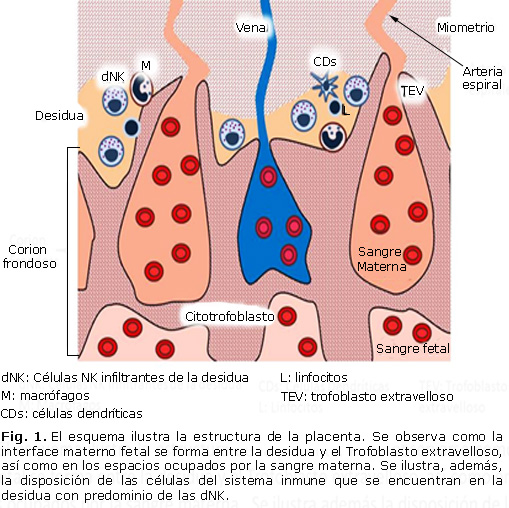
Le celle trofoblastiche sono in contatto diretto con il sangue maternale. Il feto si comporta come un trapianto semi-allogenico avendo la metà delle informazioni genetiche informazioni della madre.10 per evitare il rifiuto, le cellule trofocalizzate non esprimono le molecole del complesso principale dell’istocompatibilità (MHC dell’inglese: maggiore complesso di istocompatibilità) Classe II (DP , DQ e DR). Né hanno molecole di classe MHC I un NI B; Esprimono solo le forme MHC IC e non classiche di MHC I come HLA (dall’inglese: antigeni di leucociti umani) E, F e G.11 in questo modo le cellule trofoblastiche impediscono l’eliminazione da parte delle cellule immunitarie materne nell’interfaccia materna. Fetale.
Nella decisione ci sono cellule del sistema immunitario come linfociti, cellule dendritiche, cellule di killer naturali e altre che sono necessarie per la normale gravidanza.12 cellule killer naturali (NK di killer naturale) costituiscono il principale Popolazione dei leucociti nell’interfaccia materna-fetale.13 Nell’uomo, questa popolazione rappresenta il 70% di tutte le cellule bianche trovate nella placenta durante il primo trimestre di gravidanza e sono chiamati infiltranti nk di deciduo (DNK). Questa popolazione si distingue per il fenotipo CD56 Bright CD16 – a differenza delle cellule NK tradizionali trovate nel sangue periferico e in altri tessuti, che sono caratterizzati dall’esprimere i marcatori CD56Dim CD16 + (Fig. 1) .14
La popolazione DNK Non esprimere dal recettore a basso affinità per IgG (CD16) manca di attività citotossica dipendente dagli anticorpi (la citotossicità mediata da cellule dipendenti da anticorpo ADCC) .9 Inoltre DNKS ha un’espressione maggiore del recettore KIR (dall’inglese: l’immunoglobulina della cellula killer Come i ricevitori) 14 e It (dall’inglese: il ricevitore come leucociti immunoglobulina) 15 che le cellule NK del sangue periferico.
Il KIR è una famiglia polimorfica dei recettori in cui alcuni hanno un’azione inibitoria mentre altri trasmettono i segnali di attivazione. I ligandi di questi recettori sono le molecole di classe MHC I, in particolare l’HLA-C.16 Inoltre il ligando dei recettori dell’ITT sono le molecole HLA-G e la sua segnalazione inibisce anche l’attività citotossica delle cellule NK.15 nel trofoblast è di solito Espresso HLa-C e HLA-G altamente espresso; 14 questo svolge un ruolo importante nella tolleranza del feto e dalla formazione della placenta.
Le citochine DNK secrete pro-infiammatorie come TNF-α (fattore di necrosi tumorale inglese, inglese necrosi del tumore fattore alfa), IL-8 e IFN-γ (Gamma interferone); Oltre a produrre fattori di crescita come il fattore di crescita vascolare endotelio (VEGF, fattore di crescita vascolare-endotelio), 5 fattore di crescita della placenta (PGF, inglese: fattore di crescita placentan), Angny1 / 2 (dall’inglese: angiopietina) e trasformazione Fattore di crescita Beta1 (TGF-β1, dall’inglese: trasformazione della crescita beta1 fattore) .14
In vitro e in vivo Studi ha dimostrato che la segnalazione attivando il recettore nel DNK favorisce l’attività secretoria; A differenza del sangue periferico NK, che rilascia i fattori citotossici dai suoi granuli.17 L’IL-8 prodotto dal DNK interviene nei processi di migrazione e dell’invasione del trophoblasto, tuttavia TNF-α aumenta l’attività citotossica del DNK sulle cellule del trophoblast.5 Allo stesso modo, il PGF, Angpt 1/2 e la VEGF interviene nel processo di allenamento la placenta e il ristrutturato dei vasi sanguigni.14
nell’interfaccia materna-fetale oltre al DNK che troviamo Altre cellule immunitarie. I linfociti T rappresentano meno del 10% dei leucociti trovati nella placenta. Per lo più sono linfociti TCD4 Sebbene possiamo anche trovare i linfociti CD8 T incaricati della produzione di citochine e regolazione dell’invasione tropheblastica.18
cellule dendritiche (CDS) rappresentano solo tra il 1 ° e il 2% dei leucociti (fig . 1). Nell’utero, i CD immatici caratterizzati dall’espressione del marker CD1A, a differenza dei CD maturi trovati nell’endometrio durante la fase mestruale, che esprimono il CD38. I CD interagiscono direttamente con il trophoblast attraverso il ricevitore DC-sing (dal ricevitore ICAM specifico per cellule DENDRITIC-specifico per iNetegin). Data la sua funzione di presentare gli antigeni, i CD hanno la capacità di regolare il modello di differenziazione dei linfociti T.15
l’azione degli ormoni durante la gravidanza ha anche effetto sui linfociti. Il progesterone induce la produzione del fattore vincolante indotto dal progesterone (PIBF del fattore legante indotto dal progesterone inglese). Il GDPF favorisce la differenziazione del fenotipo TH2 di IL-4, IL-5 e IL-10. Le cellule TH2 promuovono l’acquisizione del fenotipo M2 nei macrofagi, che contribuisce all’ambiente tolerogenico della placenta.19
i macrofagi rappresentano circa il 20% dei leucociti infiltranti della decidua durante la gravidanza; Tuttavia, costituiscono un’importante fonte di citochine per la tolleranza del feto e la difesa contro le infezioni. Nella gravidanza normale, i macrofagi dei secretori di citochine antinfiammatorie M2 (CD68 +) e fattori vascolari come VEGF, IL-8 e Angpt ½ (figura 1) .20
Immunopatigno di PREECLAMPSIA
Per un lungo periodo è stata considerata malattia ipertensione gestazionale (pre-eclampsia / eclampsia) come disturbo di eziologie multiple; Tuttavia, negli anni ’70 del secolo scorso è stato rivelato che questa malattia era associata all’ischemia utero-placentare. Al giorno d’oggi è noto che questa insufficiente irrigazione è dovuta alla formazione inadeguata dei vasi sanguigni in placenta.21
Durante la gravidanza normale, le cellule derivate da cytofoblast fetale migrano all’endometrio e al miometrio che sostituiscono il muscolo liscio e il myometrio Endotelio delle arterie a spirale uterina, questo ristrutturato garantisce vasi di calibro maggiore e meno resistenza al flusso sanguigno. Tuttavia, quando questo processo non si verifica completamente, sono state avviate complicazioni associate alla gravidanza.5
Gli sforzi intensivi sono stati fatti per comprendere i fattori coinvolti nel processo di formazione della placenta. Le prove recenti indicano che la scarsa proliferazione, la migrazione e l’invasione delle cellule trofocalizzate sono conseguenze di infiltrazione aberrante da parte delle cellule immunitarie nell’utero e nell’azione delle citochine prodotte da queste cellule.5
nella patogenesi di Praeclampsia sono coinvolte Molecole MHC non classiche, cellule NK, cellule dendritiche, recettori di riconoscimento del modello, citochine e sottopopolazioni dei linfociti TCD4 e TCD8. 22 Ecco perché il sistema immunitario svolge un ruolo importante in questo disturbo. Gli esperimenti in vitro hanno dimostrato che i DNK sono importanti per il processo di rimodellamento delle arterie a spirale e la corretta formazione della placenta. Pertanto, le modifiche in questa popolazione cellulare sono legate all’emergere della malattia.23
In un modello murino di malattia gravida ipertensiva è stato dimostrato che vi è una riduzione della popolazione DNK con la conseguente perdita di fattori derivati Da queste cellule.24 Altri studi, attraverso il modello murino pre-eclampsia BPH / 5 ha mostrato un’elevazione di IL-15 pur diminuendo la popolazione DNK. Nell’uomo, l’esistenza della relazione tra i livelli di IL-15 e la gravità della preeclampsia.13
Gli studi immunoistochimici sono stati danneggiati negli esseri umani hanno dimostrato un aumento della popolazione delle cellule placentali NK (CD56). Alle placentas delle normali donne incinte. Tuttavia, non ci sono state differenze significative tra l’infiltrazione da parte delle cellule NK placentali tra le donne con pre-eclampsia e Eclampsia.25 Questi risultati apparentemente contraddittori a quanto riscontrato nei modelli animali sono dovuti in pazienti con malattia gravida ipertensiva, si verifica un processo infiammatorio associato. All’ischemia placentaria con il reclutamento delle cellule NK periferiche con attività citotossica16, questi dati corroborano la teoria che c’è un collegamento tra l’infiammazione e lo sviluppo della malattia.Sebbene le nuove prove siano state pubblicate di recente che confermano il ruolo dell’infiammazione nella genesi della pre-eclampsia.26.27
altre cause dell’infiammazione diversa dall’ischemia sono state correlate alla genesi della malattia. Ad esempio, è descritta l’associazione tra infezioni da tratto genitali e patologie multiple in donne in gravidanza. Al suo interno i fallimenti dell’impianto, gli aborti e la consegna pre-termini. Tuttavia, l’ambiente infiammatorio causato da questi germi altera il modello di citochine nell’utero, che potrebbe contribuire all’aspetto della malattia ipertesa gestazionale come trigger .28
studi nei modelli animali ha dimostrato che l’iniezione di LPS All’inizio della gravidanza ha prodotto sintomi simili a pre-eclampsia. Queste scoperte suggeriscono che il segnaletica del recettore del riconoscimento del modello TLR-4 (dall’inglese: il ricevitore del pedaggio) è importante nella Genesi di questa malattia. Ci sono dati clinici per aumentare questo recettore in placentas umani di donne con pre-eclampsia.29, indicare anche una possibile associazione tra i batteri gram negativi e lo sviluppo della malattia ipertesa gestazionale.30 È necessario ricordare che una parte importante del La microbitata del tratto genitale è batterica grammo negativa.
La risposta infiammatoria non appare solo prima delle infezioni; Ad esempio, l’obesità è associata a un processo infiammatorio cronico di bassa qualità. 31 Studi hanno dimostrato che l’obesità e le diete ricche di zuccheri e grassi diminuiscono l’infiltrazione di DNK durante la gravidanza. Inoltre, gli adipociti producono la leptina, che aumenta l’attività citotossica del DNK.5 I risultati sono livelli più bassi dei fattori necessari per stimolare la migrazione del trofoblasto e dall’altro, una popolazione di DNK con la capacità di distruggere le cellule trofocalizzate. La combinazione di questi fenomeni viene tradotta in un rimodellamento inferiore delle arterie a spirale, quindi, il flusso sanguigno utero-placentario è interessato e la placenta diventa ischemica.
La placenta ischemica produce fattori solubili come SFLT1 e VEGF, l’elevazione di questi fattori nel sangue materna è associata all’inizio della pre-eclampsia.32-34 l’uso di anticorpi monoclonali (ACM) contro il SFLT1 e la VEGF ha dimostrato la riduzione della proteinuria nei topi. È interessante notare che gli esseri umani, la pre-eclampsia non si sviluppa in tutte le donne con valori elevati di SFLT1.35 Questi risultati sono dovuti ai fattori prodotti dalla placenta ischemica inducono danni endoteliali generalizzati responsabili della proteinuria e delle figure elevate della pressione sanguigna. La combinazione di questi due fattori e il danno endoteliale sono responsabili della comparsa dell’edema in questi pazienti (figura 2) .26

Endoglin sembra svolgere un ruolo importante nell’infortunio endoteliale e potrebbe servire come marcatori di rischio per lo sviluppo della malattia. Il fattore inducibile dell’ipossia alfa (HIF1-α di fattori inducibili ipossia inglesi) sembra svolgere un ruolo rilevante all’inizio della malattia ipertensione gestazionale.36 HIF1-α si verifica in risposta all’ippoxia e il suo aumento della placenta è associato all’espressione di I geni di risposta dell’ipossia all’interno del quale il VEGF e il fattore SFLT1.37
HIF1-α non è solo intervenuto nella sintesi dei fattori vascolari derivati dalla placenta se non ha effetto nel sistema immunitario, che favorisce L’ambiente infiammatorio nell’interfaccia materna-fetale, 37 con un aumento delle popolazioni di TH1, produttori di IFN-γ, IL-2 e IL-12, insieme a una diminuzione delle popolazioni di linfociti T aumolatori.38 Questo ambiente infiammatorio, insieme ad endoteliale Il danno favorisce il reclutamento dell’NK con l’attività citotossica, che distrugge le cellule trofocalizzanti che influenzano ulteriormente la circolazione utero-plactental e rafforza l’ischemia.39 Quindi tale contributo inadeguato di ossigeno Essere il fattore di detonazione della malattia.
L’ischemia placentaria induce anche un aumento della popolazione macrofagi M1-γ-γ.5 Sebbene IFN-γ aumenti la produzione di CXCL12 da celle endoteliali, il fattore principale per il reclutamento CD56 NK BRIGHT CD16, -40 ITS La segnaletica induce l’apoptosi nelle cellule trofocalizzate.11 Pertanto, questa ischemia iniziale peggiora la genesi della malattia che diventa un anello di amplificazione nell’immunopatogenesi della preeclampsia. Per questo motivo, possiamo affermare che l’effetto di IFN-γ nell’immunopatogenesi della preeclampsia è controverso; Tuttavia, molti autori hanno associazione correlata tra alti livelli di questa citochina e lo sviluppo della malattia.22
Altre citochine prodotte da macrofagi del fenotipo M1, come TNF-α, favorisce l’espressione aberrante delle metalloproteinasi e produce l’apoptosi diretta in cellule trofocalizzate con la quale l’invasione trophoblastica alle arterie a spirale viene rallentata. 40 In generale, le citochine proinfiammatorie riducono la migrazione trophoblastica e sono collegate allo sviluppo della malattia.22
Allo stesso modo, il modello di risposta del linfocita TCD4 è anche correlato all’aspetto della patologia, dove alcune sottopopolazione tali come TH1 e TH17 favoriscono il loro aspetto; Mentre il Treg e TH2 costituiscono fattori protettivi.41.42 In generale, le citochine del modello TH1 promuovono l’apoptosi delle cellule trofocalizzate e il ritardo nell’invasione del trophoblast; Mentre le citochine del modello TH2 favoriscono la proliferazione e l’invasione dei trophoblast.11.22 Gli studi clinici hanno dimostrato che le donne con la preeclampsia hanno elevato il linfocitano Numeri43 e Treg diminuiti rispetto alle normali donne in gravidanza e queste alterazioni materne trascendono il feto, che influisce Il sistema immunitario del neonato nelle prime settimane di vita.44
Inoltre, lo sviluppo della grave malattia gestazionale è correlata a cambiamenti epigenetici e genetici nel paziente. Uno studio bioinformatico ha dimostrato che nell’espressione dei geni polimorfi nell’influenza cronica Villi sull’aspetto della preeclampsia, sono per lo più collegati ai geni di espressione differenziale. Gran parte dei prodotti di questi geni sono collegati all’attività della DNK.45
le scuole negli esseri umani hanno dimostrato che le madri in cui il loro DNK esprime solo recettori KIR inibitory come la combinazione Kir2dl1n con l’espressione di Allele di HLA-C2 del feto aumenta il rischio di malattia sugo ipertensiva e la crescita intrauterina ritardata rispetto alle madri che esprimono l’allele KIR2DS1 del recettore attivante a DNK.46 questo è spiegato dal fatto che la segnalazione attivando i ricevitori induce in DNKS la loro secretoria Funzioni e non citotossico.17
Polymorfismi in HLA-G sono stati anche collegati a un aumento del rischio di preeclampsia, poiché i portatori di feto dell’allele + 14 BP HLA -G hanno un’espressione inferiore di HLA-G in celle trofoblastiche che favorisce l’azione citotossica di NK. (11) altri polimorfismi come TGF-β 1869 T˂C; 47 nonché nelle proteine C6 MASP1 del complemento sono stati anche associati allo sviluppo della malattia.48
come sintesi in Patogenesi dalla malattia, i fattori ambientali e genetici che portano come conseguenza un inferno inferiore delle cellule DNK è imbroglato. A causa dell’importanza del DNK per promuovere la migrazione e l’invasione delle cellule trofocalizzazioni, una diminuzione della presente popolazione porta come conseguenza che le cellule endoteliali o muscolose lisce delle arterie a spirale non vengono sostituite con la conseguente insufficienza del contributo del sangue e nutrienti.. In risposta a questa ischemia placentare, i fattori e le citochine vengono rilasciati che trasformarono l’ambiente di tollerogenico per infiammatorio con le quali le cellule trofocalizzate vengono ulteriormente distrutte. D’altra parte, l’eccesso di fattori vascolari e la trasformazione del processo infiammatorio locale in sistemico produce danni endoteliali, che è responsabile per l’aspetto dell’immagine clinica in questi pazienti.
Conflitti di interesse
Gli autori non dichiarano di avere conflitti di interesse.
1. García I, tedesco M. rischi di gravidanza in età avanzata. REV CUBANA OSTET GYNECOL. . 2013; 39 (2): 120-7. Disponibile in: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2013000200007&lng=es
2. Suárez J, Gutierrez M, Cairo V, Marín Y, Rodríguez L, Veetia M. Preeclampsia Precedente come fattore di rischio nel fattore di rischio nel Gravidanza corrente REV CUBANA OSTET GYNECOL. . 2014; 40 (4): 368-77. Disponibile in: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2014000400003&lng=es
3. Delgado J, Reyes e, Amador A, García M, Cubero o, Quesada f, et al. Malondialdeide e peso della nascita in pre-eclampsia. Breve recensione e associazione tra entrambi. REV CUBANA OSTET GYNECOL. . 2008; 34 (3): Disponibile in: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2008000300003&lng=es
4. Álvarez v, alonso r, muñiz m, martínez J. Caratterizzazione dell’ipertensione indotta dalla gravidanza . REV CUBANA OSTET GYNECOL. . 2014; 40 (2): 165-74. Disponibile in: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2014000200004&lng=es.
5. Spradley F, Palei A, Granger J. Meccanismi immunitari che collegano l’obesità e la preeclampsia. Biomolecole . 2015; 5: 3142-36. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4693273/
6. Abbas Y, Oefner C, Polcack W, Gardner L, Farrell L, Shadkey A, et al. Un dosaggio di microfluidici per studiare l’invasione delle cellule del trophoblast placentali umane. J R SOC interfaccia. . 2017; 14 (130). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5454302/
7. Matson BC, Caron Km. Adrenomedullin e controllo endocrino delle cellule immunitarie durante la gravidanza.Cel & molmunol. . 2014; 11: 456-9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4197213/
8. SALDER TW. Langman’s Medical Embriology. 8 ° ED. Messico: Ed Médica Panamericana; 2010.
9. Jabrane-Ferrat N, Siewiera J. Il lato superiore delle cellule decidue naturali killer: nuovi sviluppi nell’immunologia della gravidanza. Immunologia. . 2013; 141: 490-7. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3956423/
10. Göhner C, Plösch T, Faas M. Effetti immune-modulatori di sinconitrophoblast vescicolari extracellulari in gravidanza e preeclampsia. Placenta. . 2017; PII: S0143-4004 (17) 30288-6. http://www.sciencedirect.com/science/article/pii/S0143400417302886?via%3Dihub
11. Serrano NC. Immunologia e genetica della preeclampsia. Clin sviluppa l’immunol. . 2006; 13 (2-4): 197-01. Disponibile IT: https://www.ncbi.nlm.nih.gov/pubmed/17162362
12. Lamarca B, Amaral L, Harmon A, Cornelius D, Faulkner J, Cunningham MJ. Isemia placentare e fenotipo risultante nei modelli animali di preeclampsia. REP. Hypertens. 2016; 18 (5): 38. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5127437/
13. Sona JL, LOB, ISROFF CE, DAVISSON RL. Ruolo delle cellule decidue del killer naturale, Interleukin-15 e interferone-γ nello sviluppo placento e nella preeclampsia. AM J Physiol ReGUL Integra Comp Physiol. . 2014; 307 (5): 490-2. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4214833/
14. Da Lima P, Zhang J, Dunk C, Lye SJ, Croy BA. Angiogenesi decidual del leucociti in gravidanza precoce. Cel & molmunol. . 2014; 11: 522-37. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4220841/
15. Martínez-Varea A, Pelliccer B, Peraales-Marín A, Pellicer A. Relazione tra la risposta immunologica materna durante la gravidanza e l’insorgenza di Preeclampsia. J di immunol res. . 2014; 2014: 210241. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4060291/
16. Takeshita lyc, gonzalez-galarza ff, dos santos ejm, maia mht, rahmam mm, zain sms, et al. Un database per la cura delle associazioni tra recettori e malattie da immunoglobulina cellulare killer nelle popolazioni mondiali. Banca dati. . 2013; 2013: BAT021. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3625957/
17. Hannaj Gwy. Le cellule NK decidual regolano processi di sviluppo chiave nell’interfaccia umana fetale-materna. NAT MED. . 2006; 12: 1065-74. Disponibile IT: http://www.nature.com/nm/journal/v12/n9/full/nm1452.html?foxtrotcallback=true
18. Wallace AE, Fraser R, cartwright je. Trofoblasta extravillous e cellule killer naturali decidue: una partnership di rimodellamento. Aggiornamento riproduttore umano. . 2012; 18 (4): 458-71. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3373213/
19. Robinson DP, Klein SL. Gli ormoni associati alla gravidanza e alla gravidanza alterano le risposte immune e la patogenesi della malattia. Comportamento del corpo . 2012; 63 (3): 263-71. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3376705/
20. Smith SD, Dunk Ed, Aplin JD, Harris LK, Jones Rl. Prova per il coinvolgimento delle cellule immunitarie in arteriole a spirale decidual rimodellamento nella gravidanza umana precoce. Am j patolo. . 2009; 174: 1959-71. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2671283/
21. Vázquez Cabrera J. embarazo, parte y puerperio. Princips Complicaciones. La Habana: editoriale Ciencias Médicas; 2009.
22. Ning F, Liu H, Lash G. Il ruolo dei macrofagi decidui durante la gravidanza normale e patologica. AM J riproduttore immunol. . 2016; 75 (3): 298-309: p. 510-24. https://www.ncbi.nlm.nih.gov/pubmed/26750089
23. Robson A, Harris LK, Pnes BA, Lash Ge, Aljunaidy mm, Aplin JD, et al. La cellula del killer naturale uterina inizia l’arteria a spirale rimodellamento nella prematura umana. FASEB J.. 2012; 26: 4876-85. Disponibile IT: https://www.ncbi.nlm.nih.gov/pubmed/22919072
24. Linzke N, Schumacher A, WooDacki K, Croy BA, Zenclussen AC. Il monossido di carbonio promuove la proliferazione delle cellule del killer naturale uterina e della rimodellatura delle arterie a spirale in topi mutanti dell’OxyGenase-1 ipertensiva dell’ipertensile. Ipertensione. . 2014; 63: 580-8. Disponibile IT: http://hyper.ahajournals.org/content/63/3/580.long
25. Akhlaq m, nagi ah, yousaf aw. Morfologia placentaria nella pre-eclampsia ed eclampsia e il probabile ruolo delle cellule NK. Microbiol indiano J Patolo. . 2012; 51 (1): 17-21. Disponibile IT: http://www.ijpmonline.org/article.asp?issn=0377-4929;year=2012;volume=55;issue=1;spage=17;epage=21;aulast=Akhlaq
26. Borzychowski Am, Sargent Il, Redman CWG. Infiammazione e pre-eclampsia. SEM IN FET & NEON MED. 2006; 11: 309-16. Disponibile IT: http://www.sciencedirect.com/science/article/pii/S1744165X06000436?via%3Dihub
27. Harmon A, Cornelius D, Amaral L, Faulkner J, Cunningham MJ, Wallace K, et al. Il ruolo dell’infiammazione nella patologia della preeclampsia. Clin Sci (Lond). . 2016; 130 (6): 409-19. Disponibile IT:
28. Weiss G, Goldsmith lt, Taylor Rn, Bellet D, Taylor Hs. Infiammazione nei disturbi riproduttivi. Reprod Sci. . 2009; 16 (2): 216-29. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3107847/
29. KOGA K, MOR G. Recettori simili a pedaggio sull’interfaccia materna-fetale nei normali disturbi della gravidanza e della gravidanza. AM J riproduttore Immuno. . 2010; 63 (6): 587-00. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3025804/
30. Rampersaud R, Randis TM, Ratner AJ. Microbiota del tratto genitale superiore e inferiore. Med neonatale semin feto. . 2012; 17 (1): 51-7.Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3242913/
31. Romeo GR, Lee J, Shoelson SE. Sindrome metabolica, resistenza all’insulini e ruolo di infiammazione-mecanismi e obiettivi terapeutici. Arterioescler. Tromb. Vasc. Biol. . 2012; 32: 1771-6. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4784686/
32. Palmer K, Tong S, Kaitu’u-Lino T. Placental-specifico-specifico SFLT-1: RUOLO nella patofisiologia pre-eclampica e le sue possibilità traslazionali per la previsione clinica e la diagnosi. Mol hum Reprod. . 2017; 23 (2): 69-78. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4925329/
33. Almasry s, elfayomy A, hashem h. ultrastruttura e analisi istomorfometrica delle navi del cordone ombelicale umano in Preeclampsia: un potenziale ruolo di VEGF , VEGFR-1 e VEGFR-2. ROM J Morphol Embryol. . 2016; 57 (2 suppto): 681-9. Disponibile IT: http://www.rjme.ro/RJME/resources/files/571216681689.pdf
34. Liberis A, Stanulov G, Ali E, Hassan A, Pagalos A, Kontomanolis E. Pre-Eclampsia e la crescita endoteliale vascolare Fattore: un nuovo aspetto. Clin ExcStat Gynecol. . 2016; 43 (1): 9-13. Disponibile IT: https://www.ncbi.nlm.nih.gov/pubmed/27048010
35. Kanasaki K, Kalluri R. La biologia della preeclampsia. Rene int. . 2009; 76 (8): 831-7. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4313558/
36. rob k, cotechini t, allaire c, sperou A, Graham C. La restrizione fetale indotta da infiammazione è associata a ratti Aumento dell’accumulo di HIF-1α positivo. Plos. . 2017; 12 (4): E0175805. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5397034/
37. Charnock-Jones D. Ipossia Placental Ipossia, stress reticolo endoplasmatico e sensibilizzazione endoteliale materna da SFLT1 in pre-eclampsia. J rimprovera immunol. . 2016; 114: 81-5: 38-42. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4822533/
38. Vianna P, Mondadori A, Bauer M, Dornfeld D, Chies J. HLA-G e CD8 + cellule T regolatoriali nell’infiammatorio Ambiente di pre-eclampsia. Riproduzione. . 2016; 152 (6): 741-51. Disponibile IT: http://www.reproduction-online.org/content/152/6/741.long
39. Southcombe J, Redman C, Sargent I. Cellule T Naturali invariante periferica invariante per le cellule T per la gravidanza e nelle donne preacciccolate. J rimprovera immunol. . 2010; 87 (1-2): 52-9. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2995212/
40. Lockwood cj, basar m, kayisli ua, guzeloglu-kayisli o, murk w, wang j, et al. Interferone-G protegge le cellule decidue del primo trimestre contro la matrice aberrante metalloproteinases 1, 3 e 9 espressione in preeclampsia. Am j patolo. . 2014; 184: 2549-59. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4188280/
41. Lamarca B, Cornelius D, Harmon A, Amaral L, Cunningham M, Faulkner J, et al. Identificazione dei meccanismi immunitari che metteno la mediazione dell’ipertensione durante la preeclampsia. AM J Physiol ReGUL Integra Comp Physiol. . 2016; 311 (1): R1-9. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4967235/
42. Figueiredo A, Schumacher A. Il paradigma della cellula T tipo 17 / regolatore di THE THE THE A. Immunologia. . 2016; 148 (1): 13-21. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4819144/
43. Cornelius D, Amaral L, Wallace K, Campbell N, Thomas A, Scott J, et al. Ridotta pressione di perfusione uterina T-Helper 17 celle causa una fisiopatologia associata alla preeclampsia durante la gravidanza. AM J Physiol ReGUL Integra Comp Physiol. . 2016; 311 (6): R1192-R1199. Disponibile IT: http://ajpregu.physiology.org/content/311/6/R1192.long
44. Sava F, Tato G, Treszl A, Hajdú J, Harmath Á, Rigó JJ, et al. Sottini cellulari immunitari, livelli di citochina e cortisolo durante la prima settimana di vita nei neonati nati da madri pre-eclamici. AM J riproduttore immunol. . 2017; 77 (6). Disponibile IT: http://onlinelibrary.wiley.com/doi/10.1111/aji.12659/pdf
45. Rabaglino Mb, post-uterweer ed, jeyabalan a, hogge wa, conrad kp. Un approccio bioinformatico rivela le prove per la prua maturazione endometriale prua prima e durante la gravidanza precoce nelle donne che hanno sviluppato la preeclampsia. Ipertensione. . 2015; 65 (2): 421-9. Disponibile IT: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4290371/
46. Ivarsson MA, Michaëlsson J, Faurt C. Attivazione dei recettori ig-simili a celle killer in salute e malattia. Immunol anteriore. . 2014; 5 (184): 1-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4001058/
47. li x, shen l, tan h. polimorfismi e livello plasma di trasformazione fattore di crescita-beta 1 e rischio per la preeclampsia: a Revisione sistematica. Plos. . 2014; 9 (5): E97230. Disponibile IT:
48. wu w w, yang h, feng y, zhang p, li s, wang x, et al. Polimorfismi in geni di complemento e rischio di preeclampsia a Taiyuan, in Cina. Res infiammabile. . 2016; 65 (10): 837-45. Disponibile IT: https://link.springer.com/article/10.1007%2Fs00011-016-0968-4