Lavori originali
Papillare Neoplane Indraductal Pancreas: Risultati clinici-patologici
Neoplasmi mucinosi Papillary intraduttali (IPMN ) del pancreas: risultati clinico-patologici
j. A.-Cienfuegos1, F. Rotellar1, P. Martí Cruchaga1, V. Valentí1, G. Zozaya1, A. Bueno1, N. Pedano1, MD Lozano2, JJ Solo2 e F. PARDO1
1Departamento della chirurgia generale e digestivo.
2 servizio patologico anatomia. Università della Clinica di Navarra. Pamplona, Navarra
Direzione per corrispondenza
Riepilogo
Introduzione: La neoplasma papillario mucinosa intraduttale (NPMI) del pancreas comprende una serie di ferite che si evolvono da infortuni benigni (adenoma) al carcinoma ductuale invasivo.
Obiettivo: analizzare i risultati clinici e patologici di 15 pazienti con diagnosi di NPMI e intervenuiti secondo le raccomandazioni della conferenza di consenso.
Materiale e metodi: Analisi retrospettiva di 15 pazienti con NPMI, intervenuto tra marzo 1993 e settembre 2009; Secondo le linee guida per le conferenze di consenso internazionali. Dati demografici, test diagnostici, tipo di intervento, istopatologia e sopravvivenza attuariale sono stati raccolti con un follow-up tra mese e mezzo e nove anni.
Risultati: 6 duodenopancreatectomies, 4 pancreatectomies totale, 2 pancreatectomies centrale, 2 pancreatectomies parziale a Pancreatectomia distale. Una morbidità del 40% è stata registrata, senza mortalità operativa, con un soggiorno medio di 10 giorni. In 5 casi il NPMI è stato miscelato, in 4 colpiti il condotto pancreatico e nei restanti 6 a rami accessori. Due pazienti hanno presentato il carcinoma in situ e 3 carcinoma invasivo con linfonodi negativi. Un paziente, senza carcinoma invasivo, è morto a 66 mesi dal pancreas adenocarcinoma. La sopravvivenza attuariale fino alla recidiva o alla morte era di 105.133 mesi; Con una gamma di follow-up tra mese e mezzo e 9 anni.
Il NPMI duttale e misto richiede la resezione completa grazie all’elevata incidenza di carcinoma invasivo o infortuni precursori di malignità. Per la sua natura multifocale, i pazienti dovrebbero essere rivisti a lungo termine. Ci sono polemiche nell’accessorio asintomatico tipo NPMI e meno di 3 cm.
Parole chiave: neoplasma papillario mucinoso intraduttale. Fattori prognostici Carcinoma invasivo. Sopravvivenza.
Astratto
Sfondo: Neoplasma neoplasmato mucinoso papillario intraduttivo (IPMN) mostra a serie di lesioni che si evolvono dalle lesioni benigne -denoma a carcinoma invasivo.
Aound: Analizzare I risultati clinici e patologici di 15 pazienti con diagnosi di IPMN e trattato chirurgicamente secondo le linee guida della conferenza internazionale della conferenza.
Materiale e metodo: un’analisi retrospettiva di 15 paganti trattati chirurgicamente tra marzo 1993 e settembre 2009, secondo l’Internazionale Raccomandazione del consenso. Strumenti demografici, diagnostici, report chirurgici, database patologico e sopravvivenza attuarial sono stati analizzati con un follow-up da un mese e mezzo di nove anni.
Risultati: 6 Bantastati sono stati sottoposti a pancreaticoduodomectomiactomia, 4 corpo o pancreatectomia di pancreatectomies 2 Pancreatectomie parziali ) e 1 pancreatectomia distale. Una morbilità della mortalità dell’ospedale del 46 e dello 0% è stata valutata, con un soggiorno ospedaliero di lunghezza mediana di 10 giorni. In cinque casi, l’IPMN è stato combinato il tipo combinato (sia i condotti pancreatici principali che di ramo involtografica) in quattro principali tipi di condotti e ramo di ramo negli altri sei. Diversi Atipia (carcinoma IPMN in sitión) è stato osservato in 2 paganti e carcinoma invasivo con linfonodi negativi è stato identificato in 3 paganti. Un paziente senza carcinoma invasivo ha creato a 66 mesi di follow-up per il pancreas adenocarcinoma. La sopravvivenza attuariale fino alla recidiva o alla morte era di 105.133 mesi con una gamma di follow-up da 1 mese e mezzo fino a 9 anni.
concerie: il condotto principale IPMN o il tipo misto garantisce la resezione completa grazie alla sua incidenza di carcinoma invasivo o Anche lesioni precursori di malignità. A causa del suo motivo multifocale, i pazienti devono essere seguiti in sorveglianza a lungo termine. La gestione del ramo di tipo IPMN asintomatico inferiore a 3 cm è controverso.
Parole chiave: neoplasma mucinoso papillare intraduttale. Fattori di prognosi. Carcinoma invasivo. Sopravvivenza.
Introduzione
La neoplasia papillare la neoplasia pancreas endraduttale (NPMI) comprende uno spettro di lesioni con caratteristiche biologiche e cliniche che hanno suscitato un grande interesse per l’ultimo decennio (1-6).
La prima serie di casi clinici di NPMI è stata descritta da Ohhashi nel 1982 e ha ricevuto il suo nome da Sessa nel 1994 (7,8).Il fatto che il 20-30% degli NPMI sia multifocale e il 5-10% può influire sull’intera ghiandola, ha generato più controversie multiple nel trattamento chirurgico e il follow-up di questi pazienti (1-5).
I fatti più significativi degli NPMI sono le loro forme di presentazione -Varitor ductal, di accessori di condotti pancreatici e progressione mista e sequenziale da lesioni incipienti, come adenoma a carcinoma in situ e carcinoma invasivo; Quindi dovrebbe essere considerato come una lesione precursore del cancro del pancreas, specialmente nelle lesioni del condotto pancreatico principale (9-13).
Al fine di chiarire le suddette controversie, diverse riunioni di consenso in merito alla diagnosi e al trattamento . L’obiettivo di questo lavoro è analizzare i risultati del trattamento chirurgico dell’NPMI e del suo accordo con le raccomandazioni delle Conferenze di consenso (14-16).
Materiale e metodi
tra Marzo 1993 e settembre 2009, 38 pazienti sono stati intervenuti da tumori Quistum di pancreas, di cui 15 hanno diagnosticato con neoplasma papillario mucinoso intraduttale (NPMI), oggetto di questo studio.
un’analisi retrospettiva delle storie cliniche, Objecting dei sintomi principali, quelli relativi alla chirurgia, all’istopatologia, alla sopravvivenza e al modello di ricorrenza. L’indicazione chirurgica è stata stabilita nella sessione interdisciplinare, basata su diversi test dell’immagine: Tomografia computerizzata multicort (TC), ecografia endoscopica (uso) con puntura ad ago fine (PAAF), risonanza magnetica Collangiopancreatography (CPRM) e citologia secondo le linee guida del consenso Riunioni menzionate.
nelle lesioni situate nella testa del pancreas, processo non innato e il corpo del pancreas, è stato eseguito il duodenopancreatectomtomia cefalico (intervento krauss-whipple). Negli infortuni centrali, è stata eseguita la pancreatectomia centrale e nelle ferite del corpo e della coda, è stata eseguita flusso o pancreatectomia distale. Nei pazienti con coinvolgimento dell’intero condotto WADSUNG, è stata eseguita la pancreatectomia totale. In tutti i casi è stato effettuato uno studio intraoperatorio dei bordi di resezione pancreatica.
La diagnosi di NPMI è stata effettuata in conformità con la nomenclatura stabilita dall’organizzazione mondiale della sanità (OMS) (17) e della Conferenza di consenso TENUTO A OSAKA nel 2004 (15). I tumori sono stati esclusi che hanno presentato uno schema simile allo stroma ovarico e che sono stati diagnosticati come tumori chimici mucinosi (17).
L’NPMI è stato classificato in tre categorie: coloro che hanno colpito il principale condotto pancreatico, quelli originati nell’accessorio rami e neoplasmi misti quando hanno influenzato entrambi i componenti. I tumori sono stati classificati in NPMI non invasive e NPMI invasivi; Secondo i criteri di chi sono i criteri e quelli successivamente pubblicati da Singh e Maitra (9,17).
I bordi di resezione sono stati studiati in conformità con gli standard AJCC (manuale di stadiazione del cancro) (18). Il margine di resezione pancreatico è stato considerato positivo ogni volta che qualsiasi grado di NPMI è stato identificato microscopicamente.
La mortalità operativa è stata definita come morte nello stesso reddito ospedaliero o nei primi 30 giorni di periodo postoperatorio. La fistola pancreatica è stata definita quando le concentrazioni di amilasi erano tre volte superiore al valore del plasma nel drenaggio percutaneo (19). La recidiva è stata definita come “locale” sul letto pancreatico, “regionale” nella cavità peritoneale e “remota” se si è verificato in fegato, polmone, ossa, ecc. Gli intervalli di confidenza sono stati calcolati con il programma EPI Info 6.0, 4C. La sopravvivenza attuariale è stata calcolata secondo il metodo Kaplan-Meier, con il programma SPSS, versione 15.0.
Risultati
Nella tabella I riassumono le caratteristiche cliniche più rilevanti della serie. L’incidenza era simile in entrambi i sessi sia con una fascia di età compresa tra 33 e 79 anni (61 anni mediani, media 63,2 anni); Limite di fiducia (LC): 95%; 55.95-70.44.
I sintomi della presentazione erano generalmente Anodyne, sebbene cinque pazienti hanno studiato con sintomi specifici, come ittero, febbre, episodi precedenti di pancreatite e sindrome costituzionale.
il più Il test diagnostico usato era il CT-addominale con endoscopica endoscopica (uso) e puntura fissa dell’ago. La citologia è stata positiva per il tumore mucinoso in 8 dei 9 casi in cui è stato eseguito (88,8% di sensibilità). In due pazienti, è stato ottenuto materiale insufficiente.
Otto dei neoplasmi erano situati nella testa del pancreas, in tre pazienti si diffondono in modo diffuso al canale pancreatico principale e nel corpo colpito da NPMI rimanente -Cola, processo infinito e in due casi al corpo del pancreas.Sono state eseguite sei duodenopancreatectomies, quattro pancreatectomie totali, due pancreatectomie centrali, due pancreatectomie parziali e una pancreatectomia distale.
complicazioni sono state registrate in 6 pazienti (40%). Quattro collezioni presentate “del letto chirurgico” di cui 3 drenaggio transdesco richiesto utilizzando. Una persona malata, che è stata praticata un’enucleazione, ha sviluppato una fistola pancreatica a quattro giorni dallo scarico ed è stata trattata con drenaggio percutaneo. Un altro paziente ha sviluppato lo svuotamento gastrico ritardato. Il soggiorno ospedaliero medio è stato di 10 giorni (intervallo 4-22 giorni). Non c’era la mortalità operativa.
In cinque casi l’NPMI è stato miscelato e in quattro NPMI ha colpito il principale condotto pancreatico (figura 1). Nei restanti sei i rami accessori pancreatici colpiti NPMI (figura 2). In tre casi, una leggera displasia è stata descritta nel margine di resezione pancreatico e la resezione non è stata estesa.
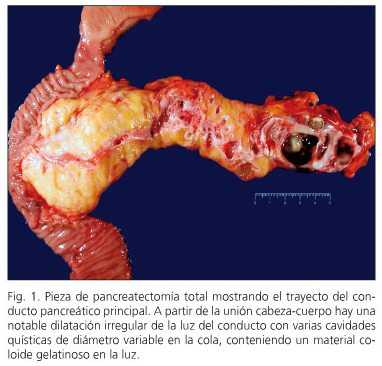
In tre pazienti, la neoplasia intraepiteliale pancreatica (“Panin” è stata rilevata. In due casi è stato il tipo Panin-1a, lesioni piatte con atipia minima e una lesione Panin-2 con atipia moderata. Due pazienti avevano NPMI con Dysplasia di alta qualità -Carcinoma in situ- (casi 6 e 10) e altri tre pazienti (casi 1, 2 e 3) hanno presentato un carcinoma invasivo con linfonodi negativi (figura 3). Due di loro sono privi di malattia a otto e nove anni di follow-up, mentre uno è privo di malattie a tre anni di pancreatectomia e dopo essere stato riunito da una recidiva regionale a 15 mesi di pancreatectomia.
Un paziente (caso 4) è morto a cinque anni e mezzo di una ricorrenza del ganglio munciale del pancreas adenocarcinoma. Il resto dei pazienti rimane vivo e privo di malattie. Tutti i pazienti sono stati esaminati con un campo di follow-up tra un mese e mezzo e nove anni; Ottenere una sopravvivenza attuariale di 105.133 mesi con un indice di confidenza del 95% (86,264-124,003) e una sopravvivenza alla ricorrenza o alla morte di 98.355 mesi (intervallo di confidenza: 76.761-119.949). Nella figura 4 la sopravvivenza attuariale viene raccolta fino alla presenza di recidiva o morte.
discussione
La prima serie di NPMI è stata descritta da OHHASI nel 1982 (7,20). Successivamente Sessa et al. Hanno caratterizzato la lesione con il termine attualmente impiegato (8).
Infine, l’Organizzazione mondiale della sanità (OMS) nel 1996, in occasione di una classificazione dell’esocrina del pancreas, ha definito l’NPMI come papillare Proliferazione di un epiteliano colonnar eluggegetor nel condotto principale o negli accessori dei condotti pancreatici (17). Tale classificazione ha chiarito una serie di termini confusi che hanno ostacolato di conoscere la loro naturale evoluzione ed eseguire valutazioni comparative tra diversi autori (5,6).
Nell’ultimo decennio c’è stata una grande proliferazione di pubblicazioni riferite Alla NPMI e si stima che tra l’8 e il 20% delle resezione pancreatiche nei centri di riferimento sia dovuta a questa entità (22-24). Uno degli aspetti più unici è le loro forme di presentazione, accessorio contrastante, accessorio pancreatico e ramo mista, e quello che è considerato come un infortunio premaligne, in cui la displasia della sequenza è leggermente in situ, il carcinoma invasivo è ben consolidato. Nei pezzi di resezione pancreatica, la neoplasia intraepiteliale pancreatica (Panina) è stata descritta, divisa in turni in vari gradi di cellulare (Panin-1, Panin-2, Panin-3). Le lesioni Panin-1, a sua volta, sono suddivise in Tipo di piano (Panin-1A) e tipo papillario (Panin-1b).
A causa di diverse controversie, diversi consensi e riunioni emessi sono state tenute con le guide di recitazione questo (14-16). Sebbene la nostra serie sia limitata, rappresenta il secondo in letteratura spagnolo ed esprime tutte le lesioni NPMI, dalla sua forma più benigna al carcinoma invasivo. Il profilo demografico è simile ad altre serie, presentandosi a se stessi a sessi relativamente avanzati (70-80 anni); Ciò che è stato in grado di sollevare un atteggiamento “Nihilista” per quanto riguarda il trattamento chirurgico di questi pazienti.
La posizione più frequente nella testa e nel corpo del pancreas (9 dei 15 casi), e i sintomi della presentazione , coincidendo con quelli descritti in altri lavori (3,21-25). Nella nostra serie, i quattro casi con segni di malignità -Carcinoma in situ o carcinoma invasivo – erano quelli che hanno avuto l’affettazione del condotto principale o misto, un fatto che concorda con la maggior parte degli autori (24,26-29).
Un paziente è morto a 66 mesi, da una ripetizione del ganglio di un pancreas adenocarcinoma (caso 3) e che ha presentato il tipo di affettazione mista, modello morfologico con una maggiore incidenza di lesioni invasive nella serie più grande (24 , 26-30). La possibile ricorrenza o il tumore “de novo” pancreatico è apparso a cinque anni e mezzo, che è il tempo stimato (5-7 anni) per completare l’evoluzione dell’adenoma al carcinoma (9,11,12,24,27). In una serie molto simile alla nostra, AdSay et al. Descrivono due pazienti con un NPMI non invasivo morto a 65 mesi della chirurgia della diffusione locale di un pancreas adenocarcinoma (21). In uno dei pazienti e del carcinoma invasivo (Caso 13), c’era una ricorrenza peritoneta a 15 mesi di pancreatectomia totale. Detti resti malati vivi e privi di malattia a 3 anni dopo essere stati riinseritati.
Il coinvolgimento multifocale nel pancreas è stato descritto fino al 30% dei pazienti – con variante “condotto accessorio” – e se ha pubblicato 10 % Ricorrenze in pazienti con NPMI non invasive, sottoposte a pancreatectctomie parziali e margini negativi (31,32). L’adenocarcinoma del pancreas sincrono o metracronico è stato descritto nel 9,2% di 76 pazienti in NPMI (33). Tre dei pazienti hanno presentato l’affettazione del margine di resezione pancreatico con displasia lieve. C’è un accordo in cui non è necessaria una resezione più ampia del pancreas (11,16,15,32,34).
Il resto dei pazienti rimangono privi di malattia con un campo di follow-up tra 6 mesi e otto anni. Non c’era la mortalità operativa e la morbilità del 40% si trova nella gamma riferita da centri accreditati con esperienza nelle resezione pancreatiche (35,36). L’ospedalizzazione media era di 10 giorni, con un intervallo di 5 e 22 giorni. Dell’esperienza pubblicata si conclude che gli NPMIS di affettazione duttale e mista devono essere risuscitati chirurgicamente con la conferma intraoperatoria dell’assenza di invasione della resezione pancreatica, stimato una sopravvivenza dell’80% a cinque anni nel caso di NPMI Invasive e 30 % nei casi con carcinoma invasivo. Nella tabella II presentiamo la recente esperienza di serie di grandi dimensioni (26,31,37-41).
Abbiamo precedentemente commentato che l’incidenza del carcinoma invasivo è più frequente nelle lesioni del condotto principale del Pancreas (75%), che nelle lesioni originarono dei condotti accessori (25%) (15,24,30,42,43). Questi sfondi giustificano lo studio di Salvia et al. in cui hanno effettuato 89 pazienti con accessorio a ramo di tipo NPMI, asintomatico, di dimensioni inferiori a 3,5 cm e normali valori CA-19.9. In detto studio, solo cinque pazienti (6%) hanno sviluppato un aumento di dimensioni e sono stati resetizzati senza segni di malignità (44,45). Risultati simili sono stati pubblicati da Tanno et al., Al follow-up di 81 pazienti per 61 mesi (46).
A seguito di questo studio – grado di prova 3- Linee guida pratiche raccomandano il follow-up di Quelle lesioni che influenzano esclusivamente gli accessori asintomatici dei condotti pancreatici, meno di 3 cm di diametro e che non presentano noduli all’interno (15,44.47,48). L’intervallo di follow-up – CT ed EUS – non dovrebbe superare i sei mesi; A causa della massima incidenza di adenocarcinoma del pancreano metacronico nel resto della ghiandola pancreatica (49,50).
In base alle esperienze precedenti, possiamo concludere che l’NPMI con il suo condotto principale e il tipo misto è debitamente debitore con conferma istologica dell’assenza di invasione di bordi di resezione. Nei casi di NPMI non invasiva, una sopravvivenza è stimata in 5 anni dell’80% e del 30% in quei casi che presentano un carcinoma invasivo. Tabla II riassume l’esperienza della serie più importante.
![]() Gestione per corrispondenza:
Gestione per corrispondenza:
Javier A. Cienfuegos.
Dipartimento di chirurgia generale.
Clinica Università di Navarra.
Avda. Pio XII, 36. 31008 Pamplona, Navarra.
E-mail: [email protected]
ricevuto: 24-11-09. Accettato: 09-02-10.
Bibliografia
1. Garcea G, Ngo SL, Rajesh A, Neal CP, Pollard Ca, Berry DP, et al. Lesioni cistiche del pancreas. Un dilemma diagnostico e di gestione. Pancreatologia 2008; 8: 236-51.
2. Goldsmith JD. Neoplasmi cistica del pancreas. Am J Clin Pathol 2003; 119 (1): S3-S16.
3. Basturk o, Coban I, AdSay NV. Cisti pancreatiche: classificazione patologica, diagnosi differenziale e implicazioni cliniche. Arch Patolo Lab Med 2009; 133: 423-38.
4. Admay NV. Lesioni cistiche del pancreas. Patologia moderna 2007; 20: 571-93.
5. I SEIXO RÍOS S, Lariño nonia J, chiese García J, Lozano León A, Domínguez Muñoz Je. Tumore papillario mucinoso e intraduttale: approccio diagnostico e terapeutico. Gastroentrol Epatol 2008; 31: 92-7.
6. Fernández-Esprach G, Pellisé M, Ginès A.Tumore mucinoso Papilare Intraductal del Páncreas: UNA ENTIDAD MÁS DES DESCONOCIDA QUE INFECUENTE. Gastroenterol Hepatol 2003; 26: 562-70.
7. OHHASHI K, MURAKAMI Y, Takekoshi T. Quattro casi di carcinoma pancreatico segreto mucoso (ABSTR). PROG Diagn Endosc 1982; 20: 348-51.
8. Sessa F, Solcia E, Capella C, BONATO M, Scarpa A, Zamboni G, et al. I tumori papillare intraduttali-mucinosi rappresentano un gruppo distinto di neoplasie pancreatiche: un’indagine sulla differenziazione delle cellule tumorali e le anomalie K-RAS, P53 e C-ERBB-2 in 26 pazienti. Virchows Arch 1994; 425: 357-67.
9. Singh M, Maitra A. Lesioni precursori del cancro pancreatico: patologia molecolare e implicazioni cliniche. Pancreatologia 2007; 7 (1): 9-19.
10. Hruban Rh, Maitra A, Kern SE, Goggins M. Precursori al cancro del pancreas. Gastroenterol Clin North AM 2007; 36: 831-49.
11. Maitra A, Fukushima n, Takaori K, Hruban Rh. Precursori del cancro del pancreas invasivo. Adv anat patolo 2005; 12: 81-91.
12. Maittra A, Hruban Rh. Il cancro del pancreas. Annu rev patol mech dis8 2008; 3: 157-88.
13. Serikawa M, Sasaki T, Fujimoto Y, Kuwahara K, Chayama K. Gestione della neoplasma intraduttale papillare-mucinoso del pancreas: strategia di trattamento basata sulla classificazione morfologica. J Clin Gastroenterolo 2006; 40: 856-62.
14. Furukawa T, Klöppel G, Volkan Adsay N, Albores-Saavedra J, Fukushima N, Horii A, et al. Classificazione di tipi di neoplasma papillare intraduttale-mucinoso del pancreas: uno studio di consenso. Virchows Arch 2005; 447: 794-9.
15. Tanaka M, Chari S, AdSay V, Fernandez-del Castillo C, Falconi M, Shimizu M, et al.; Associazione internazionale di pancreatilogia. Linee guida internazionali del consenso per la gestione di neoplasie mucinose papillare intraduttali e neoplasie cistiche mucinose del pancreas. Pancreatologia 2006; 6: 17-32.
16. Hruban Rh, Takaori K, Klimstra DS, Adsay NV, Albores-Saavedra J, Biankin Av, et al. Un consenso illustrato sulla classificazione della neoplasia intraepiteliale pancreatica e neoplasie mucinose papillare intraduttali. Am J Surg Pathol 2004; 28: 977-87.
17. Kloppel G, Solcia E, Longnecker DS, Capella C, Sobin LH. Digitatura istologica dei tumori del pancreas exocrino. In: Organizzazione mondiale della sanità Classificazione internazionale dei tumori. 2 ° ed. Berlino: Springer; 1996. p. 11-20.
18. Edge Sb, Byrd Dr, Compton EC, FRITZ AG, Greene FL, Trotti A, redattori. Pancreas exocrina ed endocrino. It: AJCC. Manuale di stadiazione del cancro. 7 °. New York: Springer-Verlag; 2010. p. 241-9.
19. Bassi C, Dervenis C, Buturrrini G, Fingerhut A, Yeo C, Izbicki J, et al.; Gruppo di studio internazionale sulla definizione di fistola pancreatica. Postoperatorio Pancreatic Fistula: come definizione internazionale del gruppo di studio (ISGPF). Chirurgia 2005: 138: 8-13.
20. Ohhashi K, Takagi K. ERCP e diagnosi di imaging del cancro del pancreas (ABSTR). Endoscopia 1980; 77: 1493-5.
21. Adsay NV, Conlon KC, Zee Sy, Brennan MF, Klimstra DS. Neoplasmi papillare-mucinosi intraduttili del pancreas: un’analisi di carcinomi in situ e invasivi in 28 pazienti. Cancro 2002; 94: 62-77.
22. RAut CP, KRILY KR, STAERKEL GA, ABBRUZZESSE JL, WOLFF RA, Lee JH, et al. Neoplasmi mucinosi papillari intraduttili del pancreas: effetto dell’invasione e dello stato del margine pancreatico sulla recidiva e la sopravvivenza. Ann Surgor Oncol 2006; 13: 582-94.
23. Ubiña Aznar E, Rivera Irigoin R, Méndez Sánchez I, Fernández Moreno N, García Fernández G, Sánchez Cantos A. Segni endoscopici del tumore misto del pancreas. Rev ESP Enferm Dig 2007; 7: 413-4.
24. Sohn Ta, Yeo CJ, Cameron Jl, Hruban Rh, Fukushima N, Campbell Ka, et al. Neoplasmi mucinosi papillari intraduttili del pancreas: un’esperienza aggiornata. Ann Surg-2004; 239: 788-97.
25. Marín Serrano E, Macías Rodríguez MA, Rendón Inchata P, Pérez Requez J, Guillén Mariscal P, Martín Herrera L. Pancreatica PAPILLARY PAPILLIAR Tumtor Mucinoso. REV ESP Enferm Dig 2005; 11: 836-7.
26. Schnelldorfer T, Sarr mg, nagorney dm, zhang l, smyrk tc, qin r, et al. Esperienza con 208 resezione per neoplasma mucinoso papillare intraduttale del pancreas. Arch Surgar 2008; 143: 639-46.
27. Salvia R, Fernández-del Castillo C, Bassi C, Thayer SP, Falconi M, Mantovani W, et al. Neoplasmi mucinosi papillari intraduttili del condotto principale del pancreas: predittori clinici di malignità e sopravvivenza a lungo termine dopo la resezione. Ann Surg-2004; 239: 678-85.
28. Yang AD, Melstrom LG, Brentrem DJ. Risultati dopo il pancreatectomia per neoplasmi mucinosi papillari intraduttili del pancreas: un’esperienza istituzionale. Chirurgia 2007; 142: 529-34.
29. D’Angelica M, Brennan MF, Suriawinata AA, Klimstra D, Conlon KC. Neoplasmi mucinosi papillari intraduttili del pancreas: un’analisi delle caratteristiche ed dei risultati clinicotici. Ann Surg-2004; 239: 400-8.
30. Rodríguez Jr, Salvia R, Crippa S, Wavershaw Al, Bassi C, Falconi M, et al.Neoplasmi mucinosi papillari intraduttili di ramo-condotto: osservazioni in 145 pazienti che hanno subito la resezione. Gastroenterologia 2007; 133: 72-9.
31. Bianco R, D’Angelica M, Katabi N, Tang L, Klimstra D, Fong Y, et al. Destino del pancreas residuo dopo la resezione della neoplasma non invasiva di neoplasma papillario intraduttale. J Am Coll Surg 2007; 204: 987-93.
32. Chari St, Yadav D, Smyrk TC, Dimagno EP, Miller LJ, Raimondo M, et al. Studio della ricorrenza dopo la resezione chirurgica della neoplasma mucinosa papillare intraduttale del pancreas. Gastroenterologia. 2002; 23: 1500-7.
33. Yamaguchi K, Ohuchida J, Ohtsuka T, Nakano K, Tanaka M. Tumore intraduttivo papillare-mucinoso del pancreas concomitante con carcinoma duttale del pancreas. Pancreatologia 2002; 2: 484-90.
34. Andea A, Sarkar F, AdSay VN. Correlati clinicatilogici della neoplasia intraepiteliale pancreatica: un’analisi comparativa di 82 casi con e 152 casi senza adenocarcinoma ductile pancreatico. Mod patolo 2003; 16: 996-1006.
35. Joseph B, Morton JM, Hernandez-Boussard T, Rubinfeld I, Faraj C, Velanovich V. Rapporto tra volume ospedaliero, sistemi risorse cliniche e mortalità in resezione pancreatica. J Am Coll Surg 2009; 208: 520-7.
36. Van Heek NT, Kuhlmann KF, Scholten RJ, De Castro SM, Busch Or, Van Gulik TM, et al. Volume dell’ospedale e mortalità dopo la resezione pancreatica: una revisione sistematica e una valutazione di intervento nei Paesi Bassi. Ann Surg 2005; 242: 781-8.
37. WADA K, KOZAREK RA, Traverso W. Risultati dopo la resezione di neoplasie mucinose papillare intraduttali invasive e nonvasive del pancreas. Am J Surg 2005; 189: 632-7.
38. RAut CP, KRILY KR, STAERKEL GA, ABBRUZZESSE JL, WOLFF RA, Lee JH, et al. Neoplasmi mucinosi papillari intraduttili del pancreas: effetto dell’invasione e dello stato del margine pancreatico sulla recidiva e la sopravvivenza. Ann Surgor Oncol 2006; 13: 582-94.
39. Nakagohri T, Kinoshita T, Konishi M, Takahashi S, Gotohda N. Risultato chirurgico delle neoplasie mucinose papillare intraduttali del pancreas. Ann Surgor Oncol 2007; 14: 3174-80.
40. Nara S, Shimada K, Kosuge T, Kanai Y, Hiraoka N. Carcinoma di papillario intraduttale minimamente invasivo-mucinoma del pancreas: studio clinicaopatologico di 104 neoplasie di pillola intraduttali-mucinose. AM J Surg Patolo 2008; 32: 243-55.
41. Nagai k, doi r, kida a, kami k, kawaguchi y, ito t, et al. Neoplasmi mucinosi papillari intraduttili del pancreas: caratteristiche clinicaopatologiche e follow-up a lungo termine dopo la resezione. World J Surg 2008; 32: 271-8.
42. Terris B, Ponsot P, Paye F, Hammel P, Sauvanet A, Molas G, et al. I tumori mucinosi papillari intraduttili del pancreas limitati ai condotti secondari mostrano caratteristiche patologiche meno aggressive rispetto a quelle che coinvolgono il condotto pancreatico principale. Am J Surg Pathol 2000; 24: 1372-7.
43. Kobari M, Egawa S, Shibuya K, Shimamura H, Sunamura M, Takeda K, et al. I tumori mucinosi papillari intraduttili del pancreas comprendono 2 sottotipi clinici: differenze nelle caratteristiche cliniche e nella gestione chirurgica. Arch Surgamer 1999; 134: 1131-6.
44. Salvia R, Crippa S, Falconi M, Bassi C, Guarise A, Scarpa A, et al. Neoplasmi mucinosi papillari intraduttili di ramo-condotto del pancreas: utilizzare o non operare? GUT 2007; 56: 1086-90.
45. Ghaneh P, Neoptolemos J. Un nuovo approccio alla gestione di neoplasie pancreatiche mucosianti papillare intraduttali. GUT 2007; 56: 1041-4.
46. Tanno S, Nakano Y, Nishikawa T, Nakamura K, Sasajima J, Minoguchi M, et al. Storia naturale del condotto della filiale Neoplasmi intraduttili papillare-mucinosi del pancreas senza noduli murali: risultati di follow-up a lungo termine. GUT 2008; 57: 339-43.
47. Bassi C, Sarr mg, Lillemoe KD, Reber Ha. Storia naturale dei neoplasmi mucinosi papillari intraduttili (IPMN): prove attuali e implicazioni per la gestione. J gastrointest Surgor 2008; 12: 645-50.
48. Woo sm, ryu jk, lee sh, yoon wj, kim yt, yoon yb. Neoplasmi mucinosi papillari intraduttili di ramo in una serie retrospettiva di 190 pazienti. BR J Surg 2009; 96: 405-11.
49. Tanno S, Nakano Y, Koizumi K, Sugiyama Y, Nakamura K, Sasajima J, et al. Adenocarcinomi ductali pancreatici in pazienti di follow-up a lungo termine con neoplasie mucinose papillari del condotto di ramo. Pancreas 2010; 39: 36-40.
50. Belyaev O, Seeling MH, Muller Ca, Tannapfel A, Schmidt Noi, UHL W. Neoplasmi mucinosi papillari intraduttili del pancreas. J Clin Gastroenterolo 2008; 42: 284-94.