Introduzione
La sclerosi laterale amiotrofica (ELA) ha come caratteristica principale la perdita selettiva dei neuroni dei motori nel cervello, il tronco cerebrale e il midollo spinale1. La maggior parte dei casi ELA è sporadica, ma circa il 10% dei pazienti ha una storia familiare2, e questi pazienti, il 20% ha mutazioni nel Superossido CU2 + / ZN2 + Smutase1 (Sod1) 3. Inoltre, il TDP-43 e la proteina figure / TLS potrebbero essere associati a pazienti con una famiglia e sporadica ELA4.5 e la più alta percentuale di casi è stata collegata a un’espansione intronica di una ripetizione GGGGCC di esasunucleottà nel gene c9orf726 .
Il meccanismo con cui i motori neuroni diventano selettivamente vulnerabili e muoiono in pazienti con ELA è ancora sconosciuto. Il modello di progressione clinico trovato in topi mutati di Sod1 transgenici potrebbe indicare che la malattia si diffonde centrifuga da una regione interessata a un’area adiacente; Pertanto, potrebbe essere ipotizzato che i prodotti tossici generati in un’area diffondiscano la lesione, influenzati da neuroni adiacenti e diffondendo così la malattia e la possibilità è che questi fattori potessero essere veicoli attraverso il fluido cerebrospinale (LCR) 7. Questa ipotesi ha portato diversi ricercatori a sviluppare esperimenti per indagare se l’incubazione in vitro nelle culture dei neuroni e nelle linee neuronali cellulari con il SCF di pazienti con ELA (ELA-LCR) potrebbe causare danni cellulari, che è stato confermato alla maggior parte degli studi7-22 come una recensione , anche se non a tutto23. Il nostro Gruppo ha determinato che ELA-LCC influisce sulla redditività dei neuroni corticali corticali del ratto mantenuti nelle colture primarie; Tuttavia, questo effetto sembra essere mediato da un meccanismo indipendente del glutammato, sebbene l’ELA-LC abbia causato un’elevazione della concentrazione di base della citosi di CA2 + () dei motoneuroni24,25. Questi dati supportano la presenza di fattori tossici nel responsabile ELA-LCR (s) per causare danni da parte dei motoneuroni negli esperimenti in vitro, ma è possibile che non in tutti i pazienti o in tutte le fasi della malattia26. La domanda è se l’ELA-LCR potrebbe anche causare danni cerebrali in vivo. Infatti, l’iniezione infraticata acuta o intracerebrerebrebrerebrebroventricolare di ELA-LR produce cambiamenti nell’attività neuronale, nell’espressione dei recettori del glutammato e dei canali ioni, nella fosforilazione della proteina dopo solo 2 “dopo l’iniezione 29- 29 o indugia alterazioni mitocondri, stress ossidativo o disfunzione lisosomiale30.
Questi esperimenti prodotti con iniezioni puntuali non imitano il corso temporaneo dell’ELA e quindi non lo riproducono. Pertanto, sembrava opportuno effettuare gli esperimenti che descriveremo qui: l’esame dei cambiamenti cerebali istopatologici e funzionali che si verificano dopo l’infusione continua di ELA-LCR per 20 o 43DIAS, ottenuto dall’uso di un minibumb collegato al Ventricolo cerebrale di ratto attraverso una cannula, al fine di determinare le conseguenze dell’esposizione più prolungata di ELA citotossica. Sebbene non troviamo modifiche funzionali simili all’ELA, troviamo una maggiore espressione precoce di molecole di segnaletica neuroprotettiva, una reazione neuroproinfiammatoria precoce accompagnata da microglia attivata e astrogliciosi, nonché sovraespressione delle proteine citoplasmatiche elastica come TDP-43, cystatinac e Transferrin.
Materiale e metodi Hefallarthideo e preparazione ELC citotossica (CELA-LCR)
I campioni LCR sono stati raccolti mediante foratura lombare in 32 pazienti con ALA diagnosticata secondo i criteri diagnostici di EL ESCIARIA31 (25). ** Erano Estratte tra 1,5 e 3CC di ciascun paziente, centrifugata a 1,500 giriose durante 10 minuti e divisa in 4 a 5 aliquoti per scopi di studio. È stato ottenuto un consenso informato di ciascun paziente. Sedici pazienti erano donne; L’età media della serie era di 59 anni al momento dell’estrazione del LCR. Quattro pazienti avevano la famiglia e il resto erano sporadici; 11Cases sono state presentate come forma di aspetto bulbar, 20 casi subì il tipo di colonna vertebrale e un paziente presenta sintomi in entrambi i posti. Dei pazienti con ELA, solo 4 mutazioni presentate nel gene SOD1 e uno era asintomatico, il che significa che il QCS dei pazienti con un meccanismo di genetica SOD1 ha avuto una presenza molto bassa nel gruppo ELA-LCR.Venti campioni (68,7%) hanno mostrato una significativa citotossicità (CELA-LCR) utilizzando il metodo descritto di seguito. I campioni di LCR utilizzati come controlli (NO-ELA LCR) sono stati ottenuti da pazienti affetti da mal di testa o convulsioni e necessarie punture lombare durante un esame di routine. È stato ottenuto anche un consenso informato dei controlli. I campioni del LCR sono rimasti congelati a -80 ° C fino a quando non sono stati utilizzati.
Al fine di dimostrare la citotossicità, le colture delle cellule in vitro del motoneurone, come è stato precedentemente descritto24. Per questi esperimenti, i neuroni sono stati ottenuti dalla moto cerebrale degli embrioni di ratti 20 giorni. Le cellule ottenute sono state seminate a una densità di 105 tacchi / ml in piastre 48-pozzetti contenenti 0,25 ml di supporto neurobasale integrato con B-27 e coltivato per 8-10 giorni. Dopo questo tempo, le colture sono state incubate per 24 ore con il 10% ELA-LCR e la redditività dei neuroni è stata misurata con i saggi MTT32. L’ELA-LCR è riuscito agli animali è stato preparato dalla condivisione delle fiale del LCR che ha esposto effetti citotossici in vitro (almeno il 20% di perdita di neuroni dei motoroni), e la maggior parte del CSF incluso in quel gruppo è stato preso da pazienti con Sporadic Elo. I campioni di controllo del LCR per i campioni non tossici di 3 pazienti sono stati considerati prima dell’amministrazione ICV.
Animali
Gli animali sono stati manipolati secondo i principi della cura degli animali da laboratorio pubblicati dal comitato etico spagnolo (RD 1201/2005) e la direttiva europea 86/609 / CEE; La procedura è stata approvata dal comitato etico per la cura e l’uso di animali di ricerca presso l’ospedale clinico San Carlos de Madrid, in Spagna. Gli adulti maschi del maschio di 28 ratti wistar sono stati ottenuti dai laboratori del fiume Charles. Tutti gli animali sono stati ospitati sotto un ciclo luminoso / scuro 12h con accesso gratuito a cibo e acqua. Sono stati ingabbiati individualmente in condizioni di colonie standard presso l’Ospedale clinico della zona San Carlos. Il gruppo LCR è stato somministrato ai ratti in 4 periodi. Nel primo periodo, 14 ratti tra 1 e 5 mesi di età (media di 3,25 metri) e nel secondo periodo, sono stati iniettati 12 ratti tra 2,5 e 5 mesi (media di 4,1 mesi) sono stati iniettati con il LCR sopra descritto. L’intervallo tra i 4 periodi era di circa 3 mesi.
Gruppi sperimentali
Tre gruppi sperimentali sono stati progettati per questo studio. Il Gruppo1 ha incluso 9 ratti a cui sono stati implementati i minibumboni ICV pieni di pazienti antialatici (NO-ELA-LCR). Group2 è stato composto da 15 ratti impiantati ICV con minibombe di ELA-LCR citotossico (CELA-LCR). Infine, 4 ratti impiantati ICV con minibump pieni di salina fisiologica formati il Gruppo3 (gruppo di trattamento simulato o sham).
Amministrazione intricata di CELA-LCR o No-Ela-LCR
I ratti sono stati anestetizzati con tribrometanolo e Un minibompa osmotico (0,15l / h; Alzet 2006, Alzet Palo Alto, CA, USA) è stato implementato tramite per via sottocutanea. Inserisci le scapole. Prima dell’impianto, i miniboni osmotici sono stati riempiti con la corrispondente preparazione per ogni gruppo sperimentale. I minibump erano attaccati a una cannula per infusione cerebrale (Alzet) attraverso un tubo di polietilene e sono preparati dall’immersione in normale soluzione salina a 37 ° C per 24 ore. Queste procedure sono state effettuate in condizioni sterili. La cannula è stata impiantata nel ventricolo cerebrale laterale destro (-0,5 mm anteropostering, -1.4mm laterale e -3.3mm dorsoventral (coordinate basate su Atlas Paxinos) 33 e sono state fissate al cranio con cemento dentale.
Il volume del serbatoio delle pompe garantisce il pompaggio almeno durante i 42 giorni. Il LCR è stato iniettato intratenatamente a un tasso di 0,15L / h per un periodo di 43, ad eccezione dei ratti sacrificati fino ad oggi 20. Gli animali rimangono nello studio rimasto Fino al giorno 82 fossero impiantati con un tubo di polietilene sigillato meccanicamente per prevenire l’irritazione locale a causa dell’attrazione continua dell’acqua alla pompa.
Valutazioni cliniche
Gli animali sono stati clinicamente testati a meno di un giorno a settimana da una settimana dopo l’intervento chirurgico. Tutti i test sono stati eseguiti con gli esaminatori ciechi al gruppo sperimentale a cui apparteneva ogni ratto. Le valutazioni dello studio includevano la misurazione del peso corporeo, la risposta al test aereo inclinabile e alla scala del motore Matsumoto34. Per misurare il peso corporeo, gli animali sono stati pesati ogni 4 stagioni con una scala digitale.Per il test del piano inclinato, 20 ratti sono stati posizionati lateralmente contro l’albero lungo del piano inclinato per misurare l’angolo massimo in cui potrebbero mantenere la loro posizione nell’aereo per 5 secondi. Per valutare la forza di entrambe le estremità allo stesso modo, gli animali sono stati collocati sull’aereo inclinato con il suo lato destro del corpo contro la parte decrescente della superficie inclinata, quindi con il lato sinistro del corpo che va in discesa. Un punteggio inferiore a 70? Nel test aereo inclinabile, è correlato bene con l’aspetto della debolezza muscolare nei topi transgenici Sod1-G93A34. Per determinare la scala del motore Matsumoto34, la capacità degli animali di raddrizzare se stessi è stata testata entro gli anni ’30 di essere manipolate su entrambi i lati (riflesso del raddrizzamento). I ratti che erano in grado di raddrizzare entrambi i lati sono stati esaminati per la loro capacità di rimanere nella loro gabbia abitativa spontaneamente durante 1min. Se hanno mostrato un piccolo movimento nelle loro gabbie, si trasferirono in un’altra gabbia per attivare la motivazione dell’esplorazione. Se i ratti non hanno mostrato anomalie in base a queste valutazioni, sono state esaminate accuratamente per vedere se avevano alcun deficit funzionali osservabili, come la paralisi delle estremità o dei sintomi della debolezza del muscolo generale nel campo aperto. Un punteggio di 5 significa che l’animale è normale e un punteggio di 0 è un ratto completamente paralizzato. La scala motoria di Matsumoto ha dimostrato di essere correlato con la perdita dei motoruroni spinali in un modello mutatore del mouse transgenico di SOD1-G93A34
Esame elettromiografico
Un elettromiogramma di ratti cella-LCR e ratti non elabricati -Lcr eseguito al giorno 82 da un neurologo esperto in questa tecnica. L’ago è stato inserito nelle estremità anteriori e posteriori e nei muscoli parassiti per cercare di trovare segni di deviazione come attività di inserimento spontanea (onde positive, fibrillazioni o fascicoli). I ratti sono stati sedati con isoflurano all’1,5% in ossigeno di 0,7 l / min durante la procedura.
Sacrificio di animali
A partire da 20, 45 o 82 giorni dopo l’intervento chirurgico i ratti di ciascun gruppo erano profondamente anestetizzati con una dose di Pentobarbital (60 mg / kg) e fentanil (0,3 mg / kg). Innanzitutto, 10 μl di Dye Blue Evans è stato iniettato attraverso un catetere ventricolare per confermare la posizione corretta. Gli animali sono stati sacrificati dalla perfusione intracadiaca con lo 0,9% salino seguito da paraformaldeide al 4% bufferizzato (buffer fosfato 0,1 m). Dopo la perfusione, il cerebrale e il midollo spinale sono stati sezionati, lavati con PB di 0,1 milioni di PB e criocoprotected mediante immersione al 30% di saccarosio e composto PTOR. Il materiale è stato immagazzinato a -80 ° C fino all’uso. Sono stati tagliati le criosciones (50μm) della corteccia del motore e dei segmenti cervicali e lombari del midollo spinale (C5-C6 e L3-L5); I tagli sono stati collocati in una soluzione di crioprotezione contenente glicole etilenico e dimetilfossido e viene utilizzato per la conservazione dei tessuti cerebrali. Dei 9 ratti nel gruppo non Ela-LCR, uno è stato sacrificato fino a 20, 7-45 giorni e un giorno 82. dei 15 ratti nel gruppo Cela-LCR, 4 sono stati macellati fino a 20, 7 a Giorno 45 e 6 al giorno 82 dopo l’impianto. Infine, dei 4 ratti nel gruppo di trattamento simulato, uno è stato sacrificato il 20 °, 2 ai 45 giorni e uno a 82 giorni.
Istochimica e analisi immunofluorescenza
4 I tagli di macchie immunofluorescenze sono stati lavati con PBS, permeabilizzato Con TRITON X-100 dello 0,1% e bloccato con il 10% di siero di capra normale. I seguenti anticorpi primari sono stati quindi applicati durante la notte a 4 ° C: Anti-Periferina (1: 200, Millipore, AB 9282); Anti-S100b (1: 200, Millipore, 04-1054); Anti-caspase-3 (1: 200, Millipore, 04-1090); Acido fibrillare antievein-proteico (GFAP) (1: 500, dakocitomazione, Z0334); Anti-GTL1 (1: 200, Millipore, AB 1783); Anti-GFAP (1: 600, Millipore, MAB360); Anti-TARDBP (1: 200, ABCAM, AB42474); Anti-ubiquitina (1: 100, ABCAM AB7780); anti-transferrin-r (1: 200, ABCAM, AB22391); Anti-Colin Acetiltransferase (1: 100, ABCAM, AB68779); anti-metallionein (1: 100, ABCAM, AB12228); Anti-Stefin (1: 100, ABCAM, AB68290); Anti-MHC II (1: 500, ABCAM, AB6403); Anti-Iba-i (1: 1.000, Wako, dal 019-19741); Anti Panakt (segnalazione cellulare 2920s) e anti fosfoakt (segnalazione cellulare 4060). Le diapositive sono state lavate in PBS 3veciu, e gli anticorpi primari sono stati testati con CY3 (1: 1.000, Jackson) o con anticorpi secondari coniugati Alexa 488, 555 o 647 (1: 500, Invitrogen). Le sezioni di 3veci sono state lavate in PBS, in contrasto con DAPI e montate con il reagente flyorsave (Calbioochm).
Quantificazione dei dati immunoistochimici
Le immagini di fluorescenza sono state acquisite con un microscopio confocale Olympus AF1000.Uno studio immunoistochimico descrittivo è stato effettuato entro i 3 periodi di tempo stabiliti, un’analisi dei cambiamenti osservati in marcatori immunoistochimici nel tempo e il confronto tra i gruppi di controllo ed ELA-LCR. Le analisi istologiche hanno esaminato le aree strettamente correlate a ELA, in particolare la corteccia del motore, la lampadina spinale e i segmenti spinali C5-C6 e L3-L5.
GFAP, IBA1, Caspase-3 e MHC-II
Le immagini confocali erano acquisito con la stessa configurazione e distribuzione della fluorescenza utilizzando il software Confocal Olympus (Olympus Flooview Fv1000). L’analisi quantitativa è stata eseguita utilizzando la versione 1.42Q del software di analisi Imagej (USA). Il numero di celle di immunoistochimica positiva è stata contati da prendendo casualmente 368μm2 di ciascuna area analizzata da 3 a 4 diverse sezioni del cervello coronale.
Periferina, S100b, Panakt, Fosfoakt e misurazione di Metotionone
per misurare S100B, Panakt , Fosfoakt, Metothoneonein e Periferin, è stato seguito una versione modificata del metodo fisico del dissettore descritto da Reed, utilizzando il principio del mattone imparziale del dissettore 3D35. L’analisi è stata effettuata da misurazioni di densità ottica (elaborazione dell’immagine binaria di bianco e nero), ottenendo la percentuale dell’area del campo analizzato. 8 aree per animali a caso sono state selezionate da uno sperimentatore cieco con il software Imagej 1.42 (NIH).
Analisi statistica
I dati sono stati elaborati utilizzando il software Prism GraphPad 5. Sono stati segnalati come valori medi ± standard errore della media (SEM). La grafica dei risultati è stata eseguita utilizzando lo stesso programma. Il criterio per il significato statistico era P
0.05. Tutti gli animali sono sopravvissuti all’impianto ICV dal minibompa osmotico e nessuno di questi ha mostrato segni di infezione (ascesso, edema o scarico purulento nell’impianto); Nessuno ha sofferto convulsioni, aggressività, piloerazione o prostrazione. L’infusione è stata effettuata durante il 20 o 43Dias e il corso temporaneo degli effetti del LCR o dell’infusione di soluzione salina è stato valutato a 20, 45 e 82 giorni dopo l’impianto della pompa mini-emozione. Valutazioni cliniche ed elettronica
Non sono state trovate differenze significative tra i ratti del gruppo Cela-LCR e gli altri gruppi in una qualsiasi delle valutazioni cliniche, incluso il peso corporeo, il comportamento durante il test del piano inclinato e le scale Matsumoto, che erano tutte normali. Per quanto riguarda gli elettromagrammi, le onde acute sono state trovate positive alle estremità posteriori, le estremità anteriori e i muscoli paravertebrali senza potenziale fibrillazione o fascicolazione in 6 dei ratti del Gruppo Cela-LCR all’82DIA dopo l’impianto, che non si è verificato nel I controlli, sebbene non sia stato osservato un modello di denervazione.
Attivazione microglial e espressione di GFAP, S100B, GLT1 e Caspase-3
erano ovviamente lucido reattivo, attivazione microgliale ed espressione di caspasi-3 nella corteccia del motore in I 3 gruppi sperimentali ai 20 giorni dopo l’impianto. Questi risultati potrebbero essere attribuiti a una risposta infiammatoria secondaria all’intervento chirurgico. Tuttavia, i 45 giorni dopo l’intervento chirurgico, vi è stato un aumento significativo della reattività gliale e della risposta microglial in tutte le regioni nel gruppo Cela-LCR (figure 1 e 2). Nei segmenti del midollo spinale degli animali che hanno ricevuto Cela-LCR, è stato osservato che alcuni motorionuroni fossero avvolti da cellule microgliali. La quantificazione immunoistochimica del marker IB-1 ha rivelato alterazioni nella morfologia della microglia, passando da uno stato di riposo caratterizzato da un som microgliale con processi fini e ramificati a una microglia attivata con ramificazioni scarse. I corpi cellulari allungati sono stati osservati con processi lunghi e più spessi ai 20dies dopo l’impianto, mentre le cellule amoeboidi sono state trovate con corpi rotondi con processi corti, spessi e robusti a 45 e 82 giorni, indicando un’attivazione di cellule fagocitiche in prossimità del motore neuroni. Queste cellule esprimono MHC-II, che segna le fasi infiammatorie. Nei gruppi di trattamento simulati e non ela-lcr, l’espressione di MHC-II era 3 volte inferiore a quella osservata nel gruppo Cela-LCR (Figura 3). Un punto interessante è stata la forte espressione di astrociti e la scoperta di astrociti ipertrofici che sovraespressi GFap in prossimità dei neuroni corticali e del midollo spinale. I cambiamenti più pronunciati sono stati osservati ai 45 giorni dopo l’intervento chirurgico. C’era anche un’espressione di MHC-II, ma a livelli inferiori, agli 82 giorni (figura 3). Contrariamente ai dati osservati nel gruppo Cela-LCR, una diminuzione dell’espressione di GFAP e Caspase-3 è stata trovata negli altri 4 gruppi, compresi gli 82 giorni dopo l’intervento chirurgico.Allo stesso modo, è stato osservato un leggero aumento dell’espressione del trasportatore GTL1 Glutamato, che è stato collegato all’ELA e la sua espressione è modificata da ELA-LCR36. GTL1 è stato trovato nelle vicinanze dei motoruroni spinali del gruppo Cela-LCR che correla con l’espressione di GFAP come un indicatore di attivazione di AstroCyte. La sovraespressione di S100B è apparsa a 45 e 82 giorni solo nel gruppo Cela-LCR.
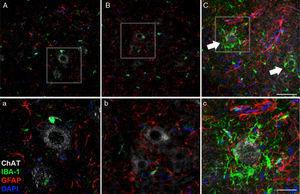
45 giorni dopo la chirurgia, aumento della reattività gliale e risposta microgliale nel gruppo Cela-LCR in tutto Le regioni del cervello studiarono, era evidente. Ad esempio, nel corno precedente (segmento lombare) dei ratti Cella-LCR, troviamo una maggiore espressione di GFAP con abbondanti astrociti ipertrofici (Panel C, C); Inoltre, una maggiore densità delle cellule positive IB-1 è stata identificata con processi ingranditi, spesso in stretta vicinanza a neuroni dei motori o persino circondari questi neuroni (frecce in pannelli c, frecce e dettaglio del pannello c). Questi cambiamenti non sono stati osservati nei gruppi finti e non lcr, in cui le cellule di microglia isolata occasionalmente osservavano vicino ai motoneuroni. Scala: A-C: 60μm; Dettagli AC: 30μm.
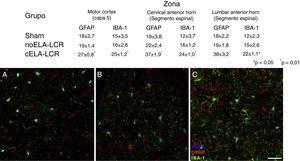
Immagine di microscopia confocale della corteccia del motore, esemplificando i dati presentati in tabelle (diversi momenti del studia) L’aumento delle cellule IB-1 e GFap positivo negli animali del Gruppo Cela-LCR (c) è evidente, rispetto al gruppo Sham (A) e al gruppo Nola-LCR (B). Layer della corteccia del motore 4-6, 45dias dopo l’intervento chirurgico. Scala della barra: 50μm.
AC) Analisi quantitativa dell’espressione di MHC-II in varie regioni del cervello e midollo spinale, nei 3 periodi di tempo studiati. Il gruppo Cela-LCR ha mostrato un aumento significativo del numero di cellule microglial, che è una chiara evidenza di una fase neurinata. D) Immagine rappresentativa delle cellule positive per MHC-II nella regione lombare. Queste cellule sono state osservate anche nelle vicinanze dei motoneuroni. Scala: 50 m; * P0.05; I dati vengono visualizzati come media.
(0,28 MB).
Espressione di Panakt e Fosfoakt
Per capire se l’aumento di Caspase-3 è stato accompagnato da un aumento dell’espressione proteica strettamente correlata alla sopravvivenza e all’apoptosi, Come Fosfoakt e Panakt, è stato condotto la sua quantificazione. Fondamentalmente, il gruppo di trattamento simulato e il gruppo No-Ela-LCR hanno mostrato cambiamenti significativi in tutto lo studio (20, 45 e 82 giorni).Tuttavia, nel gruppo Cela-LCR, sono stati trovati significativi aumenti di Panakt e Fosfoakt a 45 giorni, con un’espressione immunoistochimica che era 3 volte maggiore dei livelli osservati negli altri gruppi, ma a 82 giorni dopo l’intervento chirurgico questi dati erano simili al gruppo di trattamento simulato (figura 4).

expressioni di panakt (Aktpan) e fosfoakt (Aktfosfo) in varie regioni del sistema nervoso centrale del sistema nervoso del 3 gruppi di ratti. A) Immagini di microscopia confocale dell’espressione di Panakt, Fosfoakt e Periferina (perip). B) Analisi del fosfoakt e Panakt di quantificazione delle densità ottiche. Le maggiori espressioni di Aktpan e Fosfoakt sono state osservate a 45 giorni nel gruppo Cela-LCR (A e B). Un fenomeno interessante nel gruppo Cela-LCR era l’aumento dell’espressione della periferica, del fosfoakt e della Panakt nei neuroni (A). Il giorno 82 dopo l’intervento chirurgico, le concentrazioni di AKT (PAN e FOSFO) erano simili a quelle dei gruppi finti e non in ELA-LCR, l’espressione era tornata a livelli simili a quelli osservati negli altri gruppi a 82 giorni di post-chirurgia ( B) Chirurgia. Scala: 50μm.
periferina espressione
periferina gioca un ruolo importante nel trasporto assonale nei neuroni motori spinali. Recentemente la periferica è stata anche associata ad alcune neuropatologie che caratterizzano lo sporadico Elo, dal momento che si trova in Bun Rail37. Pertanto, abbiamo ritenuto rilevante per analizzare le periferiche nei neuroni dei motori, poiché la sua espressione è correlata a Elam sporadici. Tutte le sezioni del gruppo Cela-LCR hanno mostrato i neuroni dei motori con espressione periferica positiva (figure 5 e 6), ma negli animali macellati a 45 giorni, i livelli 4 volte superiore a quelli degli altri gruppi e dei punti analizzati (Fig. . 6). D’altra parte, le cellule con la più immunoreattività della periferica si sono anche co-espresse con Panakt e Fosfoakt. Queste cellule hanno mostrato il pennarello periferico con un modello filamentoso, che è anche osservato in condizioni normali; Tuttavia, nel gruppo Cela-LCR, sono state osservate cellule contenenti il pennarello periferico nelle inclusioni citoplasmatiche che ricordano anche strutture robuste o granulari, che potrebbero innescare la formazione di precipitati o inclusioni di proteine (Fig. 5).
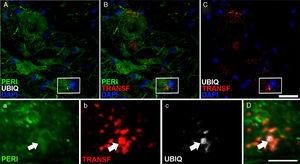
espressione periferina (Peri), ubiquitina (UBIQ) e transferrin dopo l’infusione di Cela- Lcr. A 45 e 82 giorni dopo l’intervento chirurgico gli animali con il trattamento cease-LCR hanno mostrato inclusioni nel citoplasma e avevano un’etichettatura positiva di ubiquitina nei neuroni. Le inclusioni ubiquitina (frecce) sono state collocate con periferiche e, occasionalmente, con transferrin. Scala A-C: 20μm; AC e D: 2μm.
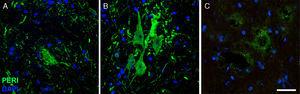
Immagini di immunofluorescenza che mostrano l’espressione della periferica (Peri) durante il corso dello studio nel gruppo Cela-LCR (A: 20Dias, B: 45 giorni, C: 82 giorni). Un aumento temporaneo della periferica è stato osservato nei motoneuroni del giorno del giorno 45, che era tornato alle condizioni basali al giorno 82. L’aumento dell’espressione periferica è stato associato a eventi di lesione della colonna, mentre l’espressione è bassa sotto condizioni normali Scala: 40 μm.
La co-espressione della cistatina c, il transferrin, l’ubiquitina e il TDP-43
nel gruppo Cela-LCR, a 45 e 82 giorni dopo le cellule di chirurgia sono stati osservati con una maggiore espressione di ubiquitina , Transferrin (figura 5) e cistatinac. Questi dati sono strettamente collegati a forme sporadiche di ELA38. D’altra parte, è stato osservato che c’era una traslocazione di TDP-43 nel citoplasma dei motoneuroni (Fig. 7). È interessante notare che l’analisi immunoistochimica mediante la microscopia confocale ha rivelato inclusioni di TDP-43, ubiquitin e cistitinac, e queste proteine sono state collocate nel citoplasma dei motoneuroni. L’aumento di queste inclusioni a 82 giorni è stato accompagnato da una diminuzione dell’espressione periferica (Fig. 6).
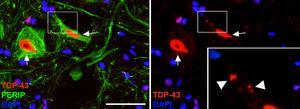
Immagini in cui si osserva che gli animali trattati con Cela-LCR hanno mostrato inclusioni citoplasmatiche di TDP-43 Nei neuroni del midollo spinale (frecce). In dettaglio, vengono osservate inclusioni (teste della freccia). Scala: 40μm.
metotionioni
Poiché alcuni studi hanno suggerito che l’omeostasi di rame e zinco potrebbe contribuire alla patogenesi dell’ELA, è stata studiata l’espressione di metaltioneina39.40. L’espressione dei metotionici era legata al corso temporaneo dei cambiamenti dopo l’intervento chirurgico (45 e 82 giorni) e si è verificato solo nel gruppo Cela-LCR, in cui è stato osservato nei neuroni del motore che ha co-espresso ubiquitina e transferrin. L’aumento del S100b misurato a 45 e 85 giorni dopo l’intervento chirurgico era strettamente correlato all’aumento delle periferiche in prossimità dei motoneuroni. Le cellule che esprimono S100B corrispondevano al fenotipo degli astrociti (GFAP +) dei neutrofili adiacenti al motoneurone. Gli astrociti che esprimono S100B sono strettamente correlati al saldo di calcio, zinco e rame. S100B è una proteina vincolante del calcio espressa esclusivamente da cellule di glial.
Discussione
Lo studio attuale mira a determinare le conseguenze dell’Amministrazione sostenuta ELA-LCR nei ratti per comprendere gli effetti che potrebbero verificarsi in pazienti che presentano la citotossicità nel loro Quic-csf. Ciò dimostra che l’infusione ICV sostenuta di Cela-LCR nei ratti produce cambiamenti cytohistochimici nel midollo cerebrale e spinale che assomiglia a quelli trovati in pazienti con ELA sporadica. Queste modifiche non sono state osservate nei ratti infusi con soluzione salina o negli animali infusi con No-Ela-LCR. L’infusione è stata eseguita durante 20 o 43DIA e tessuti sono stati analizzati a 20, 45 e 82 giorni dopo l’impianto della cannula. Gli animali dello studio che sono stati sacrificati agli 82 giorni hanno ricevuto l’infusione durante i primi 43 anni solo.
Le relative cambiamenti nelle cellule a 45 giorni sono state un’attivazione microgliata seguita da astrogliosi. L’attivazione e la proliferazione della microglia prima dell’emergenza dei segni clinici sono prodotti anche in pazienti con ELA41, così come i topi transgenici Sod1-G93A42. Inoltre, in topi transgenici ELA la microglia attivata appare prima dell’aspetto della neuronale perdita43. Ciò è mantenuto in linea con l’osservazione che la ridotta espressione di Sod1-G93a nelle cellule microglial rallenta la progressione della malattia e prolungare la sopravvivenza44. Al contrario, le cellule microglial che esprimono Aumento di Sod1-G93A Aumento della neurotossicità e aumento della produzione di citochine, NO e MCP-1 dopo l’attivazione in vitro45. Queste scoperte supportano l’idea che l’attivazione della microglia può svolgere un ruolo rilevante nello sviluppo di ELA46.47. A 45dies dopo l’impianto (43 giorni di infusione con ELA-LCR) troviamo le cellule di Microglia nelle vicinanze con i neuroni del midollo spinale.Queste cellule hanno mostrato la tipica morfologia dell’attivazione concomitante con maggiore espressione di MHC-II, che è considerata un marker della risposta infiammatoria dipendente dalla Complement4.49. L’astrogliosi è chiaramente presente, anche se il suo coinvolgimento nella patogenesi dell’ELA è ancora sconosciuto e se appare prima o dopo l’attivazione microglial. Un’altra scoperta notevole è stata la sovraespressione di S100B negli astrociti a 45 e 82 giorni. Questa proteina è stata correlata con la sopravvivenza a ELA50.51 ed è regolata in astrociti e neuroni motori del midollo spinale nei pazienti52, così come nei ratti infusi durante 48 ore con ELA-LCR53. Gli astrociti con inclusioni sono presenti anche nei mouse mutanti Sod154. Allo stesso modo, è stato osservato che l’astrogliosi e la sovraespressione del GFAP apparivano dopo l’attivazione della microglia. Questo potrebbe sostenere l’idea di un meccanismo di neuroinfiammazione come evento iniziale nella patogenesi della malattia.
Negli ultimi anni, l’enfasi è stata collocata sulla traslocazione citoplasmatica di TDP-43, una proteina codificata da Il gene le cui mutazioni TARDBP sono state associate a ELA4. Abbiamo osservato che TDP-43 si trova nelle inclusioni ubiquitina nello sporadico Elo, ma non nei casi SOD1 mutati. La presenza citosolica del TDP-43, collocata con ubiquitina, su 45 e 82 giorni nel Gruppo Cela-LCR supporta l’idea che tali modifiche siano correlate all’ELA sporadica. Ciò è rafforzato dai nostri risultati che i primi cambiamenti nei motoroni neuroni includevano la sovraespressione di cistitatinac, transferrin e periferica, 3 proteine che sono strettamente collegate ai corpi Buni nell’ELA37,55,56 sporadic. Infatti, le mutazioni periferiche sono già state associate allo sporadico ELA57.
Un’altra variabile che è stata valutata era il percorso di segnalazione PI3K / AKT relativo alla survibria cellulare58. Abbiamo trovato un aumento dell’espressione di Panakt e Fosfoakt al giorno 45 nei ratti trattati con Cela-LCR. Questa è stata una scoperta interessante considerando che periferina è anche un substrato PI3K. Vale la pena notare che l’aumento dell’espressione PI3K, ma non Akt, è stato trovato nel midollo spinale dei pazienti con ELA59. Tuttavia, l’aumento del Fosfoakt è stato osservato in midoi spinali di topi SOD1-G93A nella fase asintomatica60. D’altra parte, gli studi in vitro indicano che PI3K / AKT è alterato in celle da ratti mutati Sod1-G93A61. Pertanto, la periferica e il percorso PI3K / AKT potrebbero aumentare come risposta allo stress cellulare causato da CELA-LCR. L’aumento di Caspase-3 come segno di apoptosi in questi ratti è compatibile con questo punto di vista e con la scoperta dei motoruroni apoptotici a ELA62-64.
L’ultima ricerca che dovrebbe essere menzionata L’aumento dell’espressione della metallioneta nei ratti infusi a Cela-LCR. Ciò è conforme a livelli più elevati di livelli più elevati di metallionioni in topi mutati Sod165-67; Un aumento simile della sua mRNA è stato anche descritto in questi MICE68. In coerenza con questo, è l’osservazione che nei topi provengono dall’incrocio dei roditori con ELA e carente di metallionena, la progressione della malattia68 è accelerata e che la sua più grande espressione rappresenta una migliore. Al contrario, l’espressione di Metotionena e la sua mRNA è diminuita in ELA70. I metotionici sono proteine di legame CU / ZN che riducono i prodotti reattivi dell’ossigeno e contrastano la tossicità del metallo. In questo contesto, la ricerca di un’espressione di maggiore metallionetina potrebbe significare che una reazione neuroprotettiva è sviluppata in risposta all’infusione cronica di Cela-LCR nel ratto; Ciò è mantenuto in linea con la ricerca, maggiore espressione di metallionein nei motoneuroni del midollo spinale dei topi mutati con ELA, che cerca di evitare la perdita dei neuroni e inibisce la progressione della malattia71.
I risultati istopatologici descritti sono compatibili con l’ipotesi che il csf citotossicità nei ratti, settimane indotte di infusione di ICV prolungata di Cela-LCR, produce cambiamenti in un midollo spinale e midollo spinale simile a quelle delle forme sporadiche ELA. Il nostro studio mostra alcune limitazioni. Innanzitutto, i sintomi clinici sono assenti nei 3 periodi studiati (20, 45 e 82 giorni). In topi SOD1-G93A-ELA, i primi sintomi clinici appaiono a 90-100 giorni dall’età72, ma i roditori con altre mutazioni possono iniziare a mostrare sintomi clinici più tardi. Sono state osservate anomalie precoci, come la frammentazione di Golgi all’età dell’età73; Sembra anche possibile che i sottili cambiamenti avvengano prima di quell’età74. Nei topi con mutazioni Sod1, le prime alterazioni appaiono nel Cord38 spinale cervicale.Anche i cambiamenti sono stati osservati nel midollo spinale cervicale e lombare simile a quelli osservati nella corteccia del motore cerebrale, che indica che l’effetto dannoso del Cela-LCR infuso nel ventricolo cerebrale si era diffuso distalmente al midollo spinale. Questa osservazione è compatibile con l’ipotesi che la progressione della malattia potrebbe essere mediata in parte attraverso il CSF. In secondo luogo, diversi marcatori proteici sono stati ancora rilevati che sono sovraespressi a 45Dias, anche se in concentrazioni minori, a 82DIA (cioè, periferico, GFAP, Panakt e Fosfoakt); In altri è sovraespresso allo stesso modo a 45 e 82Dias (cioè cistatina, transferrina, ubiquitina e traslocazione TDP-43), anche se con la limitazione che le dimensioni del campione dei gruppi di studio non erano simili e il numero di ratti dei gruppi di controllo era basso . Tuttavia, l’espressione anormale di queste proteine nel gruppo Cela-LCR è chiaro ei diversi risultati nei gruppi di controllo confermano che le modifiche non sono dovute a manufatti del metodo. Terzo, Cela-LCR è stato infuso da ICV per 43DIAS, che era il termine massimo per il volume del minibompa. Nonostante il fatto che Cela-LCR non sia stato amministrato tra il giorno 43 e il giorno 82, i neuroni dei motori apoptotici sono stati osservati solo negli animali esaminati nel Giorno 82. Ciò suggerisce che il processo dannoso potrebbe rimanere attivo dopo il giorno 43, e quindi sembra possibile che l’estensione dell’infusione di Cela-LCR oltre 43DIA e / o il prossimo corso temporaneo della malattia oltre 85 giorni potesse rivelare le manifestazioni cliniche di A motoneurone simile a quelli delle forme sporadici di ela.
In conclusione, questo studio presenta le prime conseguenze della citotossicità LCR-ELA dopo settimane di infusione ICV sostenuta con il QCS dei pazienti con ELA, che era stato precedentemente stato Provato che mostravano effetti citotossici in una cultura primaria dei neuroni dei motori. A 45 e 82 giorni dopo l’inizio dell’infusione, la corteccia del motore, il talloam e il midollo spinale cervicale-lombare hanno mostrato diversi cambiamenti nei marcatori tipici della malattia di ela elastici. Questi risultati possono migliorare la nostra comprensione della patogenesi e dell’evoluzione dell’ELA e aiutano a trovare nuovi obiettivi terapeutici utili per lo sviluppo di nuovi composti che ritardano o addirittura arrestano la progressione della malattia.
Finanziamento
Questo studio è stato supportato da questo studio da quattro sovvenzioni concesse a JMG di Mutua Ma Madrileña, in Spagna, nel 2008 e nel 2009. È stato inoltre sostenuto dalle seguenti sovvenzioni concesse a AGG da istituzioni spagnole: 1) NDE07 / 09, Laín Entralgo Agency, Comunità di Madrid; 2) Eugenio Rodríguez Fundación Pascual; 3) Fondazione Cien, Carlosii Institute of Health; 4) Renevas-RetCs-RD06-026, Instituto Carlosiii; 5) Saf 2010 a 21795, Ministero dell’Economia e della Competitività, Spagna e 6) Mat2011-28791-C03.
Conflitto di interessi
Gli autori dichiarano che non ci sono conflitti di interesse.
Ringraziamenti
Gli autori vogliono ringraziare la collaborazione di Pablo González e M. Cruz Rodríguez per il coordinamento delle procedure di assistenza agli animali e della Fondazione Teófilo Hernando per il suo continuo supporto.