In antichità, c’era una grande controversia tra gli studiosi della fisica rispetto alla composizione essenziale di tutta la questione che hanno osservato. In questo contesto, alcuni filosofi dell’antica Grecia hanno sollevato che ogni forma di materia era composta da particelle che costituivano tale sostanza: un pezzo di carta potrebbe essere diviso quasi innumerevoli volte fino a quando non si decompose nelle particelle di carta primordiale; Un pezzo di osso sarebbe composto da particelle d’osso primordiali; L’acqua di mare sarebbe costituita da migliaia di piccole particelle di acqua di mare. Tali particelle elementari sono state chiamate “homeomerias” e rappresentavano l’idea incipiente che le cose materiali erano composte da minuscoli mattoni eterni, idea che si evolverebbe più tardi nel concetto di “atomo”. Infatti, la parola “atomo” è stata ugualmente coniata dai filosofi greci (attribuendo il merito soprattutto al democrito e al suo approccio “cosa succederebbe se ai grani di sabbia, che provengono da frammentarsi sulle rocce, sono ancora frammentato?”) , per designare le particelle “indivisibili” e “indistruttibili” che hanno costruito tutto ciò che vediamo.
Al momento, sappiamo che, anzi, la questione che conosciamo è costituita da unità che continuiamo a chiamare gli atomi. Tuttavia, a differenza della concezione originale, abbiamo prove sufficienti per affermare che gli atomi non appartengono a un numero illimitato di sostanze: non ci sono ossa, carne o atomi d’acqua. Tutte queste sostanze complesse sorgono, infatti, dalla combinazione di un certo numero di specie chimiche pure che conosciamo come “elementi chimici”, che raccogliamo nel modello della tabella periodica, ognuna delle quali è costituita da un tipo specifico di atomo. Gli atomi dei diversi elementi chimici si combinano tra loro di dare origine a tutte le sostanze che esistono e, in aggiunta, quelle che danno origine alle reazioni chimiche avvengono. Per atomo capiamo, quindi, alla più piccola unità di materia con La propria identità e questo è in grado di partecipare a una reazione.
D’altra parte, sappiamo anche oggi che gli atomi sono divisibili in unità minori sappiamo, nel suo insieme, come “particelle subatomiche”. C’è una notevole quantità di particelle subatomiche e non tutte fanno parte del soggetto, ma agli atomi abbiamo una struttura molto definita: un nucleo costituito da un conglomerato di particelle con carica positiva (protoni) e carico neutro (neutroni) nel numero variabile e una crosta di particelle con carica negativa (elettroni). Le accuse positive compensano i carichi negativi, in modo che, agli atomi neutri, la cosa normale è che vi sia lo stesso numero di protoni come elettrone.
Il numero di protoni è dato dal “numero atomico” , Che identifica l’elemento chimico che è. Ad esempio: l’atomo con un protone nel suo nucleo è dall’elemento “idrogeno”; L’atomo con due protoni, di “elio”; l’atomo di tre protoni, “litio”, ecc. Nella tabella periodica, gli elementi sono ordinati da più in basso rispetto a quelli più elevati a seconda del numero atomico (Z). D’altra parte, il numero di massa (A) rappresenta il numero di protoni e neutroni, che sono quelli che concentrano la maggior parte della massa dell’atomo. Tuttavia, il numero enorme di un elemento può variare, in modo che ogni elemento abbia diverse versioni di per sé, ciò che sappiamo come isotopi. Negli isotopi, il numero di neutroni varia, che cambia la massa dell’atomo; Pertanto, molti isotopi sono instabili e decompongono con il passare del tempo, che causa la “radioattività”.
Questa conoscenza è stata il risultato di un accumulo progressivo, durante il XIX secolo e XX, di prove sperimentali che sono state migliorare i modelli atomici che sono stati sviluppati dalla concezione originale dell’atomo. Il modello Thompson ha concepito l’atomo come una solida sfera di caricamento positiva con gli elettroni aggrappati in esso. Era il primo modello che associava i carichi elettrici all’atomo; il precedente uno, quello di Dalton, non lo contemplava. Tuttavia, con gli esperimenti di Rutherford, è stato visto che l’atomo era per lo più spazio vuoto, con carichi positivi in un nucleo circondato da una crosta di elettroni. Bohr ha definito che questi elettroni sono stati distribuiti in diversi livelli di energia, basati su spettri atomici. Con lo sviluppo, nel ventesimo secolo, della teoria quantistica, il modello Atom Bohr è stato modificato fino al Modello attuale, il modello meccanico, influenzato dai contributi degli scienziati come Sommerfield, Schrödinger, Broglie o Planck.
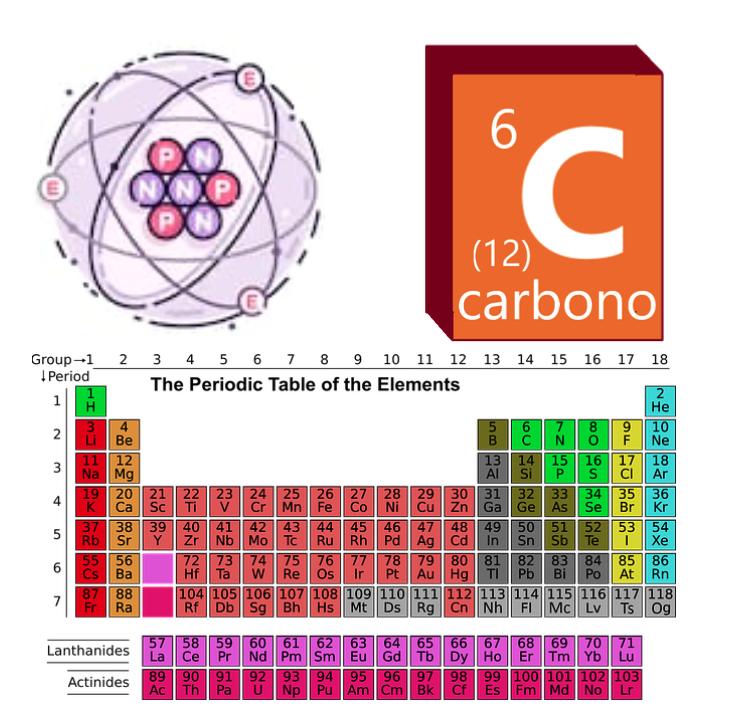
Gli atomi non sono così come sono solitamente rappresentati, ma non abbiamo davvero molti modi migliori per attirarli comprensibilmente.Pertanto, di solito adottiamo semplici modelli didattici come il modello Rutherford o il modello BOHR, dove possiamo facilmente visualizzare che gli atomi sono costituiti da un numero di protoni, neutroni ed elettroni intuitivamente. Nella tabella periodica, gli atomi sono ordinati in base al loro numero atomico (Z). Il numero di massa può cambiare. Carbon, ad esempio, ha z = 6 e un numero di massa variabile. L’isotopo più comune è il carbonio-12 (a = 12), ma ci sono anche altri isotopi molto comuni, come il carbonio-14 (a = 14), che si disintegra radioattivamente con una certa facilità e viene utilizzato per i resti archeologici di Datream.