Summary: Tre elementi della specifica catena infiammatoria dei pazienti sono stati valutati in emodialisi: LBP; Il-6 e PCR, come indicatori di infiammazione e previsione. IL-6 è un rischio indipendente di rischio di morte nei pazienti con HD, più potente della PCR. Questo profilo migliore come un marker di rischiali di morte dovrebbe essere parzialmente, alla sua minore variabilità e in parte, per aggiungere alla valutazione del rischio di morte cardiovascolare, propria PCR, la valutazione del rischio di morte per infezioni, associata alla malnutrizione. Nella clinica, la PCR dovrebbe continuare ad essere utilizzata come indicatore di infiammazione, perché è più facile la sua misurazione, ma nel lavoro di ricerca dovrebbe essere utilizzato i livelli di 6-6. L’LBP può servire a rilevare l’esposizione di pazienti a endotossine. È ancora vedere se è un indicatore di rischio di morte.
Introduzione
Introduzione
I pazienti con insufficienza renale cronica presentano alterazioni nella risposta immunitaria, Sia specifico che non specifico 1. L’emodialisi può essere considerato immunodeferico 1. L’hemodialysis non risolve la maggior parte di questi disturbi e addirittura aggiunge nuova, aumentando l’esposizione del paziente a materiali bioincoplamibili, endotossine e sostanze come l’acetato liquido della dialisi. Questa situazione è accompagnata da una predominanza di citochine proinfiammatorie sui farmaci antinfiammatori 1,2, quindi alcuni di questi pazienti mantengono una reazione di fase acuta “cronotta”. I reagenti positivi di fase acuta, come la proteina reattiva C e il fibrinogeno, sono spesso aumentati in siero e negativi, come albumina e prealbumina, diminuiti. Questi reagenti di fase acuta sono in grado di prevedere il rischio di morte in questi pazienti, anche dopo aver regolato la mortalità ad altri fattori, come l’età, il sesso, il diabete, ecc. 3-7.
La mortalità dei pazienti con dialisi è più volte maggiore di quella del resto della popolazione, corretta per età e sesso. In questi pazienti, le cause della morte cardiovascolare sono le più frequenti. Questa predominanza della morte della causa cardiovascolare è molto più pronunciata nell’Europa settentrionale e negli Stati Uniti d’America che nell’Europa meridionale. Nel registro spagnolo del trattamento renale sostitutivo del 2002, visitabile su www.senefro.org, il tasso di mortalità dovuto alle cause infettive rappresenta una quantità simile a cardiovascolare. La mortalità infettiva è correlata al deficit immunologico e allo stato nutrizionale di questi pazienti. Un buon fattore predittivo del rischio di morte nell’emodialisi dovrebbe, pertanto, valutare non solo il rischio cardiovascolare ma anche la nutrizione e la quantità e la qualità della dialisi. Questi fattori di rischio cardiovascolare e infezione sono imbrittati nella sindrome descritta nei pazienti in emodialisi 8. La prevenzione di esso deve essere l’obiettivo principale di ridurre l’elevata mortalità dei pazienti in emodialisi.
Il substrato della morte cardiovascolare è Arteriosclerosi, che in questi pazienti è valutata 9.10. L’uremia, da sola, è in grado di aumentare le placche di Ateroma 10. Nell’evoluzione dei piatti di ateroma, dello stress ossidativo, degli angiotensina II e delle citochine proinfiammatorie, come l’influenza IL-6. I radicali di ossigeno attivano e impediscono l’inibizione del fattore nucleare infiammatorio nucleare NF-K-B. Tutti questi meccanismi aterogenetici sono alterati in pazienti con uremia dialisi. D’altra parte, i piatti di ateroma dei pazienti uremici presentano peculiarità poiché è il fatto che siano più frequentemente calcificati. La massima tendenza alle calcificazioni extraosus dei pazienti con dialisi è collegata a questo processo, essendo iperfosfatemia uno dei suoi principali fattori di condizionamento 3,10-15.
I pazienti con dialisi hanno fattori di rischio per subire eventi cardiovascolari comuni al generale Popolazione: ipertensione arteriosa; Dislipemia; fumare; Obesità, sedentario. Tutti devono essere prevenuti e trattati, tenendo conto delle peculiarità di questi pazienti. Inoltre, i pazienti uremici della dialisi presentano fattori di rischio specifici, dipendenti dall’uremia e da altri della tecnica del dialisi. Abbiamo menzionato i sbatizzi esistenti tra agenti ossidanti e antiossidanti, citochine proinfiammatorie e citochine antinfiammatorie, angiotensina II, esposizione a sostanze tossiche, come clorammine, o esposizione, in alte concentrazioni, sostanze come acetiche nell’emodiali e al glucosio nella dialisi peritoneale . La maggiore esposizione a sostanze pirogeniche, in grado di stimolare le cellule di presentatore di antigene, tra cui si distinguono endotossine, meritano un commento separato.Queste sostanze non possono solo venire dal fluido di dialisi 16,17, ma anche di infezioni cliniche e subcliniche o passare dall’intestino attraverso una barriera intestinale alterata. La sua capacità di stimolare i monociti e causare l’infiammazione è enorme, soprattutto, quando ci sono altri stimoli o adiuvanti. La ritenzione di sostanze ureneiche difficili da eliminare con dialisi convenzionale come il DMA asimmetrico (dimetil-l-arginina) o il fattore D del complemento, è un altro fattore da prendere in considerazione 18.19. Tutti questi fattori specifici devono essere trattati o eliminati. Non c’è una soluzione singola in quanto non è il recupero della funzione di integrum renale.
Tra i trigger di infiammazione specifici nei pazienti affetti da hemodialysis evidenzia la membrana del dializzatore e la sua capacità di stimolare direttamente o attraverso l’attivazione del complemento ai monociti, ha aumentato la produzione di citochine. Il comportamento delle membrane di emodialisi in questo aspetto è molto variabile. Alcuni sono chiaramente più biocompatibili di altri. D’altra parte, la presenza di sostanze pirogeniche e acetato nella LD sono altri due stimoli dei monociti 20-22. La presenza concomitante dei tre è il più grande stimolo per l’infiammazione specifica dell’emodialisi.
dialisi Liquido come induttore di infiammazione:
Dialisi Liquid (LD) È uno di gli elementi fondamentali del trattamento con emodialisi. Anche i problemi come amiloidosi dializzata creduti fondamentalmente legati alla membrana del dialyzer è stato anche dipendente dalla purezza degli stessi 23,24. Pertanto, le unità di emodialisi (HD) che hanno migliorato il problema della contaminazione batterica di LD e del suo livello di endotossine (ET) riescono a ridurre radicalmente l’incidenza della sindrome del tunnel carpale 23,24. La malnutrizione e l’arteriosclerosi sono altri aspetti relativi alla purezza di LD 3.25. La sindrome “MIA”, la malnutrizione, l’infiammazione e l’arteriosclerosi, sarebbero mediate da citochine (CQ) e molecole di adesione e avrebbero avuto nell’endotoxemia uno dei suoi trigger principali.
Il liquido dialisi (LD) è importante quanto il dialeiling o il monitor HD. Inoltre, questi tre elementi interagiscono l’uno con l’altro. Ad esempio, è inutile utilizzare un dializzatore con una membrana molto biocompatibile e un’elevata permeabilità se abbiamo un LD contaminato, con un gran numero di pirogeni. Il dializzatore e la macchina sono garantiti da case commerciali, responsabili della loro qualità e di rispettare le regole in questo senso. Al contrario, LD è fabbricato nell’unità di dialisi, al momento, senza la possibilità di controlli di qualità prima del loro uso e indubbiamente sotto la responsabilità del medico curante. Per tutto quanto sopra, credo che la qualità del LD sia attualmente uno degli argomenti più importanti e difficili per il personale sanitario di un’unità di dialisi.
Endotossine nel liquido di dialisi (sostanze induttive della produzione di citochine da monociti)
Il paziente uremico nel trattamento con emodialisi è sottoposto a uno stato infiammatorio cronico 4 -6 Questa situazione è collegata ad alcuni dei fattori che condiziona la loro elevata mortalità e la scarsa qualità della vita, e tra cui includono arteriosclerosi accelerata, malnutrizione, anemia, stress ossidativo e amiloidosi dialutica 2-6, 23-30. In effetti, attualmente, l’arteriosclerosi, la malnutrizione e l’infiammazione dovrebbero essere concepite come tre espressioni dello stesso processo.
Il processo infiammatorio è mediato da citochine prodotte dallo stimolo della cellula monocitata 4-6. Nei pazienti in HD questa stimolazione è multifattoriale, endotossine e altre sostanze batteriche 31. L’origine di questa endotossynemia è multipla. Da un lato, le infezioni ripetute intervengono, alcune cronache, che sono sottoposte a questi pazienti, come quelle dipendenti dall’accesso vascolare o da una traccia urinaria. D’altra parte, da alcuni anni fa, si è verificato il ruolo di endotossine che vanno al sangue dal liquido di dialisi e che sono prodotti dalla contaminazione batterica dei suoi componenti.
Siamo continuamente esposti a ETS e da quando siamo nati, ogni processo infettivo che soffriamo è una nuova esposizione. Infatti, se nella normale popolazione IGG e IGM anti-et anticorpi verrebbero osservato come i loro livelli aumentano dalla nascita per stabilizzare circa 16 anni di età. Concentrandosi sui pazienti in emodialisi, è stato dimostrato che ETS può entrare nel sangue attraverso il dializzatore.Questo passaggio dipende non solo dalla quantità di ET ma anche della sua qualità e sebbene il trasporto sia principalmente effettuato da retrofiltro-20, quelli del peso molecolare di piccole dimensioni possono anche passare per il backhi. Gli ETS possono passare attraverso qualsiasi tipo di membrana di emodialisi, sebbene sia stato dimostrato che con elevate membrane di permeabilità, la retrofiltrazione è più comune e le reazioni pirogeni sono più frequenti che con i minimi. Ci sono membrane di dialisi con capacità adsorbiera e, come polisulfone e poliammide, che possono ridurre il suo passaggio 17.
Una volta nel sangue, gli ET sono in grado di attivare i monociti e indurre la formazione del CQ. Questa attivazione monocita non è lineare e fattori diversi che possono aumentare o diminuire la produzione CQ sono coinvolti. È un processo multifattoriale, in cui la quantità e il tipo di tossina influenzano il tipo di membrana, diversi fattori plasmatici e l’azione concomitante di altri sistemi di attivazione dei monociti e sistemi di inattivazione 21. È noto che la presenza di proteine o sangue intero è un Fattore migliorato di questo processo di attivazione e attualmente, almeno due proteine, un trasportatore (LBP, la proteina legante di trasportatore) e un altro con capacità di permeabilità (BPI), sono necessari per questo processo da svolgere 32. La presenza concomitante di altri stimoli o i segnali sono molto importanti, come l’attivazione del complemento e infine, per complicare ulteriormente questo fenomeno, alcuni cq entreranno in gioco, come il-10 33. Quanto sopra giustifica l’importanza che sia lo stato della nutrizione che il sistema immunitario avere in questo campo
Oltre alle endotossine, ci sono altri agenti in grado di stimolare i monociti. Questi sono quegli elementi bioincolicibili del sistema di dialisi e tra coloro che evidenziano la membrana del dialyzer. Il contatto del sangue con questo produce una serie di reazioni che influenzano la maggior parte dei globuli e delle proteine. In questo processo, l’effetto dell’attivazione del complemento indotto nel grado diverso da membrane di dialisi è molto importante. D’altra parte, non dobbiamo dimenticare che alcune membrane sono capaci di endotossine adsorberi e mediatori che riducono l’effetto bioincompatibile.
Il monocita, come una cellula effettiva, integra i vari stimoli e produce un rilascio cronico di citochine. La conoscenza dei recettori della membrana di queste cellule è arrivata a confermare come le endotossine sono i loro principali stimoli, i recettori cd14 20, ma ci sarebbe la necessità di altri stimoli concomitantenti, come il complemento CD16, in modo che il CQ fosse secreto 34.
CQ e fondamentalmente IL-6 sono in grado di innescare una reazione di fase acuta, la cui principale espressione è il cambiamento della sintesi proteica attraverso il fegato. Alcune delle proteine, come l’albumina e la prealbumina, stanno iniziando a sintetizzare in una quantità inferiore e altri, d’altra parte, aumentano la sua produzione, come con la proteina C-reattiva (PCR) e la sostanza del Siero Amyloide A (SAA) . Sembra che PCR non sarebbe solo un indicatore di fase acuto, ma avrebbe un ruolo di mediatore di infiammazione e ferita vascolare. I livelli di PCR in molti pazienti con emodialisi sono cronicamente aumentati e si riferiscono a alcuni fattori del paziente, come: mortalità, arteriosclerosi, stato nutrizionale e alcune comorbidità che coinvolgono l’infezione da infiammazione. I livelli di PCR con caratteristiche della tecnica dell’emodialisi, come: il ripassore, le endotossine della LD e la sua rimozione da parte dei filtri 6,20.
Per evitare questa situazione infiammatoria, dobbiamo agire a vari livelli: prevenire e trattare contaminazioni batteriche di LD; Rimuovere gli ETS LD con filtri adatti nel circuito idraulico delle macchine HD; Evitare o trattare le infezioni croniche dei pazienti in HD; Utilizzare materiali biocompatibili per evitare stimoli concomitanti di monociti ed eliminare l’acetato, anche a livelli bassi, di LD. Il mantenimento del buon stato nutrizionale nei nostri pazienti in HD, può influenzare una migliore risposta immunitaria. L’azione sul LBP o l’IBP o sui destinatari dei monociti o del CQ, è ancora in fasi di studi molto preliminari.
Una serie di lavori eseguiti nelle unità di dialisi dell’area 1 di Madrid , alcuni di loro in collaborazione con le unità di dialisi italiane coordinate dal Dr. Panichi 20. Esistono tre degli elementi fondamentali nella specifica cascata proinfiammatoria dei pazienti in emodialisi: proteina C-reattiva (PCR); Proteina vincolante di IL-6 e Lipopolisaccaridico (LBP).L’obiettivo di questi studi era di relazionare questi tre mediatori con fattori clinici e biochimici e persino con la mortalità di questi pazienti
La proteina C reattiva come marcatore di mortalità in HD.
Questo studio mira a mettere in relazione la PCR con altri fattori HD e a sua volta, con la prognosi dei pazienti.
In 84 pazienti con 84 HD non selezionati, della nostra unità ospedaliera, è stata eseguita una misurazione basale, a tre mesi E annualmente di PCR e IL6, sono stati seguiti per quattro anni. La PCR è stata determinata da un grande test immunoreattivo, 0.001 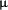 MG /
MG / 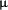 ML, (tecnica laser nefelometria, behring diagnostica), con normale), con normale valori compresi tra 0,1 e 4 mg / l.
ML, (tecnica laser nefelometria, behring diagnostica), con normale), con normale valori compresi tra 0,1 e 4 mg / l.
La PCR è stata sollevata rispetto ai controlli, superiore a 5 mg / l, in 47 dei 84 pazienti e superiore a 20 mg / l in 17 di loro, (n = 84, 15,2 ± 18,9 mg / l). C’era una buona correlazione della PCR con IL6, n = 84, r = 0,65, pigrabilmente, correlata con altri reagenti di fase acuta: Prealbumina, R = -0.47; VGS, R = 0,32 e albumina R = -0.27. In 15 pazienti, la sua elevazione potrebbe essere dovuta alla sofferenza di malattie intercaniche che hanno condizionato l’infiammazione. In 25 pazienti c’era anche una patologia vascolare e la loro PCR era anche maggiore di quella dei pazienti senza malattie intercounter, le differenze pesiste in PCR in base alla membrana dialisi e alla dialisi utilizzate, ma non hanno raggiunto il significato statistico.
La differenza media tra le due determinazioni PCR era di 5 mg / l, molto più bassa in pazienti con valori normali, 1,2 mg / l.
PCR non è stato educato come variabile di distribuzione normale. Né si è comportata secondo gli altri standard di distribuzione. Solo quando la sua trasformazione logaritmica è stata effettuata aveva una distribuzione gaussiana. La correlazione tra due valori consecutivi in ogni paziente era r = 0,95, la correlazione di Pesta è stata mantenuta per due anni perdendo in seguito.
degli 84 pazienti 38 sono morti durante i 4 anni di follow-up. La sopravvivenza dei pazienti con elevati livelli iniziali di PCR era: 79%, 60%, 44% e 35% all’anno, 2 °, 3 ° e 4 ° anno. Nei pazienti con livelli normali era: 95%, 87%, 76% e 64%. (Log rank p = 0,0032). La differenza dei due curve di sopravvivenza è stata stabilita nei primi due anni, il 29%, per rimanere in tale intervallo fino a 4 anni. Lo studio longitudinale per valutare l’effetto della variazione temporanea della PCR sulla sopravvivenza dimostrata, nella coorte studiata, la progressiva diminuzione del suo valore predittivo. L’analisi di Cox ha dato come cofattili predittivi di morte, PCR, P = 0,0001, età p = 0,0011 e creatinina P = 0,026.
In questo studio, è stato concluso, che la PCR è un fattore predittivo indipendente di morte. Mantiene il suo valore predittivo durante i primi due anni dopo la sua determinazione. In molti pazienti, la reazione di fase acuta è intermittente e non continua.
IL-6 come indicatore di mortalità in HD.
IL-6 stimola la sintesi della PCR in il fegato. Nei pazienti in emodialisi, è stato dimostrato che sia PCR che IL-6 hanno un potente valore predittivo della morte 35,36. Ciò che non è noto è se il valore predittivo di IL-6 riflette semplicemente quale PCR, essere più facile da misurare. L’obiettivo di questo studio era di sapere se IL-6 fornisce informazioni prognostiche più o diverse rispetto al PCR fornisce.
Una coorte di 218 pazienti in emodialisi è stata seguita durante una mediana 3,5 anni. La sua età media era di 59,5 anni, 63% di uomini e 18% di diabetici. Durante il follow-up, 75 morti, 41 delle cause cardiovascolari. IL-6 (EIA, RD System Boringher), PCR (metodo modificato di nefelometria ad alta sensibilità, berhing diagnostico, GmbH, Rarburb), albumina sierica, ematocrito, lipidi sierici e IPth sono stati determinati. Un’analisi di regressione di COX è stata utilizzata per esaminare la relazione di IL-6 e PCR e la mortalità.
Risultati: il quartile minore (13,5 PG / ml per IL-6 e > 14.0 mg / l per PCR) è stato 4.52 (Intervallo di confidenza del 95%: 2.26-9.05) per IL6 e 2.41 (1.33-4.37) per PCR. Quando entrambe le variabili sono state incluse nello stesso modello, la stima è stata 4,01 (1,69-9,50) per IL-6 e 1,08 (0,51-2,59) per PCR. Come variabili continue, la relazione tra entrambi e la mortalità diventa lineare dopo la trasformazione logaritmica delle variabili. Per un’unità della deviazione tipica del registro (variabile), il RR era 2.07 (1,50-2,85) per IL-6 e 1,65 (1.20-2.56) per PCR.
Se incluso nello stesso modello, la stima è stata 1.90 (1.28-2,81) per IL-6 e 1.15 (0,80-1,66) per PCR Questi risultati non sono stati modificati sostanzialmente quando è stata esaminata solo la mortalità cardiovascolare. Il fenomeno era ancora più pronunciato dopo la regolazione per tutti i potenziali fattori confondenti.
conclusioni: IL-6 ha un valore predittivo superiore alla PCR per tutte le cause di mortalità e cardiovascolare. Sembra fornire informazioni di pre-fornitura indipendenti e più convenienti rispetto alla PCR. Sono necessari ulteriori studi per determinare se i risultati dipendono dal più piccolo errore di misurazione di IL-6 o della sua variabilità inferiore o se riflette un vero fenomeno biologico.
un’ipotesi per spiegare questi risultati, sarebbe : Il-6 ha effetti sulla nutrizione e sull’immunità, due importanti condizionamento dell’evoluzione delle infezioni, essendo in Spagna una causa di mortalità importante quanto cardiovascolare.
La proteina legante Lipopolisaccaride (LBP) come indicatore di infiammazione in HD.
Il LBP è una proteina da 60 kD sintetizzata nell’epatocita. I suoi livelli plasmatici aumentano in situazioni con esposizione a endotossine (ET). Si unisce agli ETS e li trasferisce al loro recettore monocitico, CD14, migliorando la sua risposta. A causa della sua prima apparizione all’interno della catena infiammatoria potrebbe essere un utile pennarello nella diagnosi e nella prognosi del paziente con complicazioni relative all’esposizione a batteri e endotossine. In questo lavoro, il LBP è stato studiato in pazienti in HD e nella loro relazione con altri fattori considerati coinvolti nella sindrome di risposta infiammatoria sistemica.
Pazienti e metodi: LBP (immunoassay specifico, è stato determinato. Immulite®) , in 220 pazienti non selezionati in HD. Simultaneamente IL-6, PCR, albumina, prealbumina, fibrinogeno, emoglobina (HB), IST e dose di EPO sono stati misurati. Le caratteristiche cliniche di pazienti e emodialisi sono state raccolte. L’età media era di 62,2 ± 14,9 anni. 121 erano uomini e 99 donne. Il tempo medio in HD era di 70 ± 67 mesi.
Risultati: il livello medio del LBP era 14,9 ± 8,8 UG / ml, i valori normali con processo infiammatorio cronico o acuto ( n = 69, p = 0.000), episodi di AVVA (n = 33, p = 0.034), vasculopatia periferica (n = 60, p = 0,04), malattia cardiaca non ischemica cronica (n = 111, p = 0,001) livelli di lbp maggiore di quelli che non lo fanno. Non c’erano differenze nei livelli plasmatici del LBP secondo il sesso, l’esistenza (n = 42) o meno le antiche fistole, che il FAV era autologo (102) o un innesto, che aveva (n = 67) o non un cronico Epatopopatia o che era un corriere (n = 18) o meno di una neoplasma attiva
e non c’erano differenze in base alla macchina (n = 66) o non filtranti di ET. L’LBP è correlato in modo significativo con PCR (P = 0.000), fibrinogeno (P = 0.000), Ferritina (P = 0.033), IL-6 (P = 0,002) e l’IRE (P = 0,001) direttamente e inversamente con albumina (P = 0.000), Prealbumina (P = 0.000), ematocrito (p = 0,019) ed emoglobina (p = 0,041). Il coefficiente di correlazione della PCR con IL-6 (P = 0,07) era inferiore rispetto al LBP. Nell’analisi fattoriaria per passaggi, il LBP è stato incluso nei componenti RFA, ma anche in quelli di anemia e nutrizione.
Conclusione: il LBP è correlato alla RFA, con un maggiore significato IL-6. È anche correlato ai parametri clinici coinvolti in SRIS e pertanto, è un marker di infiammazione nei pazienti in HD. È necessario continuare a rintracciare questi pazienti per diversi anni per valutare se è un buon indicatore di rischio di morte nell’emodialisi.
Evoluzione dei livelli di LBP a seconda dell’uso di un filtro per endotossine nel circuito idraulico delle macchine HD.
In questo lavoro, la modifica ai livelli di pazienti LBP in hemodialysis dopo aver messo i filtri ET nei monitor.
pazienti e metodi: coincidendo con il posizionamento del filtro ET in 56 monitor di pazienti in HD, poliethersulfone (PES) in 17 e Polisolfone (PS) in 34, LBP basali è stato determinato (prima di mettere il filtro) e a 3 mesi del loro posizionamento (immunoassiaggio specifico, immulite®). Il gruppo di controllo, 34 pazienti sono stati formati, rimasero senza un filtro. Allo stesso tempo, il-6, PCR, albumina, prealbumina, fibrinogeno, emoglobina, ferritina e dosi EPO sono stati misurati. Le caratteristiche cliniche di pazienti e emodialisi sono state raccolte. Il Medioevo era di 64 ± 13 anni, 44 erano uomini e 46 donne e il tempo in HD di 69 ± 61 mesi.
Risultati: Durante il follow-up dei pazienti nello studio, il Il livello dell’ET nel pre-ultrafilter LD è aumentato dai livelli inferiori a 0,5 EU / ml al momento basale, a livelli tra 0,5-1 UE / ml a 3 mesi di posizionamento ultrafiltro.
Il LBP tra entrambe le determinazioni aumentato in modo significativo in pazienti senza filtro ET (n = 34, p = 0,03) e rimaneva invariato in cui è stato posizionato.Non c’erano differenze nei livelli del LBP di base tra il gruppo che iniziarono con il filtro PES e PS, ma il LBP a tre mesi era maggiore in coloro che avevano il filtro PES (P = 0,018). Nei pazienti con filtri PS, LBP diminuisce a tre mesi del loro posizionamento (n = 39, p = 0,025), tale diminuzione è a scapito del sottogruppo con dialologie a bassa permeabilità (n = 28, p = 0,049). Quando l’aumento del LBP viene analizzato nel gruppo di controllo (senza filtro) in base alla permeabilità della membrana, è oggettivo che sia solo significativo nel sottogruppo di pazienti con dignizione di coefficienti UF superiori a 15 ml / ora / mmHG ( n = 28; p = 0,049).
Nei 56 pazienti in cui UltraFilter, IL-6 diminuisce in modo significativo, P = 0,001, mentre nel gruppo di controllo non viene modificato.
Conclusione: l’LBP aumenta quando esiste l’esposizione a ET e quindi è un indicatore utile per il monitoraggio del grado di esposizione a ET e altri contaminanti batterici della LD. I filtri ET sono in grado di contrastare parzialmente questo effetto.
Riferimenti:
1.- GIMDT M, Sester M, Sester U, Kaul H, Kohler H. Aspetti molecolari della funzione T-e B-Cell In uremia. Kidney Int 2001, 78: S206-11.
2.- Goicoechea m, Martin J, de Derque P, Quiroga Ja, Ortiz A, Carreño V, caramello C ruolo delle citochine nella risposta all’erythropietin in Pazienti emodialisi. Rene INT 1998 54: 1337-1343.
3.- Zimmermann J, Herrlinger S, Pruy A, Metzger T, Wanner C: Iscrise Insieme rischio cardiovascolare e mortalità in emodialmente. Rene INT 1999: 55: 648-658.
4.- Bárány P., Divino JC., Bergström J.: Alta proteina C-reattiva è un forte predittore di resistenza agli eritropiet in pazienti emodialmente. Am J Kid Dis 1997; 29: 565-568.
5.- haverkate F, Thompson SG, Pype SDM, Gallimore JR, PEPYS MB: produzione di proteine C-reattive e RISD di eventi coronieri in angina stabile e instabile. Lancet 1997; 349: 462-466.
6- Bergström J, Heimbürger O, Lindholm B, Qureshi AR: proteina reattiva C come predittore per l’albumina sierica e la mortalità nell’emodialiisi. GEN AM SOC Neprol 1995; 6: 573-577.
7.- Yeun Jy, Levine Ra, Mantadilok V, Kaysen GA. La proteina reattiva c-reattiva prevede tutta la mortalità a causa e cardiovascolare nei pazienti affetti da emodialisi. Am J. Kidney Dis 2000; 35: 469-476.
8.- Stenvinkel P, Heimburger O, Paultre f et al. Forte associazione tra malnutrizione, infiammabilità e ateroscele in insufficienza renale cronica. Rene int 1999; 55: 1899-1911.
9.- Lindner A, Charra B, Sherrard DJ, Scribner BH. Ateroscelosi accelerata in emodialmente di manutenzione prolungata. N engil j med 1974; 290: 697-701
10.- Kerstin Amann, Christina Ritz, Marcin Adamczak, Eberhard Ritz. Perché la malattia coronarica è così frequente e così devastante? Trapianto di quadrante Nefrol (2003) 18: 631-640.
11.- Oh J, Wunsch R, Turzer M et al. Arteriopatia coronarica e carotide avanzata in giovani adulti con insufficienza renale cronica in insorgenza infantile. Circolazione 2002; 106: 100-105
12.- da Francisco Alm, Pérez García R. Ultrapure Diarreduce e Siede effetto sul risultato dei pazienti. Trapianto Saudita J Kidney RS 2001; 12 (3): 406-412.
13.- Block GA, Hulbert-Shear Te, Levin NW, Port FK. Associazione del fosforo siero e del prodotto di calciumxphosfato con rischio di mortalità nei pazienti con hemodialysis cronici: uno studio nazionale. Am J Kidney Dis 1998; 31: 607-617
14.- Bro S, Bentzon JF, Falk E, Nielsen LB, Olgaard K. K. Guasto renale cronico Migliora Atherosceleros ATIC in topi apolipoproteina-e carenza. Trapianto di quadrante Nefrol 2002; 17: 46A
15.- shoji t, emoto m, tabata t et al. Aterosclerosi avanzata nei pazienti predisontale con insufficienza renale cronica. Rene int 2002; 61: 2187-2192.
16.- Pérez-García R, Rodríguez Benítez P. Perché e come monitorare la contaminazione batterica di Diasate? Trapianto quadrante Nefrol 15: 760-764, 2000.
17.- Pérez-García R., Anaya F., Chisvert J., Valderábano F. Associazione dei dialisi ad alto flusso e contaminazione batterica di Diarate indotta Rilascio cronico di citochine nei pazienti con emodialmente. Trapianto di quadrante Nefrol 11: 2.164-2.166, 1.164-2.166, 1.995.
18.- Deppisch RM, Beck w, Goehl H, Ritz E. Comprime componenti come tossine uremiche e il loro potenziale ruolo dei mediatori di microinfiamm. Rene INT suppL 2001; 78: S271-S277
19.- Kielstein JT, Boger Rh, Bode-Boger SM et al. Marcato aumento di dimetilarginina asimmetrica in pazienti con malattia renale cronica primaria incipiente. J sono soc nephrol 2002; 13: 170-176.
20.- Panichi V, Migliori M, di Pietro S, Metelli Mr, Taccola D, Pérez García R, Palla R, Rindi P, Cristofani R, Tetta C. Plasma C -Reactive proteine nei bandi di hemoodysis: un sondaggio clinico longitudinale cross-compensale e longitudinale. Blood Purif 2000; 18: 30-36.
21.- G. Lonnemann: qualità batteriologica dializzata e la permeabilità delle membrane del dialyzer a pirogeni.Rene int 1993; 43, supponi. 41: 195-200.
22.- Amore A, Coppo R. intolleranza acetato e sintesi di ossido nitrico da cellule endoteliali. J AM SOC Nephrol 1997, 8: 1431-1436.
23.- Baz M, Durand C, Ragon A, Jaber K, Andrieu D, Merzouk T, Purgus R, Olmer M, Reynier JP, Berland Y: Usare l’acqua ultrapura in emodialisi ritarda la sindrome del tunnel carpale. Int J Artif Organs.1991: 14: 681-685.
24.- Schwalbe S, Holzhauer M, Schwalbe J, Galanski M, Koch Km, Floege J: BETA2 Microglobulina Associata Amiloidosi associata: una complicazione a vuoto di hemodialysis a lungo termine? Rene int 1997; 52: 1077-1083.
25.- Kaizu y, kimura m, yoneyama t, miyaji k, hibi i, kumagai h: interleukin-6 può mediare la malnutrizione in pazienti cronici hemodialysis.am J Kidney DIS 1998 ; 31: 93-100.
26.- Kleophas w, Hasstert B, Backus G, Hilgers P, Westhoff A, Van Endert G Esperienza a lungo termine con un fluido di dialisi individuale ultrapuro con una macchina da bagno Quadrante Nefrol Trasplante 1998; 13: 3118-3125.
27.- Gunnell J, Yeun Jy, Depnerd Ta, Kaysen GA. La risposta acuta prevede la resistenza all’ereritropoietina in emodialisi e pazienti con dialisi peritoneale. AM J Kidney DIS 1999; 33: 63-72.
28.- Sitter T, Bergner A, Schiffl H: induzione di citochine correlata a dializzata e risposta all’erythropotina umana ricombinante nei pazienti affetti da emodialisi. Trapianto quadrante Nefrol 2000, 15: 1207-1211.
29.- De Leo fr, Renee J, McCormick S, Nakamura M, Apicella M, Weiss JP: Neutrofili esposti a batteri lipopolisachescharide upregolato Assemblea di Nadph Oxidasi: J Clin Invest 1998; 101: 455-463.
30.- Morena M, Cristol JP, ceread B. Perché i pazienti emodialisi sono in uno stato prooxidante? Cosa si potrebbe fare per correggere lo squilibrio Pro / Antiossidante. Sangue Purif 2000; 18: 191-199.
31.- Pertosa G., Gesualdo L., BottaloCo D., Schena FP.: Endotossine modulare il fattore necrosi cronico del tumore del tumore alfa ANG Interleukin 6 rilascio di monociti uramici . Trapianto di quadrante nefrolo 1995; 10: 328-333.
32.- Sundaram S, re Aj, Pereira BJ. Proteine leganti-leganti di lipopolisaccaride e fattore battericida / permeabilità-aumento del fattore durante emodialisi: determinanti clinici e ruolo di diverse membrane. J Am SOC Nephrol 1997; 8: 463-470.
33.- Girndt M, Köhler H, Schiedhelm-Weick E, Schlaak JF, Büschenfelde KHM, Fleischer B. Produzione di Interleukin-6, fattore di necrosi tumorale A e Interleukin-10 In vitro correla con il difetto immunitaria clinico nei pazienti con emodialisi cronici. Rene int 1995; 47: 559-565.
34.- Scherberich Je, Nockher WA: fenotipi di monociti del sangue e recettore solubile endotossina CD14 in malattie infiammatorie sistemiche e pazienti con insufficienza renale cronica. Trapianto di quadrante Nephrol 2000; 15: 574-577.
35.- Pecoits-filho r, Bárány P, Lindholm B, Heimbürger O, Stenvinkel P. Interleukin-6 è un predittore indipendente di mortalità nei pazienti che iniziano il trattamento di diálisis. Trapianto di quadrante Nefrol 2002; 17: 1684-1688.
36.- Bologa RM, Levine DM, Parker Ts, Cheligh Js, Serour D, Stenzel KH, Rubin al. Interleukin-6 prevede ipoalbuminemia, ipocholesterolemia e mortalità nei pazienti affetti da emodialisi. Am J Kidney Dis 1998; 32: 117-114.