cardioprotezione mediato da canali del potassio dipendente da ATP.
DR Fernando Zeledón SA, DR Orlando Morales Ma, Dr. Edgar Méndez JB, DR Eduardo Induni LC, il dottor Oswaldo Gutiérrez SD.
sintesi
i mitocondri ha un ruolo centrale nel mantenimento del metabolismo cardiomicito durante i fenomeni di ischemia e di riperfusione. Questa “cardioprotezione” sembra essere legato all’apertura dei canali del potassio ATP-dipendenti nella membrana mitocondriale, che evita l’apertura del poro di transizione di permeabilità (MPTP), sovraccarico di calcio e la perdita di volume di spazio intermembrane mitocondriale, prevenire la morte cellulare mediante necrosi o apoptosi .
Diversi studi clinici sostengono l’uso di farmaci promettenti che aprono questi canali del potassio e che potrebbe essere una nuova arma terapeutica contro la malattia ischemica e le sue conseguenze
Parole chiave:. precondizionamento ischemico; canali di potassio mitocondriali e sarcolemici; Sovraccarico di calcio; lo stress ossidativo; apoptosi, poro permeabilità transizione.
abstract
mitocondriale ATP-sensibili canali del potassio svolgono un ruolo importante prevenire la morte delle cellule necrotiche e apoptsis durante ischamia / riperfusione fenomeni per mezzo di prevenzione permeabilità mitocondriale Transition Pore (MPTP) Apertura, sovraccarico intracellulare di calcio e perdita di spazio intermembrane mitocondriale.
non v’è evidenza clinica di effetti benefici di un gruppo di bevande chiamato canali del potassio che colud essere un nuovo strumento terapeutico contro ischanics cardiache Malattie e . la sua considence
Parole chiave:. ischemica precondizionamento SarColemic e mitocondriale potassio canali, calcio di sovraccarico, stress ossidativo, apoptosi, mitocondriale permeabilità transizione Pore
Introduzione
Ad oggi , il trattamento della malattia cardiaca dell’origine ischemica si è concentrata sulla prevenzione del danno ischemico, aumentando il contributo dell’ossigeno all’area miocardica in pericolo o Diminuendo il consumo di ossigeno di miociti cardiaci.
Analogamente, da molti anni è noto che l’esposizione dei miociti a brevi eventi ischemici ripetutamente, produce una protezione contro eventi di ischemia post-resistenti, processo chiamato precondizionamento ischemico (1 ).
al momento, l’interesse scientifico si concentra nella ricerca dei meccanismi cellulari coinvolti nella cardioprotezione contro gli eventi di ischemia / riperfusione, tra cui i canali del potassio sensibili all’ATP (K ATP) sembrano avere un ruolo centrale (1- 3).
in questo articolo, i concetti di cellulare e fisiologia molecolare legata al ruolo dell’ATP k sono esaminati in difesa ischemica del miocardio.
Struttura e funzione dei canali del potassio cardiaci .
potassio (k +) è la seconda cazione più abbondante dell’organismo. Un adulto di 70 kg contiene circa 4200 potassio MEQ o circa 50 meq / kg nel maschio e 40 meq / kg nella donna, tenendo conto della regolazione mediante adipocità e massa corporea. Il contenuto K + dell’organismo diminuisce con l’età a circa 2 meq / kg ogni 10 anni diminuendo la massa muscolare.
Approssimativamente, il 98% di K + è nel intracellulare liquido, con una concentrazione di 150 mEq / L, mentre al di fuori delle cellule è di 4 mEq / l, con un range di normalità ristretto tra 3,5 a 5,5 mEq / l.
K + ingerito quantità nei paesi occidentali è quasi 50 a 100 mEq / giorno o più o meno da 0,7 a 1,3 meq / kg di peso corporeo al giorno. Per esempio, in una persona che consuma 80 mEq in un giorno, il rene sarà responsabile per espellere 70 mEq, il tratto gastrointestinale 9 meq e la pelle intorno 1 meq.
Il potassio è in uno stretto equilibrio corpo , parte del quale è dovuta a una ridistribuzione tra i diversi compartimenti cellulari, se tale detto ION è tradotto dal mezzo intracellulare all’estracellulare o viceversa (4). Affinché tale fenomeno si verifichi, gli usi cellulari transmembrana proteine che funzionano come canali
I canali ionici hanno tre proprietà essenziali:.
1) un tunnel centrale o pori attraverso cui flussi da ioni rispetto alla loro gradiente elettrochimico.
2) un filtro di selettività, che dettami quali ioni potranno passare attraverso il poro, detta regione p
3) una struttura che esercita la funzione di gate controllando la probabilità conformazionale di apertura e chiusura del canale e di conseguenza, la permeabilità di detta proteina (4,5,6,7).
I canali del potassio è composto di alfa e sottounità beta. Responsabile della guida degli ioni attraverso il bilayer Lipid è la subunità alfa.A seconda della sua topologia e del numero di regioni P (selettività dei pori), è stata stabilita una classificazione dei canali di potassio (4,7,8).
Così, ad esempio, i canali di potassio che aumentano o diminuiscono La loro permeabilità a seconda della tensione transmembrana, hanno sei segmenti transmembrane (TM) e un poro (1 P) e sono chiamati canali K + dipendenti dalla tensione (KV, Figura 1, A); Coloro che presentano 2 TM-1P sono canali che consentono il passaggio del potassio verso intracellulare quando la membrana plasmatica è ad una tensione più negativa rispetto al suo potenziale di equilibrio e sono chiuse a potenziali più positivi, quindi sono chiamati, canali di potassio raddrizzatori interni (Kir , K interiormente rettificatore) (7,9,10,11,12,13).
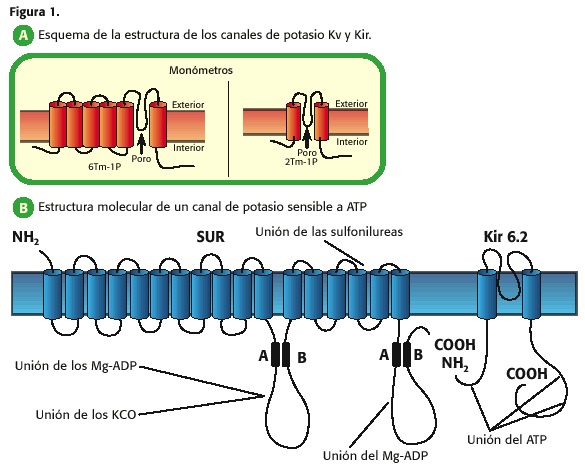
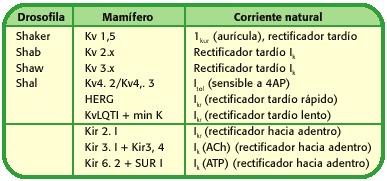
Ciascuna di queste famiglie di canali di potassio può a sua volta presentate sottofamilie, a seconda dell’elettrofisiologia del canale o del ligando che mediata l’apertura di tali proteine, tabella 1.
Tabella 1. Nomenclatura e struttura dei canali di potassio (14).
all’interno dei canali raddrizzanti in interiore sono due sottofamiglia importanti in Fisiologia cardiaca: 1) I canali K regolati da G Protein, che sono attivati dalla R. ECetratori muscarinici M3 (Kach) e 2) Canali sensibili all’ATP (KATP), questo ultimo oggetto centrale della revisione (7,9,10,13).
La funzione dell’ATP K è la migliore Conosciuto nelle cellule beta pancreatiche, dove cambia accoppiamento nell’eccitabilità elettrica della membrana plasmatica e del rilascio dell’insulina, in relazione alla concentrazione di glucosio nel sangue. Tuttavia, sono stati anche coinvolti nella protezione neurale negli eventi ischemici e nell’epilessia, nella regolamentazione dei toni polmonari e sistemici), retola del glucosio nel muscolo scheletrico e protezione contro l’ischemia dal miocato cardiaco, argomento di questa recensione (10).
Queste proprietà derivano dalla capacità dei canali KATP di accoppiare il metabolismo cellulare all’attività elettrica, rilevando i cambiamenti nel citosol dei livelli ATP e ad Adenosine Difosfato (MG-ADP), che operano l’ATP come blocco del canale e il mg- ADP come attivatore o promotore della sua apertura (10,11).
Il poro dei canali di potassio è un tetramer e perché il Kir è 2 TM-1P, quattro di queste unità sono unite per formare il poro, denominato a livello cardiaco Kir 6.2 e Kir 6.1. Inoltre, c’è un’altra proteina chiamata recettore di sulfonilurea (recettore sud, sulfonilurea, figura 1, B (15))
che regola l’apertura o la chiusura del PORE KIR 6.2 o KIR 6.1: L’ATP inibisce Il canale già si unisce alla subunità KIR 6, mentre MG-ADP lo attiva attraverso la sua interazione con la subunità meridionale (10,11,12,13,14).
Funzione centrale dei mitocondri in Cardioprotection
i mitocondri si trovano in quasi tutte le celle ad eccezione dell’ematis e il loro numero varia in base al tipo di cellulare; Ad esempio, ogni epatocita ha 1.022 a 2.000 mitocondri, che misura circa 3 μm circa.
Mitocondria Possiedono due membrane, un esterno e altro interno, che provocano scomparti intermembra e la matrice mitocondriale. Nella matrice mitocondriale e nella membrana interna, è qui che si sviluppano la maggior parte delle attività relative alla catena respiratoria (16). Nelle mitocondri ci sono diverse proteine che svolgono particolari funzioni, sia che promuovono la cardioprotezione o il danno della funzione cardiaca; E sono interrelati dal KATP da diversi meccanismi.
Entro il più importante sono:
1) Il poro di permeabilità transitoria (MPTP, poro di transizione per permeabilità mitocondriale) che è composto da:
– Canale anionico dipendente dalla tensione (VDAC, canale anionico dipendente dalla tensione), che si trova nella membrana mitocondriale esterna (MME)
– il trasportatore dei nucleotidi adenina (formica, Adenino Nucleotide Translocator), situato nella membrana interna (MMI)
– la creatina chinasi (CK), nello spazio intermembrano (EIM)
2) I convogliatori na + / H +, na + / ca ++, k + / h +, h + / piruvato, il cotrasporter ca ++ e le ben note proteine della catena respiratoria, beta-ossidazione e ciclo di krebs (17,18) ( Figura 2).
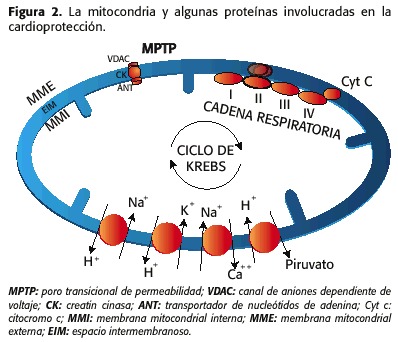
Eventi Più importante coinvolto nella Genesi dell’ischemia / ripercussione sono:
1. Modifiche nel volume della matrice mitocondriale
2. Lo stato EIM
3. La permeabilità dei MMI
4. La rottura della MME e
5. Il sovraccarico di calcio-sodio intramitocondriale.
Mitologia mitocondriale della movimentazione del calcio.
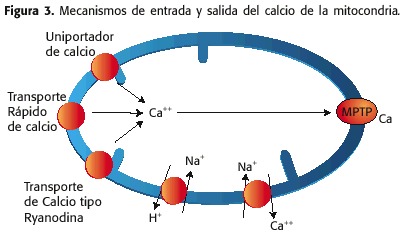
Il calcio gioca un ruolo fondamentale nella fisiologia mitocondriale, le cui concentrazioni sono in intervalli stretti. Il calcio può essere riconquistato verso la matrice mitocondria attraverso gli MMI da tre meccanismi:
1) una pompa di calcio, nota come Uni-calcio o up,
2) un canale che consente La voce calcio veloce, nota come calcio veloce o proteina di trasporto RAM (modalità rapida Ca ++ assorbente) e
3) una Riverodinia o Ryr (recettore ryanodine).
sull’altro Mano, l’uscita del calcio della matrice mitocondriale è dovuta a:
1) il contro-trasportatore na + / ca ++, in condizioni fisiologiche
2) l’MPTP, in condizioni patologiche (figura 3)
Funzione primaria del calcio a livello di Il mitocondria è la stimolazione della catena respiratoria a più livelli, causando un aumento della produzione di ATP e la sua esportazione al citosol per soddisfare la domanda metabolica di MyOCIT.
Sappia anche che il processo di fosforilazione ossidativa genera scimmia Quantità di radicali liberi Come prodotto di complessi I, Coenzyme Q e complesso III, e quello lontano da essere dannoso, piuttosto necessario per la trasduzione del segnale di più percorsi metabolici intramoscondriali (19).
Meccanismi che promuovono Sovraccarico di calcio intramitocondriale. Durante l’ischemia miocardica, l’aumento della glicolisi provoca un accumulo progressivo di acido lattico, riducendo il pH mitocondriale e che eserciterà un feedback negativo che alla fine
inibisce la glicolisi e la produzione di ATP. L’attivazione del anticipatore anti-go + / h + che estrae le idreogenei dei mitocondri cerca la normalizzazione del pH intramatriciale, ma nel processo sarà incoraggiato un sovraccarico di sodio, il che non può essere pompato fuori dalla cella, poiché Il na + / k + -atpase è inibito dalla perdita di ATP (19). Di conseguenza, l’attività del contro-trasportatore NA + / CA ++, che di solito esporta il calcio dai mitocondri e dalla cella, è diminuita o addirittura recita inversamente (perché questo è un meccanismo di trasporto attivo secondario) in modo che nei diversi compartimenti cellulari Inizia un feedback positivo che promuove notevolmente un sovraccarico di calcio. A questo punto, l’omeostasia ionica non può essere mantenuta, il sodio intracellulare e le concentrazioni di calcio aumentano progressivamente, con nucleotidi ridotti di adenina e aumento del fosfato.
Inoltre, l’aumento del calcio mitocondriale promuove la formazione radicale gratuita nei mitocondri dai seguenti meccanismi:
1) Il sovraccarico di calcio mitocondriale promuove un aumento del flusso elettronico nella catena respiratoria
2) stimola anche l’ossido nitrico sintetasi, formando ossido di nitrico (NO)
3) è noto che non inibisce la catena respiratoria al livello complesso IV che
4) aumenta la formazione di radicali liberi (ROS, specie di ossigeno reattivo) per ciclo Q
5) I complessi I e II della catena respiratoria possono anche essere inibiti dall’aumento del calcio e non, contribuendo ancora di più alla formazione di ROS
6) il calcio anche dissociati il citocromo c di proteina cardiolipina in MMI e infine mo
7) L’aumento del calcio promuove l’apertura dell’MPTP, consentendo il rilascio del citocromo, tramite MME (19).
Nonostante tutto quanto sopra, durante l’ischemia il mitocondriale PH (PHMI) rimane basso e questo fenomeno, come sarà discusso nelle seguenti sezioni, è abbastanza potente da mantenere la MPTP chiusa, purché l’evento dell’ischemia non prolunga o supera la reperfusione temuta.
Il poro di permeabilità transitoria (MPTP)
L’MPTP è stato descritto da Haworth e Hunter più di 25 anni fa, tuttavia, è fino a qualche anno fa che la sua funzione ha preso grande importanza negli stati dell’ischemia- riperfusione (20,21,22). In uno stato stazionario o nell’omeostasia mitocondriaria, l’MPTP è chiuso, la distanza
tra MME e MMI è ottimale e quindi c’è un accoppiamento tra la VDAC-CK-ANT, che consente il principale meccanismo di energia del Il mitocondria è il sistema di creatina-fosfocreatina e in secondo luogo quello dell’ATP / ADP (Figura 4) (23). Inoltre, la permeabilità dell’ant-VDAC è bassa in questo stato e i canali di potassio dipendenti da ATP sono chiusi (18,23,24).

D’altra parte, l’antipersporter k + / h + prende il potassio da la matrice in cambio di un’idrogenión, e ha anche una bassa cinetica in condizioni fisse, per garantire il mantenimento della fosforilazione ossidativa, un adeguato volume della matrice e un potenziale di membrana mitocondriale negativo, poiché come è noto, il potenziale delle idreogenei tra EIM e il potenziale La matrice mitocondriale viene mantenuta all’impermeabilità dei MMI ai diversi ioni, che consente la generazione ATP dal complesso V situato nel MMI.
In conclusione, da un punto di vista fisiologico, il regolamento del volume della matrice mitocondriale ha importanti conseguenze per il metabolismo energetico Myocus e lo stato impermeabile del poro contribuisce a detta omeostasia (17,24,25).
il pori di permeabilità di transizione durante l’ischemia e durante la ripercenza . In condizioni di ischemia miocardica, l’MPTP si apre su un importo inferiore, consentendo che la MMI sia permeabile a qualsiasi molecola < 1,5 kDA. Si verificano quindi due importanti conseguenze. Innanzitutto, le proteine intramoscondrie non possono passare attraverso il poro e esercitare la pressione colloidosmotica nel gonfiore della matrice. L’MMI a causa della sua coerenza non soffre di lisi, tuttavia, tale fenomeno si verifica in MME, con il rilascio di proteine all’UIM, come il citocromo C e il fattore dell’induttore dell’apoptosi che svolge un ruolo critico nella morte cellulare da questo meccanismo . In secondo luogo, gli MMI diventano permeabili ai protoni, che hanno disaccigliato la catena respiratoria, la produzione ridotta di ATP e terzo, viene promosso il funzionamento inverso dell’ATP sintetasi, cioè, invece di sintetizzare l’ATP è promosso l’idrolisi di questo per il mantenimento del mantenimento Un gradiente di H + e un potenziale di membrana mitocondriale negativo (18.26.27.28,29).
Tuttavia, a una situazione del genere, le concentrazioni ATP diminuiscono rapidamente, guidando ad una modifica ionica di omeostasi metabolici E l’attivazione di enzimi che promuovono il degrado, come fosfolipasi, nucleasi e protesi. A meno che la chiusura MPTP non si verifica, queste modifiche causano danni ad cellule irreversibili, con conseguente necrosi cellulare.
Un fattore chiave nell’apertura dell’MPTP è il sovraccarico di calcio intralaitriciale, specialmente quando è accompagnato lo stress ossidativo, lo stress ossidativo accompagnato Nucleotidi adenosina, alte concentrazioni di fosfato ionico e depolarizzazione del MMI, microambiente che viene presentato nell’ischemia. Pertanto, l’apertura dell’MPTP è un passo fondamentale nella transizione dal danno cellulare reversibile ad irreversibile (18,23).
Come menzionato sopra, l’MPTP è formato dall’ant-VDAC e dall’altra Le proteine, che si chiama Cyclophiline-D (CYP-D), che deve aderire alla formica a causare l’apertura, unione che è promossa dall’aumento della concentrazione del calcio, dall’esaurimento delle riserve di nucleotidica di adenosina, aumentando PHMI e alterazioni del volume della matrice. Tuttavia, un potente inibitore di apertura dei pori è la riduzione del PHMI, un fenomeno che si verifica durante l’ischemia, stabilendo un equilibrio tra fattori che favoriscono la sua apertura (sovraccarico di calcio mitocondriale, esaurimento ATP, aumento dello stress ossidativo) e coloro che lo mantengono chiuso ( Sotto PHMI), Figura 5.
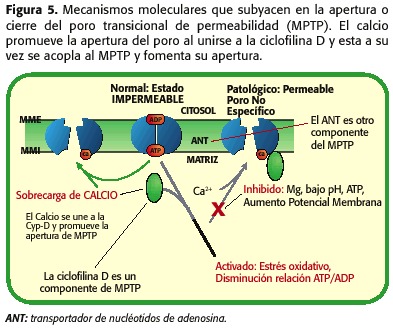
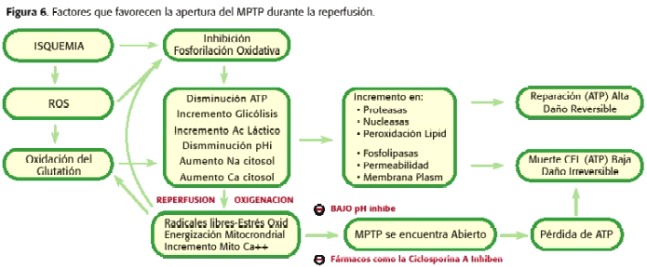
Così entrambi, durante l’ISCHEMIA il MPTP Apre ma a bassa quantità, poiché la micro-nazione cellulare non è l’ottimale per il tale fenomeno da verificare. D’altra parte, durante la riperfusione ci sono una serie di fenomeni intramoscondriali che promuovono l’apertura dell’MPTP ancora più che durante l’ischemia. Quando si verifica la riperfusione, il mitocondria è di nuovo in grado di respirare e generare un potenziale di membrana che consente la sintesi dell’ATP, con l’aumento della produzione di radicali liberi come i prodotti della catena respiratoria, il PHMI inizia ad aumentare e persistono ancora il Sovraccarico di calcio e deflessione di ATP. Pertanto, a questo punto è promosso l’apertura dell’MPTP (30,31,32,33,34,35 anni) (figura 6). A seconda della percentuale di pori aperti e il tempo rimanente in tale stato, necrosi o apoptosi (18.23,24) andrà a promuovere (figura 7).
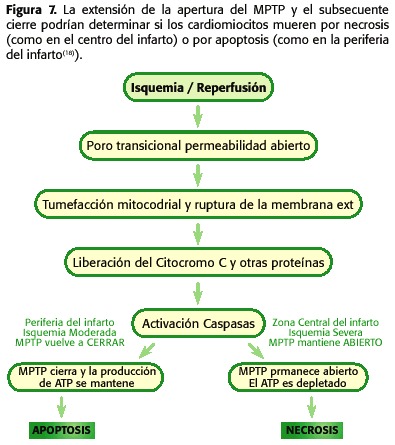
In questo modo, i mitocondri diventa terapeutico obiettivo, sia promuovendo l’inibizione diretta della MPTP o indirettamente, prevenendo i fenomeni che promuove la sua apertura, come ad esempio
1) il sovraccarico di calcio che può essere raggiunto con la propofol36 o con l’aumento della concentrazione di Mg ++ che inibisce il contatore-trasportatore Na + / Ca ++ e il tipo canali del calcio L (37)
2) migliorare la bioenergetica mitocondriale o volume della matrice, entrambi i fenomeni propiziata con farmaci che i canali aperti potassio (KCO, potassio canale apriporta) vedi sotto
3) mantenimento di un pH basso durante la riperfusione, per esempio, inibendo l’antipersportador Na + / H + con farmaci come amiloride, o piruvato aggiunta (38) ai mitocondri che favorisce l’aumento di acido lattico.
Tutto da Nterta apre una porta immensa nella ricerca nel campo delle scienze di base e nelle terapie per i pazienti affetti da ischemia miocardica o delle sue conseguenze
I canali del potassio sensibili all’ATP:. La sua funzione nella prevenzione dell’apertura della mitocondriale MPTP e nella membrana sarcoplasmatico
durante situazioni di stress miocardica, in cui l’ATP è reft, i canali di K + aumentare il loro stato di apertura con conseguenze positive per il microambiente di myocit (39,40, 41).
l’apertura della mitocondriale K ATP provoca un modesto aumento K + influenza verso l’interno della matrice, che provoca due effetti differenti a seconda dello stato bioenergetico di cardiomiociti. In primo luogo, quando la cella è a riposo, il potenziale di membrana mitocondriale è elevata, e l’ingresso di ioni potassio favorisce la tartaruga mitocondriale e alcalinizzazione della matrice, che favorisce un leggero aumento della produzione di radicali liberi. In secondo luogo, se la cella è nello stato di ischemia, mitocondri viene distribuito (basso potenziale), che promuove l’uscita di K +, un fenomeno che è contrastato dai canali di K ATP e quindi la contrazione del volume Motrix che sarebbe altrimenti verificarsi (42).
reddito potassio alla matrice mitocondriale genera una leggera produzione di radicali liberi (ROS), e, come è dimostrato, esse svolgono un ruolo importante come secondi messaggeri In una varietà di segnali intracellulari (39). Questa produzione di ROS in una cellula di riposo promuove anche il riacquisto di K + in cambio di un H + (Antitransporter K + / H +), che crea il gradiente per lo scambio di un fosfato (PI) da ElectronWealth Cotrasporter PI / H + + . PI Ricettatura è molto inferiore a quella di K +, perché il PI è presente in molte meno concentrazioni rispetto al K +. Per questo motivo, il pH della matrice è sempre aumentato quando il volume della matrice aumenta anche, fenomeni promossi dal PI e K + Ricettatura (23).
Quando i canali non sono ancora stati inseriti in funzione del KATP durante gli eventi ischemici, mitocondriale matrice subisce una contrazione e aumenta EIM, con la disunione del VDAC del ANT dalla CK, che aumenta la conduttanza allo scambiatore nucleotide dal VDAC e ANT, contrariamente a quanto accade in Resto, contribuendo così alla deflessione della matrice e ATP citosolica (Figura 3). Pertanto, l’apertura del KATP durante l’ischemia, ad esempio promosso da diazoxide, mantiene il volume della EIM, riduce il tasso di perdita di ATP, riduce la velocità di degradazione dei nucleotidi adenina in modo tale che essi esisteranno riserve ADP per la successiva fosforilazione durante la riperfusione e, infine, riduce variazioni del potenziale di membrana mitocondriale e l’accumulo di Ca ++, per prevenire il sovraccarico di calcio, poiché i resti ATP nelle concentrazioni adatte per il funzionamento minimo di NA + / K + ATPASA e altre pompe.
Questi effetti preservano la funzione mitocondriale e in questo modo si può affrontare con riperfusione con risultati fisiotopatologici migliori. Durante la riperfusione, la successiva apertura di canali KATP consente la compartimentazione dei nucleotidi adenina, il che significa che la prima fonte di energia è fosfato di fosfocreatina e non sono ATP (bassa conduttanza del VDAC (23), figura 3).
dunque, l’attivazione dei canali ATP mitocondriale durante impedisce ischemia-riperfusione la formazione del poro di transizione di permeabilità inibendo stress ossidativo, innescata dal reddito del CA ++ (18,23,24).
vanden hoek et al. Hanno dimostrato che l’aumento dei radicali liberi nei mitocondri durante la precondizione ischemica era necessaria per proteggere il miocus contro un successivo stress ossidativo durante la riperfusione.È così che è stato ipotizzato che ci sono due fasi nel rilascio di radicali liberi, il primo che contribuisce all’apertura dei canali di potassio sensibile all’atp ea una successiva durante la ripercussione, che è dannosa e attiva l’apoptosi rimodellata e cardiaca ( 42). Nella membrana sarcolemica del mioctile cardiaco e del muscolo liscio, l’apertura dei canali di potassio promuove anche gli effetti protettivi.
iperpolarizzazione della cella che impedisce il sovraccarico di CA ++ intracellulare, riducendo la durata del potenziale d’azione, limitando la limitazione della cellulare Danni e preservare le riserve energetiche cellulari e quindi, la sopravvivenza di miocit. Inoltre, questa sequenza può essere sia acuta che cronica (8,42,44). A livello vascolare, l’apertura di questi canali promuove la vasodilatazione, a causa dell’iperpolarizzazione e della riduzione della cellula nell’ingresso di CA ++, con un aumento del flusso coronarico e diminuzione del ripristino.
Prospettive cliniche
Prospettive cliniche
> A causa delle proprietà combinate della cardioprotezione e della vasodilazione, i farmaci che consentono l’apertura dei canali di potassio (KCO), potrebbero essere considerati per determinate condizioni cardiache (Tabella 2). Questi includono la protezione del miocardico sotto la circolazione extracorporea, la conservazione del cuore del donatore nel trapianto di cuore, il trattamento della malattia ischemica cardiaca, dell’ipertensione dell’arteria sistemica e polmonare, delle malattie vascolari polmonari, delle malattie vascolari periferiche e delle aritmie relative alla repolarizzazione anomala (41-50).
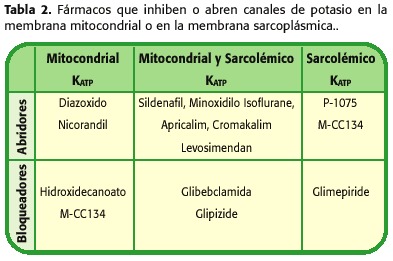
In cardiaco chirurgia, il KCO potrebbe svolgere un ruolo importante per Soluzioni di cardioplegia. In diversi modelli di chirurgia cardiaca con circolazione extracorporea, diversi koc, tra cui Nicorandil, Aprikalim e Pinacidil, hanno promosso una maggiore cardioprotezione rispetto al cardioplexy convenzionale (51.52).
in pazienti che sono stati eseguiti chirurgia dei ponti (bypass) coronarica, Il tempo necessario per raggiungere l’arresto cardiaco, i cambiamenti nel segmento ST dopo il serraggio aortico, i livelli plasmatici del CPK-MB e della dose di agenti inotropici, erano tutti minori del gruppo trattati con Nicorandil rispetto ai controlli trattati con terapia convenzionale ( 53).
L’uso di soluzioni cardioplessiche con KCO come diazossido, minoxidil (54), Propofol (che inibisce il sovraccarico di calcio ++ (36)), il magnesio (che inibisce il sovraccarico di calcio37), i digitali (che Foster cardioprotezione da percorsi di segnalazione cellulare che convergono con quelli di KCO (23,55)), piruvato (che incoraggia l’acidosi intracellulare e Standardizzazione del grado di pH della chiusura MPTP (38)), gli inibitori del controserporto NA + / H ++ come Amyloride, (che evita anche la perdita del basso effetto protettivo del basso), adenosina (che è anche un kco , agendo attraverso le proteine G, impedisce il sovraccarico di calcio poiché la cardioplegia iperpotima promuove (52.56)), possono essere forti obiettivi per la conservazione della funzione cardiaca in interventi chirurgici ad alto rischio e può evitare complicazioni potenzialmente mortali come la bassa sindrome di spesa post-pompa e molti Altri, con la riduzione dei costi economici riducendo i soggiorni dell’ospedale.
D’altra parte, l’uso di antiossidanti sembra essere utile solo in determinate circostanze, già che il suo uso in studi di laboratorio ha bloccato il pre-rivestimento ischemico bloccato , perché i radicali liberi vengono rilasciati in quantità inferiori (23,25).
in sindrome coronarica acuta, valore Del KCO è meglio documentato clinicamente con Nicorandil che ha dimostrato di essere vantaggioso con effetti negativi minimi sulla gestione di angina stabile e instabile (57). In uno studio multicentrico che coinvolge più di 5.000 pazienti con angolazione stabile, l’uso a lungo termine di Nicorandil è stato associato alla riduzione degli eventi cardiovascolari come la morte cardiaca, l’infarto del miocardico e il ricovero a causa del dolore toracico (58,59).
in I pazienti con rabbia instabile, il Nicorandil aggiunto a un trattamento anti-ischemico aggressivo ridotto episodi di ischemia miocardica / necrosi e aritmie se confrontati con i pazienti trattati con terapia convenzionale. Nei pazienti sottoposti a angioplastica coronarica, il Nicorandil ha predominato il cuore, migliorata emodinamica coronarica e la redditività miocardica conservata prima della riperfusione (60,61,62).
Nicorandil diminuisce anche il precarico e il post-carl, aumenta il rilascio di nitrico L’ossido di cellule endoteliali e, a differenza della nitroglicerina, non sviluppa la tolleranza nei confronti dei suoi effetti antiaginosi (63).
Nella angina vasospastale, Nicorandil è un potente vasodilatatore e ha dimostrato di diminuire gli episodi di angina variante, diminuisce i cambiamenti del segmento ST e migliora la perfusione coronarica. Il KOC ha anche dimostrato risultati migliori in chirurgia Bypass coronarica utilizzando innesti arteriosi (arterie toraciche interne, gastroepiploico, radiale) in quanto evita il successivo vasospasmo (64,65.66)). Sono necessari dati di esperienza e scientifici con l’uso di KCO in queste situazioni cliniche.
L’attivazione del KATP sarcolemica è responsabile della corrente elettrica che sottolinea l’elevazione del segmento ST, il classico indicatore elettrocardiografico del danno ischemico miocardico ( 41). I pazienti con diabete mellito trattati con sulfoniluree e che sono infarto acuto al miocardio, presentano una grandezza attenuata nell’elevazione della ST, il che rende difficile per la diagnosi iniziale, poiché la sulfonilureas sono inibitori dei canali KATP dipendenti (41).
Conclusione
Come praticamente tutte le malattie umane, la terapeutica della malattia ischemica cardiaca si basa su nuove conoscenze in fisiologia cellulare e fisiopatologia. La modulazione dei canali KATP è un processo critico nell’ometasi metabolica della cella e secondo la ricerca biomedica dilui nuovi concetti sulla struttura, la funzione, la regolazione e la selettività del tessuto di questi canali, i nuovi agenti terapeutici possono essere sviluppati con enormi vantaggi per la popolazione a rischio.
Riferimenti
1. Ardehali H, O’Rourke. I canali katp mitocondriali nella cella di sopravvivenza e nella morte. J mol cellu cardiol 2005; 39: 7-16.
2. Kloner RA, Bolli R, Marban E, Reinilib L, Braunwald E. Implicazioni mediche e cellulari di stupefacenti, ibernazione e precondizionamento: un laboratorio NHLBI. Circolazione 1998; 97: 18: 48-67.
3. Murray ce, jennings rb, reiner ka. Precondizionamento con ischemia: un ritardo di letali letali nel miocardio ischemico. Circolazione 1986; 74: 11: 24-36.
4. Cogan mg. Liquidi ed elettroliti: fisiologia e fisiopatologia. Manuale moderno. Messico, 1993; 145-168.
5. Sansom msp, shrivirastava ih e at. Canali di potassio: strutture, modelli, simulazioni. Biochimica et biofisica ACTA 2002, 1565: 294-307.
6. Biggin PC, Roosild T, Choe S. Struttura del canale di potassio: dominio per dominio. Parere attuale Biologia strutturale 2000, 10: 456-461.
7. Giblin JP, Leany JL e Tinker A. L’Assemblea molecolare dei canali di potassio sensibile ATP: determinanti sul Pare che forma subunità. J BOOL CHEM 1999, 274: 22652-22659.
8. Choe S. Strutture del canale di potassio. Nat Rev Neuroscience 2002, 3: 115-121.
9. Lousouarn G, Rose T, Nichols cg. Base strutturale del rettificatore interiore del canale di potassio del canale. Tendenze cardiovasc med 2002; 12: 253-258
10. Nishida M, Mackinnon R. BASE STRUTTURALE DI RECESSIFICAZIONE INTERMO: POTOPLASMICO PORARE DEL GIRK DI RACCORDIO INTERNO GIRK1 DI GIRK1 AT 1.8 ALLA RISOLUZIONE. Cellulare 2002; 111: 957-965.
11. Yamada M, Innobe A, Kurachi Y. G Regolazione proteica dei canali ioni di potassio. Recensioni farmacologiche 1998; 50: 724-747.
12. Bichet D, Haass F, Yeh Jan L. Unisci studi funzionali con strutture di canali K + raddrizzanti interni. Naturale recensioni 2003; 4: 957-67.
13. Aguilar-Bryan L, Clement IV J, González G, Kunjilwar K, Babenko A, Bryan J. verso la comprensione dell’Assemblea e della struttura dei canali Katp. Recensioni fisiologiche 1998; 78: 227-242.
14. Elizari M, Chiale P. Arrhythmie cardiache: fondamentali cellulari e molecolari, diagnosi e trattamento. Panamericana, Buenos Aires, 2003; 31-40.
15. Campbell JD, Sanson MSP, Ashcroft F. Regolamento canale di potassio. Naturale recensioni 2003; 11: 1038-1042.
16. Méndez Je, Zeledón SF, Zamora JF, Cortés VA. Un approccio alla parte della cinetica di ossigeno 1. Rev Costarar Caridiol 2004; 6: 27-32.
17. Suleiman M, HelapAp AP, Griffiths E.J. Mitocondria: un obiettivo per la protezione del miocardico. Farmacologia e terapeutica 2001; 89: 29-46.
18. HelapAp AP, Clarke J, Sabzali A, Javadov A. Mitocondriale Permeability Transition Pare Apertura durante la riperfusione miocardica: un obiettivo per cardioprotezione. Cardiovasc 2004; 61: 372-385.
19. Brookes P, Yoon e, Robotham J et al. Calcio, ATP e ROS: un triangolo mitocondriale di amore-odio. AM J Physyol Cell Physiol 2004; 287: C817-C833.
20. Hunter Dr e Haworth Ra. La Transizione della membrana indotta da Ca ++ in Mitocondria I. I meccanismi protettivi. Biochem arch Biofys 1979; 195: 453-459.
21. Hunter Dr e Haworth Ra. La Transizione a membrana indotta da Ca ++ in Mitocondria II. Natura del sito di trigger Ca ++. Biochem arch Biofys 1979; 195: 460-67.
22. Hunter Dr e Haworth Ra. La Transizione a membrana indotta da Ca ++ in Mitocondria III.Relasi di Transitional CA ++. Biochem arch Biofys 1979; 195: 468-77.
23. Garlid KD, Dos Santos P, Xie ZJ, Costa A, Paucek P. Titolo di potassio mitocondriale: il ruolo del canale K + Mintocondrial ATP-Sensitive K + in funzione cardiaca e cardioprotezione. Biochem Biophys Acta 2003; 1606: 1-21.
24. Macfalls E, Liem D et al. Funzione mitocondriale: il cuore della conservazione del miocardico. J Lab Clin Med 2003; 142: 141-9.
25. Facundo H, Fornazari M, Kowalzwki A. Protezione dei tessuti mediata dai canali mitocondriali K +. Biochm Biophys Acta 2005; 1701: 1-11.
26. HaleStrap AP. La transizione di permeabilità mitocondriale: il suo meccanismo molecolare e il suo ruolo nella lesione di riperfusione. In: Brown GC, Nicholls DG, Cooper CE, redattori. Mitocondria e morte cellulare. Simposia della società biochimica. Londra: Portland Press; 1999, vol. 66, p. 181-2013.
27. HaleStrap AP, McStay GP, Clarke SJ. Il complesso di pore di transizione della permeabilità: un’altra vista. BIOCHIMIE 2002; 84: 153-66.
28. HaleStrap AP, Kerr PM, Javadov S, Woodfield Ky. Illucidating il meccanismo molecolare della permeability transizione il poro e il suo ruolo nella ferita alla riperfusione del cuore. Biochim Biofys Acta 1998; 1366: 79-94.
29. HaleStrap AP, Brenner C. Il nucleotidico adenino Translocase: una componente centrale del mitocondriale Transition Transition PORE e Key Player nella morte cellulare. CURR Med Chem 2003; 10: 1507-25.
30. Duchen MR, McGuinness O, Brown La, Crompton M. sul coinvolgimento di una ciclosporina, un poro mitocondriale sensibile sensibile in lesioni al reperfusione miocardica. Cardiovasc res 1993; 27: 1790-4.
31. Lemaster JJ, Nieminen Al, Qian T, Trost LC, Herman B. La transizione mitocondriale di permeabilità in lesione tossica, ipossica e reperfusione. Mol cellulare Biochem 1997; 174: 159-65.
32. Lemaster JJ, Trollinger Dr, Qian T, Cascio, noi, OHATA H. Imaging confocale di CA2 +, PH, potenziale elettrico e permeabilità della membrana in singole cellule viventi. Metodi enzymol 1999; 302: 341-58.
33. Xu mf, wang yg, hirai k, ayub A, Ashraf A. Il precondizionamento del calcio inibisce la transizione del mitocondriale di permeabilità e l’apoptosi. Am J Physiol 2001; 280: H899- 908.
34. Miyata H, Lakatta EG, Stern MD, Silverman Hs. RELAZIONE DEL CALCIO MITOQUONDRIALE E CINDOSOLICO GRATUITO AL CALCIO DI MYOCYTE cardiaco dopo l’esposizione all’anossia. Circzione res 1992; 71: 605-13.
35. Griffiths EJ, Ocampo CJ, Savage JS, et al. Percorsi di trasporto del calcio mitocondriale durante ipossia e reossigenazione nei cardiomioni di ratto singolo. Cardiovasc res 1998; 39: 423-33.
36. Lim Khh, Modi P, Nicholson E, et al. Un modello di maiale di arrest cardioplegic di sangue caldo per indagare gli effetti cardioprotettivi del Propofol. J Physyol 2001; 536p: 82p.
37. Headrick JP, McKirdy JC, Willis RJ. Effetti funzionali e metabolici del magnesio extracellulare in miocardio normossico e ischemico. Am J Physiol 1998; 275: H917-29.
38. Mallet Rt. Piruvato: Protezione metabolica delle prestazioni cardiache. Proc Soc Exp Biol Med 2000; 223: 136- 48.
39. Oldenburg O, Cohen M et al. Canali katp mitocondriali: ruolo nella cardioprotezione. Cardiovasc Res 55: 429-437, 2002.
40. Miniere J, McLeod C, Sack N. Plasticità mitocondriale in classica ischemica precondizionata che si muove oltre il canale katp mitocondriale. Cardiovas res 2003; 59: 1-6.
41. Kane G, Liu X, Yamada S, Olson T, Terzic A. Cardiac Katp canali in salute e malattia. J mol cellu cardiol 2005; 38: 937-943.
42. Wang Y, Haider H, Ahmad N, Aschraf M. Meccanismi di Wich Katp Channel Opendes producono cardioprotezione acuta e ritardata. Pharmacologia vascolare 2005; 42: 253-264.
43. Vanden Hoeck T, Becker L.B, SHAO Z, Schumacker P. Specie reattive di ossigeno rilasciato da mitocondri durante il breve ipossia inducono precondizionamenti nei cardiomiociti. J Biol. Chem. 1998; 273: 18092-98
44. Jahangir A, Terzic A. Katp canale terapeutico al capezzale. J mol cellu cardiol 2005; 39: 99-112.
45. Kane GC, Behfar A, Yamada S, Perez-Terzic C, O’Cochlain F, et al. Hoenicke Em, Sun XW, Strange RG, Damiano RJ. Conservazione del cuore del donatore con una nuova soluzione iperpolarizzante: protezione superiore rispetto all’università della soluzione di Wisconsin. J Thorac Cardiovasc Surg 2000; 120: 746-54.
46. Quast u, Guillon JM, Cavero I. Pharmacologia cellulare di apri canali di potassio nel muscolo vascolare liscio. Cardiovasc res 1994; 28: 805-10.
47. Okada y, Yanagisawa T, Taira N. BRL 38227 (Levcromakalim)-Iperpolarizzazione -dotta riduce la sensibilità a CA2 + di elementi contrattili nell’arteria coronarica canina. Naunyn Schmiedebergs Arch Pharmacol 1993; 347: 438-44.
48. Donnelly R, Elliott Hl, Meredith PA, Reid Jl. Studi clinici con l’attivatore del canale di potassio Cromakalim in materie normotensive e ipertesi. J cardiovasc Pharmacol 1990; 16: 790-5.
49. Simpson D, Wellington K.Nicorandil: una revisione del suo utilizzo nella gestione di Angina Pectoris stabile, compresi i pazienti ad alto rischio. Droghe 2004; 64: 1941-55.
50. McCully JD, Levitsky S. I canali del potassio sensibile al Mitotocondrial ATP in cardioprotezione chirurgica. Arch Biochem Biofys 2003; 420: 237-45.
51. Kevelaitis E, Oubenaissa A, Peynet J, Mouas c, Menasche P. Precondizionamento degli impiegati del canale di potassio sensibile al mitocondriale – Un approccio efficace per migliorare la conservazione dei trapianti del cuore. Circolazione 1999; 100: 345-50.
52. Steensrud T, Nordhaug D, Husnes KV, Aghajani e, Sorlie DG. Sostituzione di potassio con Nicorandil nel Cold St. Thomas ‘Hospital Seredioplegia migliora la conservazione di energetica e funzione nei cuori di maiale. Ann Thorac Surg 2004; 77: 1391-7.
53. Hayashi Y, Sawa Y, Ohtake S, Nishimura M, Ichikawa H, Matsuda H Controlled NicoRandil Administration Protezione formyocardy durante la bypass di arteria coronarica innestata sotto bypass cardiopolmonare. J cardiovasc Pharmacol 2001; 38: 21-8.
54. Garlid PD, Paozed p et al. Effetto cardioprotettivo della diazossido e della sua interazione con i canali K + sensitive MITOChondrial ATP: possibile meccanismo o cardioprotezione, circuita RES del 1997; 81: 1072-182.
55. L’interazione Xic Z. Ouabain con cardiaco na / k- atpasa rivela che l’enzima può fungere da pompa e come trasduttore di segnale. Cellulare Mol Biol 2001; 47: 383-390.
56. Jovanovic A, López J, Alekseev A et al. L’adenosina previene il caricamento del CA21 indotto da K1: informazioni sulla cardioprotezione durante la cardioplegia. Ann Thorac Surgamer 1998; 65: 586-91.
57. Simpson D, Wellington K. Nicorandil: una revisione del suo utilizzo nella gestione di angina pectoris stabile, compresi i pazienti ad alto rischio. Droghe 2004; 64: 1941-55.
58. Markham A, Plosker GL, Goa Kl. Nicorandil-Una revisione aggiornata del suo uso in malattia cardiaca ischemica con enfasi sui suoi effetti cardioprotettivi. Farmaci 2000; 60: 955-74.
59. Il gruppo di studio IONA. Prova a mostrare l’impatto del Nicorandil in Angina (Iona): progettazione, metodologia e gestione. Cuore 2001; 85: E9.
60. Ito H, Taniyama Y, Iwakura K, Nishikawa N, Masuyama T, et al. Nicorandil endovenosa può conservare l’integrità microvascolare e la redditività del miocardico in pazienti con infarto miocardico a parete anteriore reperfusa. J AM COLD CARDIOL 1999; 33: 654-60.
61. Schlepper M, Thormann J, Berwing K, Strasser R, Mitrovicv. Effetti del Nicorandil sulla perfusione regionale e sulla funzione ventricolare sinistra. Droghe cardiovascl del 1995; 9: 203-11.
62. Sakatay, Kodama K, Komamura K, Limyj, Ishikura F, et al. Effetto salutare dell’amministrazione di nicorandil intrascooronaria aggiuntiva sul restauro del flusso sanguigno del miocardico e del miglioramento funzionale nei pazienti con infarto miocardico acuto. Cuore J 1997; 133: 616-21.
63. Simpson D, Wellington K. Nicorandil: una revisione del suo utilizzo nella gestione di angina pectoris stabile, compresi i pazienti ad alto rischio. Droghe 2004; 64: 1941-55.
64. Kaski JC. Gestione del ruolo di angina vasospastica di Nicorandil. Droghe cardiovascl nel 1995; 9: 221-7.
65. Chen JW, Lee WL, Hsu NW, Lin SJ, Ting Ct, Wang SP, et al. Effetti del trattamento a breve termine di Nicorandil sull’ischemia miocardica indotta da esercizio e ad anormali Attività autonomica cardiaca in angina microvascolare. Am j cardiol 1997; 80: 32-8.
66. AKAR F, Uydes-Dogan BS, Tufan H, Aslamaci S, Koksoy C, Kanzik I. Il confronto della reattività delle arterie mammari e gastroipiploici interni isolati umani a Levcromakalim: un approccio alternativo alla gestione dello spasmo innesto. BR J CLIN PHARMACOL 1997; 44: 49-56.
A Departamento de Fisiología, Universidad de Ciencias Médicas (Ucimed), Sabana Oeste, San José, Costa Rica. TELÉFONO (506) 296-3944, E-mail: [email protected], [email protected]
B Cátedra de Cirugía, Ospedale México, Ucimed, San José, Costa Rica.
C Cáttedra de Cirugía, Ospedale México, Universidad de Costa Rica (UCR), San José, Costa Rica.
d cátedra de fisiopatología, ospedale México, ucimed y ucr, san josé, costa rica