Introduzione
Le alterazioni nel metabolismo del calcio-fosforo sono un problema prevalente e di grande importanza per i pazienti con CKD (malattia renale cronica) .1-8 appropriato e precoce La valutazione, così come il trattamento è vitale per il controllo ottimale dei nostri pazienti.
Il metodo diagnostico ideale per il voto e il tipo di osteodystrofia renale è ancora la biopsia del laiale di cresta iliaca dopo la tetracycline doppia etichettatura, 9-25 ma, dovuta Alla sua natura invasiva e fatica, è di difficile applicazione nella pratica clinica quotidiana.26 Attualmente, la diagnosi e il trattamento di queste alterazioni si basano sulla determinazione dei livelli plasmatici di ormone paratiroideo intatto (IPth) .10,17,27-31 Tuttavia, la determinazione di questo ormone non è semplice ed è soggetta a grande variabilità.32-34 Oltre a ciò, i metodi utilizzati per elaborare i campioni IPTH non sono standardizzati, un fatto che potrebbe essere un’importante fonte di variabilità pre-test.
scopo dello studio
ad ana La variabilità del LYSE nei risultati della determinazione IPTH confronta i diversi metodi di elaborazione dello stesso campione di plasma trattati con acido etilendiaminetetraacetic (EDTA) in pazienti con CKD in diverse fasi di sviluppo.
Materiale e metodo
Nel nostro studio, abbiamo analizzato 294 campioni di sangue da 49 pazienti con malattia renale cronica (CKD) in diverse fasi di sviluppo, 18 provenivano da pazienti trapiantati nell’unità di trapianto renale (36,7%) e 31 dell’unità hemodialysis cronica del nostro ospedale ( 63,3%).
Tutti i campioni di sangue sono stati raccolti al mattino (tra le 8 e le 9 del mattino) dopo un’ora veloce e predialysi per i pazienti sottoposti a trattamento renale sostitutivo. Il sangue è stato disegnato al servizio di emodialisi del nostro ospedale. Tre tubi di EDTA sono stati estratti da ciascun paziente: due tubi da 5 ml e un tubo da 10 ml. Immediatamente dopo l’estrazione, sono stati inviati al frigorifero presso il dipartimento della medicina nucleare, dove ciascuno è stato elaborato in modo diverso, come verrà descritto qui.
Gruppo di riferimento o gruppo 1 (EDTA 5ml Tube):
– Campione del sangue raccolto (e inviato rapidamente refrigerato al dipartimento della medicina nucleare).
– Centrifugazione refrigerata.
– Plasma immediatamente congelato.
Gruppo 2 (tubo EDTA 10ml):
– Campione del sangue raccolto.
– Mantenuto un’ora a temperatura ambiente.
– Centrifugazione normale.
– Separato in 3 tubi:
– uno dei tubi è immediatamente congelato. Gruppo 2a
– Un tubo è refrigerato per otto ore e poi congelato. Gruppo 2b
– Un altro tubo è refrigerato per > 24 ore e congelato. Gruppo 2C
Gruppo 3 (tubo EDTA 5ml):
– campione di sangue raccolto.
– mantenuto > 3 ore a temperatura ambiente.
– Centrifugazione normale.
– separati in due tubi:
– immediatamente congelato. Gruppo 3A
– Un tubo è refrigerato per > 8 ore e congelato. Gruppo 3B
I metodi di elaborazione utilizzati per i campioni di sangue nel nostro studio sono stati solitamente applicati in questo dominio. L’IPTH è stato misurato usando il test immunoradiometrico (IRMA Total intatto Scantibodies Assay, 2a Generation). La variabilità all’interno ottenuta era inferiore al 2,5%. GRUPPO 1 è stato considerato lo standard GOLD, poiché queste sono le condizioni generalmente raccomandate per questo tipo di campioni, indipendentemente dal metodo o dal conservante utilizzato (EDTA o Citrato).
un due con due confronti è stato eseguito tra il IPth significa valori nel gruppo di riferimento e gli altri. Pertanto, la normalità di distribuzione è stata verificata prima applicando test di varianza e normalità dell’omogeneità. Successivamente, abbiamo eseguito un confronto da coppie con il test T compresa la correzione Bonferroni. Il livello di significato è stato istituito a P
Risultati
L’età media della popolazione studiata era del 60,88 ± 17,65 e la fascia di età compresa tra 26 e 90 anni. Dei 49 pazienti inclusi nello studio, 25 erano femmine e 24 maschi, che corrispondono rispettivamente al 51 e al 49%. La causa principale della malattia renale cronica non è affiliata, seguita da origine vascolare e glomerulare. Le restanti caratteristiche descrittive della nostra popolazione di studio vengono visualizzate nella Tabella 1.
Il valore medio nel gruppo di riferimento era 202,25 ± 199,72pg / ml. I valori medi dell’IPTH IPTH negli altri gruppi analizzati, visualizzati nella Tabella 2, sono stati 196 ± 203.23PG / ml, 202,8 ± 200.2pg / ml, 202,8 ± 200.2pg / ml, 20006 ± 194.87pg / ml, 204.08 ± 204.073PG / ml e 197,94 ± 182.31 pg / ml. Come si può vedere nella figura 1, i risultati sono stati praticamente identici per ciascun gruppo, senza differenze importanti rispetto al gruppo di riferimento (P = 0.87, p = 0,99, p = 0.95, p = 0.96, p = 0.90), quando Confronto con i gruppi 2A, 2b, 2C, 3A e 3b, rispettivamente).
Discussione
La determinazione del siero PARATHORMONE è difficile da quantificare poiché è abbastanza instabile sia nel siero che nel sangue43-45 (Av. 5 minuti). Il metodo di riferimento è basato su filatura refrigerata e congelando il campione immediatamente dopo l’estrazione. Tuttavia, questa procedura è molto difficile nella pratica clinica quotidiana, poiché l’attività della nefrologia non è limitata solo al dominio dell’ospedale. In generale, i campioni sono disegnati presso le cliniche e poi inviati agli ospedali di riferimento per l’analisi. A volte, queste cliniche sono a una diversa distanza dagli ospedali. La maggior parte dei campioni non è filata o separata nel luogo di estrazione perché non hanno i mezzi necessari per farlo. Oltre a questo, i campioni sono fili a temperatura ambiente. Possiamo derivare da questo l’importanza di conoscere e ridurre la variabilità per un massimo nella gestione dei campioni.
Attualmente non vi è alcun metodo standardizzato per elaborarli. Ci sono alcune polemiche sulla stabilità del parathormone in siero o plasma trattato con EDTA. Diversi studi affermano che la determinazione del IPTH in siero è meno stabile di quella ottenuta dal plasma e dal campione di emocinio conservato in tubi trattati con EDTA.35-42 Tuttavia, Omar et al.38 nel 2001 ha osservato che i livelli di IPTH in EDTA sono diminuiti 14.8 % Dopo aver rimandato a temperatura ambiente per 48 ore. Oltre a questo, recentemente, Cavalier et al.42 hanno dimostrato che i campioni trattati con EDTA non sono sempre più stabili che nel siero. Sostengono che la stabilità dell’IPTH dopo 24 ore a -20ºC è maggiore in siero che per il plasma trattato con EDTA.
In quasi tutti gli studi eseguiti fino ad oggi, siero ed EDTA sono confrontati.35-42 Tuttavia, una delle limitazioni che il nostro studio presenta è che un gruppo di controllo con siero (citrato) non è stato stabilito. Pertanto, non possiamo valutare le determinazioni dell’IPTH in siero e plasma (EDTA) una volta congelati a -20ºC, né confrontarlo con i risultati di Cavalier et al. Oltre a questo, non abbiamo analizzato ciò che avviene dopo 48 ore a temperatura ambiente per confrontare con Omar et al. Risultati.
I risultati di questo studio non mostrano differenze significative tra il gruppo di riferimento e gli altri gruppi analizzati. Si conferma che i campioni di plasma trattati con EDTA sono stabili e il suo utilizzo è raccomandato con la centrifugazione refrigerata e il congelamento immediato è difficile da raggiungere.
Conclusione
L’uso di EDTA come conservante Nel trattamento dei campioni analitici per la determinazione del sangue di IPTH consente un maggiore tempo di elaborazione senza il requisito di congelamento immediato, visualizzando una variabilità minima nei risultati ottenuti in base a diversi metodi di elaborazione. Questi risultati possono aiutare a stabilire strategie logistiche per la lavorazione dei campioni di sangue nei pazienti con CKD.
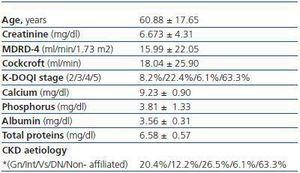
Tabella 1. Caratteristiche descrittive della popolazione dello studio

Tabella 2. Valore Ippth medio (PG / ml) per ciascun gruppo studiato
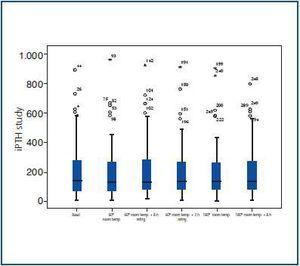
Figura 1.