Revisión do artigo
Inmunopatéxico da enfermidade hipertensiva gravidic
inmune-patoxénese da hipertensión embarazada
Alaín Alonso-Remedios, Maité Pérez-Cutiño, Dania F. de León Delgado
Universidade de Ciencias Médicas de Cienfuegos. Cuba.
Resumo
A enfermidade hipertensiva gravidic constitúe unha patoloxía obstétrica relativamente frecuente. Nos últimos anos realizouse o progreso na comprensión da patoxenesia da enfermidade, sendo o sistema inmunitario un dos actores de vital importancia na aparición deste trastorno. As células asasinas naturais de Decidue son un compoñente fundamental na remodelación vascular durante a formación da placenta. Cando hai alteracións nesta poboación celular, unha isquemia placental que promove a liberación de factores vasculares e mediadores de inflamación que promoven o dano sistémico coa aparición dos síntomas da enfermidade.
Palabras clave: preeclampsia; sistema inmunitario; Patrogenia.
Resumo
A hipertensión embarazada é a frecuente trastorno de promnancia. Os investigadores avanzaron recentemente na comprensión desta enfermidade da enfermidade. O sistema inmunitario xoga ao papel fundamental neste inicio do deseño. As decentes células asasinas naturais son compoñentes fundamentais na remodelación vascular durante o desenvolvemento placentario. Cando as alteracións ocorren nesta poboación celular, a isquemia placental é inducida a promover a liberación de factores vasculares e mecanismos de inflamación que causan estes síntomas de enfermidades.
Palabras clave: preeclampsia; Sistema inmunitario; Patoxenesis
Introdución
O embarazo considérase un evento fisiolóxico e recibe, na maioría dos casos, como agasallo concedido a sexo feminino. Con todo, nesta fase hai numerosas condicións que constitúen unha causa de morbilidade e mortalidade materna.
Prehelampsia / eclampsia é unha enfermidade de etioloxía descoñecida, en que unha hipoxia tecidual xeneralizada, especialmente aparecer, cun impacto multissistémica que afecta especialmente as do ril, fígado, vasos sanguíneos eo sistema nervioso central. A hipoxia, por outros motivos (hipóxicos, anémicos), agravará aínda máis a situación do paciente aumentando o dano á microcirculación.2
Houbo aproximadamente 2.000 anos despois de que Paracelso describise a enfermidade por primeira vez; Non obstante, o progreso na comprensión da pre-eclampsia foi lenta e só nos últimos 10 ou 15 anos cambiou o coñecemento deste desorde.3
A imaxe clínica caracterízase pola figura sistólica que alcanza os 140 mmHg ou máis e presión diastólica de 90 mmhg ou máis, acompañada por proteinuria; É común que tamén sexa Cefalea, Tinni, fosfens, edema, dor abdominal e / ou alteracións de laboratorio. É coñecido como Eclampsia cando, ademais, os pacientes con enfermidades gravidales hipertensas presentan as incautacións ou o estado de coma en ausencia doutras causas.4
Entre os factores de risco coñecidos que predisponen a preeclampsia son: nuliparidade, adolescencia, mulleres Máis de 35, a obesidade, a hipertensión arterial previa, o embarazo múltiple, as enfermidades crónicas como a diabetes mellitus, a historia de preeclampsia / eclampsia no embarazo, a historia familiar de preeclampsia e / ou sufriron eclampsia, entre outros factores. 4
Recientemente foi demostrado que durante o embarazo hai unha remodelación das arterias de espiral uterina con invasión de células trofoblásticas, que é indispensable para unha irrigación placental correcta. Cando este fenómeno é deficiente, obtense unha placenta isquémica, que constitúe un factor central na etiopatóxeno dos compoñentes preeclampsia.5.6
do sistema inmunitario como os macrófagos e as células asasinas naturais da uterina (DNK de O Decide Natural English Killer) están implicados no proceso de placentación. Hai evidencias que teñen como obxectivo unha relación directa entre as poboacións de células inmunes da placenta, o ambiente de citoquina producido por estas células e a aparición de enfermidades asociadas ao crecemento intrauterino embarazante, abortos e enfermidade hipertensiva gestacional.5,7
Con base nas evidencias sólidas que apuntan a un papel importante no sistema inmunitario na patoxenesia da enfermidade gravidal hipertensiva que decidimos facer esta revisión co obxectivo de describir os principais mecanismos inmunolóxicos implicados na patoxenesia do pre-eclampsia A través do resumo dos datos proporcionados polos artigos publicados sobre o asunto nos últimos 10 anos.
Métodos
Unha revisión bibliográfica realizouse na base de datos PUBMED / MEDLINE, utilizando os descritores: pre-eclampsia, pre-eclampsia e inflamación, pre-eclampsia e sistema inmunitario, pre- Eclampsia e Citoquinas. Todos os elementos publicados na revista de acceso aberto cuxa data de publicación non impediu a 2005. Apareceu un total de 225 artigos, dos cales 30 traballos foron seleccionados en cuxos resumos atopamos aspectos relacionados coa finalidade da nosa investigación. Adicionalmente, foi revisada a revista cubana de xinecoloxía e obstetrica onde se utilizaron os descritores: pre-eclampsia, etiopatóxenos da preeclampsia a partir da cal 4 artigos publicados a partir de 2005 foron seleccionados ata a data.
Sistema de inmunopatogênese
Sistema inmune na placenta normal
A placenta é o órgano do intercambio fetal, ademais de facerse cargo da produción de hormonas. Cara ao cuarto mes consta de dous compoñentes; Un fetal a corión frondosa e unha maternal, a caducidade basal. As células trocóbrastas e diquexas mestúranse na zona da Unión. Entre a folla corónica e decidida hai o espazo intermedio ocupado por sangue maternal. 8 A interface fetal-fetal está formada nos espazos intermedios e na decida basal (Fig. 1) .9
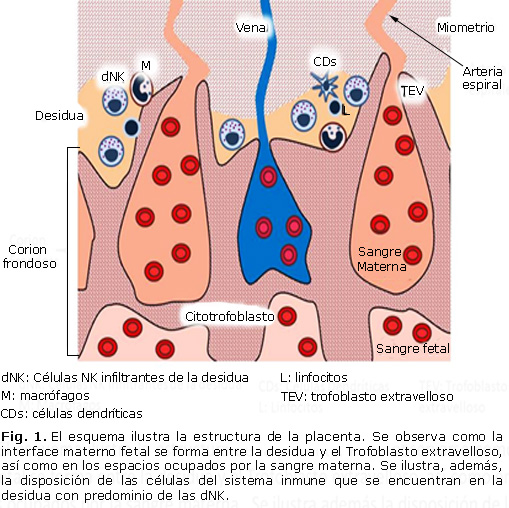
As células trofoblásticas están en contacto directo co sangue maternal. O feto compórtase como un transplante semi-allogénico ao ter a metade da información xenética da información da nai. 10 para evitar o rexeitamento, as células trofoblásticas non expresan as moléculas do complexo principal histocompatibilidad (MHC de inglés: gran complexo de histocompatibilidad) Clase II (DP , DQ e DR). Tampouco teñen moléculas de clase MHC I a ni b; Eles só expresan a MHC IC e as formas non clásicas de MHC I como HLA (do inglés: os antíxenos de leucocitos humanos) E, F e G.11 deste xeito As células trofoblásticas impiden a eliminación por células inmunes maternos na interface maternal. Fetal.
En decidir hai células do sistema inmunitario como linfocitos, células dendríticas, células asasinas naturais e outras que son necesarias para o embarazo normal. As células asasinas naturais (nk de asasino natural) constitúen o principal Poboación de leucocitos na interface maternal-fetal.13 En humanos, esta poboación representa o 70% de todas as células brancas que se atopan na placenta durante o primeiro trimestre do embarazo e son chamados infiltrando nk de Decidue (DNK). Esta poboación distínguese polo fenotipo CD56 CD16 brillante – a diferenza das células NK tradicionais atopadas en sangue periférico e outros tecidos, que se caracterizan por expresar os marcadores CD56DIM CD16 + (fig. 1) .14
A poboación DNK Non expresar a partir do receptor de baixa afinidade para IGG (CD16) carece de actividade citotóxica dependente de anticorpos (a citotoxicidade mediada por células de anticorpos dependente de anticorpos) .9 Ademais, os dnks teñen unha maior expresión do receptor de kir (do inglés: a inmunoglobulina de células asasinas) Como receptores) 14 e ILT (do inglés: leucocitos de communoglobulina-como receptor) 15 que as células de NK de sangue periféricas.
O kir é unha familia polimórfica de receptores onde algúns teñen unha acción inhibitoria mentres que outros transmiten sinais de activación. Os ligandos destes receptores son as moléculas de clase I MHC, especialmente o HLA-C.16 Ademais do ligando dos receptores ILT son as moléculas HLA-G ea súa sinalización tamén inhibe a actividade citotóxica das células NK.15 no trofoblast normalmente Expresado Altamente expresado HLA-C e HLA-G; 14 desempeñan un papel importante na tolerancia do feto e da formación da placenta.
O DNK segrega citoquinas pro-inflamatorias como TNF-α (Alpha, Inglés Tumor Necrosis Factor: Necrose Tumor Alpha factor), IL-8 e IFN-γ (Interferon gamma); Ademais da produción de factores de crecemento, como o factor de crecemento do endotelio vascular (VEGF, factor de crecemento vascular-endotelio), 5 factor de crecemento da placenta (PGF, inglés: placentan factor de crecemento), angust1 / 2 (de inglés: angiopietin) e transformación Factor de crecemento beta1 (TGF-β1, do inglés: o crecemento transformador beta1 factor) .14
in vitro e in vivo estudos mostraron que a sinalización activando o receptor no DNK favorece a actividade secretora; A diferenza do sangue periférico NK, que liberan factores citotóxicos dos seus gránulos. 13 A IL-8 producida polo DNK intervén nos procesos de migración e invasión do trofoblast, con todo o TNF-α aumenta a actividade citotóxica do DNK nas células trofoblast.5 Así mesmo, o PGF, ANGPT 1/2 eo VEGF intervén no proceso de formación da placenta e remodelada dos vasos sanguíneos.14
Na interface maternal-fetal ademais dos DNK que atopamos Outras células inmunes. Os linfocitos T representan menos do 10% dos leucocitos atopados na placenta. Principalmente son linfocitos TCD4 aínda que tamén podemos atopar linfocitos CD8 T a cargo da produción de citoquinas e regulación da invasión trocóblástica.18
As células dendríticas (CDS) só representan entre 1 e 2% dos leucocitos (Fig . 1). No útero, os CDs inmaturos caracterizados pola expresión do CD1A, a diferenza dos CD maduros atopados no endometrio durante a fase menstrual, que expresan o CD38. Os CDs interactúan directamente co troboblast a través do receptor DC-Sing (do inglés Dendritic Specificación de células ICAM que incorpora nonegrin). Dada a súa función de presentar antíxenos, os CDs teñen a capacidade de regular o patrón de diferenciación de linfocitos T.15
A acción das hormonas durante o embarazo tamén ten efecto sobre os linfocitos. A progesterona induce a produción do factor de unión inducido por progesterona (PIBF do factor de vinculación inducido por progesterona). O GDPF favorece a diferenciación do fenotipo de IL-4, IL-5 e IL-10. As células TH2 promoven a adquisición do fenotipo M2 nos macrófagos, o que contribúe ao ambiente tolerante da placenta.19
Os macrófagos representan aproximadamente o 20% dos leucocitos infiltrantes do decide durante o embarazo; Con todo, eles constitúen unha importante fonte de citoquinas para a tolerancia do feto e da defensa contra as infeccións. No embarazo normal, os macrófagos dos secretores de citoquinas antiinflamatorias M2 (CD68 +) e factores vasculares como VEGF, IL-8 e angust ½ (fig. 1) .20
Immunopatóxeno de Preeclampsia
Durante moito tempo foi considerado unha enfermidade hipertensiva gestacional (pre-eclampsia / eclampsia) como a enfermidade de múltiples etioloxías; No entanto, nos anos setenta do século pasado revelouse que esta enfermidade estaba asociada coa isquemia erotera-placental. Hoxe en día sábese que esta irrigación insuficiente débese á formación inadecuada dos vasos sanguíneos en placenta.21
durante o embarazo normal, as células derivadas do fetal-trofoblast migrar a endometrio e myometrium substituíndo o músculo liso e o Endotelio das arterias espirales uterinas, esta remodelada garante buques de maior calibre e menos resistencia ao fluxo sanguíneo. Non obstante, cando este proceso non se produce por completo, as complicacións asociadas ao embarazo están iniciadas.5
Os esforzos intensivos foron feitos para comprender os factores implicados no proceso de formación da placenta. A evidencia recente indica que a mala proliferación, a migración ea invasión das células trofoblásticas son consecuencias da infiltración aberrante por células inmunitarias no útero e a acción das citoquinas producidas por estas células. 5
Na patoxénese de Praeclampsia están implicados Moléculas MHC non clásicas, células NK, células dendríticas, receptores de recoñecemento de patróns, citoquinas e subpopulacións de linfocitos TCD4 e TCD8. É por iso que o sistema inmunitario ten un papel importante neste trastorno. Os experimentos in vitro demostraron que os DNKs son importantes para o proceso de remodelación das arterias espirales e a correcta formación da placenta. Polo tanto, as alteracións nesta poboación celular están ligadas á aparición da enfermidade. 23
Nun modelo de murina de enfermidade gravidal hipertensiva demostrouse que hai unha redución da poboación DNK coa consecuente perda de factores derivados Desde estas células.24 Outros estudos, a través do modelo Murine Pre-Eclampsia BPH / 5 mostrou a elevación do IL-15 mentres declinou a poboación DNK. Nos seres humanos, a existencia de relación entre os niveis de IL-15 ea gravidade dos estudos inmunohistoquímicos.13
Os estudos inmunohistoquímicos foron corrompidos en humanos demostraron un aumento na poboación de células placentais da poboación de NK (CD56). Ás placentas das mulleres embarazadas normais. Non obstante, non houbo diferenzas significativas entre a infiltración por células de NK placentas entre as mulleres con pre-eclampsia e eclampsia.25. Estes resultados aparentemente contraditorios ao que se atopa nos modelos de animais débese en pacientes con enfermidade gravidal hipertensiva, ocorre un proceso inflamatorio asociado. Para a placentaria isquemia con recrutamento de células NK periféricas con actividade citotóxica16, estes datos corroboran a teoría de que hai unha ligazón entre a inflamación eo desenvolvemento da enfermidade.Aínda que recentemente publicáronse novas evidencias que confirman o papel da inflamación na xénese de pre-eclampsia.26.27
Outras causas de inflamación diferentes da isquemia foron relacionadas coa xénese da enfermidade. Por exemplo, descríbese a asociación entre infeccións xenitais e múltiples patoloxías nas mulleres embarazadas. Dentro deles os fallos de implantación, abortos e entrega de pre-termos. Con todo, o ambiente inflamatoria causados por estes xermes cambiar o patrón de citocinas no útero, o que podería contribuír a aparición da enfermidade hipertensiva xestación como un gatillo 0,28
Os estudos en modelos animais mostraron que a inxección de LPS Ao comezo do embarazo produciu síntomas similares aos pre-eclampsia. Estes descubrimentos suxiren que a sinalización do receptor de recoñecemento de patróns TLR-4 (de inglés: receptor de peaxe) é importante na xénese desta enfermidade. Hai datos clínicos de aumentar este receptor en placentas humanas de mulleres con pre-eclampsia.29, tamén apuntan a unha posible asociación entre as bacterias gramos negativas eo desenvolvemento da enfermidade hipertensiva gestacional. 30 É necesario recordar que unha parte importante do A microbiota do tracto xenital é a bacteria gram negativa.
A resposta inflamatoria non só aparece antes das infeccións; Por exemplo, a obesidade está asociada a un proceso inflamatorio crónico de baixo grao. 31 estudos demostraron que a obesidade e as dietas ricas en azucres e graxas diminuír a infiltración de DNK durante o embarazo. Adicionalmente, os adipocitos producen leptina, que aumenta a actividade citotóxica do DNK.5 Os resultados son niveis máis baixos dos factores necesarios para estimular a migración do trofoblast e pola outra, unha poboación de DNK coa capacidade de destruír células trofoblásticas. A combinación destes fenómenos tradúcese nunha baixa remodelación das arterias espirales, polo tanto, o fluxo sanguíneo do útero-placentarium está afectado e a placenta convértese en isquémica.
A placenta isquémica produce factores solubles como SFLT1 e VEGF, a elevación destes factores no sangue maternal está asociada ao inicio da pre-eclampsia.32-34 o uso de anticorpos monoclonales (ACM) contra o SFLT1 eo VEGF demostraron a redución da proteinuria en ratones. Curiosamente, os seres humanos, a pre-eclampsia non se desenvolve en todas as mulleres con valores elevados de SFLT1.35. Estes resultados débense aos factores producidos pola placenta isquémica inducir danos endoteliais xeneralizados responsables da proteínia e as figuras elevación da presión arterial. A combinación destes dous factores e os danos endoteliais son responsables da aparición do edema nestes pacientes (fig. 2) .26

Endoglin parece desempeñar un papel importante na lesión endotelial e pode servir como marcadores de risco para o desenvolvemento da enfermidade. O factor inducible da hipoxia alfa (HIF1-α de factores inducibles de hipoxia inglesa) parece desempeñar un papel relevante no inicio da enfermidade hipertensiva gestacional. 36 HIF1-α ocorre en resposta á hipoxia eo seu aumento na placenta está asociada á expresión de Os xenes de resposta de hipoxia dentro dos cales o VEGF e o factor HIF1-α non só interveñen na síntese de factores vasculares derivados da placenta se non ten efecto no sistema inmunitario, que favorece O ambiente inflamatorio da interface maternal-fetal, 37 cun aumento nas poboacións TH1, os produtores de IFN-γ, IL-2 e IL-12, xunto cunha diminución das poboacións de linfocitos T Regulators.38 Este ambiente inflamatorio, xunto con endotelial Os danos favorecen a contratación de NK coa actividade citotóxica, que destrúen as células trofoblásticas que afectan a circulación utero-placental e reforzan a isquemia. 39 de aí que a contribución de osíxeno inadecuada Ser o factor detonante da enfermidade.
A isquemia placental tamén induce un aumento na poboación macrófago M1-γ-γ.5 aínda que IFN-γ aumenta a produción de CXCL12 por células endoteliais, o principal factor para a contratación de CD56 NK CD56 A sinalización induce a apoptose nas células trofoblestas. Polo tanto, esta isquemia inicial empeora a xénese da enfermidade converténdose nun ciclo de amplificación na inmunopatéxico da preeclampsia. Por este motivo, podemos afirmar que o efecto de IFN-γ na inmunopatéxico da preeclampsia é controvertido; Non obstante, moitos autores teñen asociación relacionada entre altos niveis desta citocina e desenvolvemento da enfermidade.22
Outras citoquinas producidas por macrófagos do fenotipo M1, como TNF-α, favorece a expresión aberrante de metaloproteinasas e produce a apoptose directa nas células trofoblásticas coas que a invasión trocóblástica ás arterias espirales é máis ralentizada. 40 En xeral, as citocinas proinflamatorias diminúen a migración trofoblástica e están ligadas ao desenvolvemento da enfermidade. 22
Do mesmo xeito, o patrón de resposta do linfocito TCD4 tamén está relacionado coa aparición de patoloxía, onde algunhas subpoboas tales como th1 e th17 favorecen a súa aparencia; Mentres o treg e th2 constitúen factores de protección. 41.42 En xeral, as citoquinas do patrón TH1 promoven a apoptose das células trocóblásticas e atrasan na invasión do trofoblast; Mentres as citocinas do estándar TH2 favorecen a proliferación e a invasión do trofoblast.11.22 Os estudos clínicos demostraron que as mulleres con preeclampsia elevaron os números de linfocitos TH1743 e a treg diminuíron con respecto ás mulleres embarazadas normais e estas alteracións maternos transcenden o feto, que inflúe O sistema inmunitario do recentemente nado nas primeiras semanas de vida.44
Ademais, o desenvolvemento da enfermidade grave gestacional está relacionada con cambios epixenéticos e xenéticos no paciente. Un estudo bioinformático demostrou que na expresión de xenes polimórficos na villi crónica influencia sobre a aparición de preeclampsia, están especialmente ligados a xenes de expresión diferencial. Gran parte dos produtos destes xenes están relacionados coa actividade das escolas DNK.45
en humanos mostraron que as nais nas que o seu DNK só expresou os receptores de Kir, como a combinación de Kir2DL1n coa expresión de alelo de HLA-C2 POR O feto aumenta o risco de enfermidade de salsa hipertensiva e crecemento intrauterino atrasado con respecto ás nais que expresan o alelo Kir2DS1 do receptor de activación en DNK.46 Isto explícase polo feito de que a sinalización activando os receptores induce no seu Secretario Funcións e non citotóxicos.17
Os polimorfismos en HLA-G tamén foron relacionados cun maior risco de preeclampsia, xa que os portadores de Fetus do Allele +14 BP / + 14 BP HLA -G teñen unha expresión máis baixa de HLA-G en células trofoblestas que favorece a acción citotóxica de NK. (11) outros polimorfismos como TGF-β 1869 T˂c; 47 así como nas proteínas C6 Masp1 do complemento tamén foron asociadas co desenvolvemento da enfermidade.48
como resumo en A patoxénese da enfermidade, os factores ambientais e xenéticos que traen como consecuencia un infiltrado máis baixo das células DNK están imbricadas. Debido á importancia dos DNKs para promover a migración e a invasión das células trofoblásticas, unha diminución desta poboación trae como consecuencia que as células endoteliais ou musculares lisas das arterias espirales non son substituídas pola consecuente insuficiencia da contribución do sangue e nutrientes.. En resposta a esta isquemia placentaria, os factores e as citocinas son liberadas que transforman o ambiente de toleroloxía ao inflamatorio co que as células trofoblesas son destruídas. Doutra banda, o exceso de factores vasculares ea transformación do proceso inflamatorio local no sistema produce danos endoteliais, que é responsable da aparición do cadro clínico nestes pacientes.
Conflitos de interese
Os autores non declaran que teñan conflitos de interese.
1. García I, M. Alemán Riscos do embarazo en idade avanzada. Rev Cubana Obstet Gynecol. .. 2013; 39 (2): 120-7. Dispoñible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2013000200007&lng=es
2. Suárez J, Gutierrez M, Cairo V, Marín Y, Rodríguez L, Veitia M. Preeclampsia anterior como un factor de risco no Embarazo actual Rev Cubana Obstet Gynecol. .. 2014; 40 (4): 368-77. Dispoñible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2014000400003&lng=es
3. Delgado J, Reyes E, Amador A, García M, Cubero ou, Quesada F, et al. MalonldialDehyde e Peso de nacemento en pre-eclampsia. Revisión breve e asociación entre ambos. Rev Cubana Obstet Gynecol. .. 2008; 34 (3): Dispoñible en: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2008000300003&lng=es
4. Álvarez V, Alonso R, Muñiz M, Martínez J. Caracterización da hipertensión inducida polo embarazo .. Rev Cubana Obstet Gynecol. .. 2014; 40 (2): 165-74. Dispoñible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2014000200004&lng=es.
5. Spradley F, Palei A, Granger J. Mecanismos inmunes que unen a obesidade e preeclampsia. Biomoléculas .. 2015; 5: 3142-36. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4693273/
6. Abbas y, Oefner C, Polcack W, Gardner L, Farrell L, Sharkey A, et al. Un ensaio de microfluídas para estudar a invasión das células trofoblastas de placas humanas. J R SOC Interface. .. 2017; 14 (130). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5454302/
7. Matson BC, CARON KM. Adrenomedullin e control endocrino das células inmunes durante o embarazo.CEL & MOL Immunol. .. 2014; 11: 456-9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4197213/
8. Salder TW. Embrioloxía médica de Langman. 8ª ed. México: Ed Médica Panamericana; 2010.
9. JABRANE-FERRAT N, SIEWIERA J. A cara arriba das células asasinas naturais diiduales: Novos desenvolvementos en inmunoloxía do embarazo. Inmunoloxía. .. 2013; 141: 490-7. Dispoñible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3956423/
10. GÖHNER C, Plösch T, Faas efectos M. imunomodulador da sinciciotrofoblasto vesículas extracelulares no embarazo e pre-eclampsia. Placenta. .. 2017; PII: S0143-4004 (17) 30288-6. http://www.sciencedirect.com/science/article/pii/S0143400417302886?via%3Dihub
11. Serrano NC. Inmunoloxía e xenética de preeclampsia. Clin desenvolver inmunol. .. 2006; 13 (2-4): 197-01. Disponible en:
12. Lamarca B, Amaral L, Harmon A, Cornelius D, Faulkner J, Cunningham MJ. Isquemia placental e fenotipo resultante en modelos animais de preeclampsia. Curr HyperTens Rep.. 2016; 18 (5): 38. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5127437/
13. SONES JL, LOB HE, ISROFF CE, DAVISSON RL. Papel de células asasinos naturais diiduales, interleucina-15 e interferón-γ no desenvolvemento placentario e preeclampsia. AM J Physiol Regul Integr Com Physiol. .. 2014; 307 (5): 490-2. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4214833/
14. Da Lima P, Zhang J, Dunk C, Lye SJ, Croy BA. Angioxénese de leucocitos Didriven-decidual no embarazo cedo. CEL & MOL Immunol. .. 2014; 11: 522-37. Dispoñible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4220841/
15. Martínez-Varea A, Pellicer B, Perales-Marín A, Pellicer A. Relación entre Maternal inmunolóxica Response durante o embarazo eo inicio da Preeclampsia. J de inmunol res. .. 2014; 2014: 210241. Dispoñible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4060291/
16. Takeshita LYC, González-Galarza FF, dos Santos EJM, Maia MHT, Rahmam MM, Zain SMS, et al. Unha base de datos para curar as asociacións entre os receptores de inmunoglobulina de células asasinas e enfermidades en poboacións en todo o mundo. Base de datos. .. 2013; 2013: BAT021. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3625957/
17. Hannaj Gwy. As células Decidual NK regulan os procesos de desenvolvemento clave na interface fetal-maternal humana. NAT med. .. 2006; 12: 1065-74. Disponible en: http://www.nature.com/nm/journal/v12/n9/full/nm1452.html?foxtrotcallback=true
18. Wallace AE, Fraser R, Cartwright Je. Tropoblast extravilloso e células asasinos naturais deciduales: unha asociación de remodelación. Actualización de reprobación humana. .. 2012; 18 (4): 458-71. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3373213/
19. ROBINSON DP, KLEIN SL. O embarazo e as hormonas asociadas ao embarazo alteran respostas inmunes e patoxénese da enfermidade. HORM HORT. .. 2012; 63 (3): 263-71. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3376705/
20. Smith SD, Dunk Ed, Aplin JD, Harris LK, Jones RL. Evidencia para a participación da célula inmune en remodelación de arteriole espiral diidual no embarazo humano cedo. AM J Pathol. .. 2009; 174: 1959-71. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2671283/
21. Vázquez Cabrera J. Embarazo, Parto e Puerperio. Principais complicaciones. La Habana: Editorial Ciencias Médicas; 2009.
22. Ning F, Liu H, Lash G. O papel de macrófagos diquias durante o embarazo normal e patolóxico. AM J Reprod Immunol. .. 2016; 75 (3): 298-309: p. 510-24. https://www.ncbi.nlm.nih.gov/pubmed/26750089
23. Robson A, Harris LK, Innes Ba, Lash Ge, Aljunaidy MM, Aplin JD, et al. Célula de asasino natural uterino iniciar remodelación de arteria espiral no embarazo humano. FASEB J.. 2012; 26: 4876-85. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/22919072
24. Linzke N, Schumacher A, Woidacki K, Croy BA, Zenclussen AC. O monóxido de carbono promove a proliferación de células asasinas naturais uterinas e remodelación de arterias espirales no hemeo hipertensivo embarazado hemygenase-1 ratos mutantes. Hipertensión. .. 2014; 63: 580-8. Disponible en: http://hyper.ahajournals.org/content/63/3/580.long
25. Akhlaq M, Nagi Ah, YouSAF AW. Morfoloxía placentaria en pre-eclampsia e eclampsia eo rol probable das células NK. Indian J Pathol Microbiol. .. 2012; 51 (1): 17-21. Disponible en: http://www.ijpmonline.org/article.asp?issn=0377-4929;year=2012;volume=55;issue=1;spage=17;epage=21;aulast=Akhlaq
26. Borzychowski am, Sargent Il, Redman CWG. Inflamación e pre-eclampsia. SEM en FET & Neon med. 2006; 11: 309-16. Disponible en: http://www.sciencedirect.com/science/article/pii/S1744165X06000436?via%3Dihub
27. Harmon a, Cornelius D, Amaral L, Faulkner J, Cunningham MJ, Wallace K, et al. O papel da inflamación na patoloxía da preeclampsia. Clin Sci (Lond). .. 2016; 130 (6): 409-19. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5484393/
28. Weiss G, Goldsmith Lt, Taylor RN, Bellet D, Taylor HS. Inflamación en trastornos reprodutivos. Reprod Sci. .. 2009; 16 (2): 216-29. Dispoñible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3107847/
29. Koga K, Mor G. Toll-like receptors na interface materno-fetal no embarazo e embarazo Trastornos normais. AM J Reprod Immuno. .. 2010; 63 (6): 587-00. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3025804/
30. Ramperaud R, Randis TM, Ratner AJ. Microbiota do tracto xenital superior e inferior. Semin fetal neonatal med. .. 2012; 17 (1): 51-7.Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3242913/
31. Romeo GR, Lee J, Shoelson SE. Síndrome metabólico, resistencia á insulina e papel de inflamación-mecanismos e obxectivos terapéuticos. Arterioescler. Trombo. VASC. BIOL. .. 2012; 32: 1771-6. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4784686/
32. Palmer K, Tong S, Kaitu’u-lino T. Placental específico SFLT-1: Papel en pathysioloxía pre-eclamptica e as súas posibilidades de translación para a predición e diagnóstico clínico. Mol Hum Reprod. .. 2017; 23 (2): 69-78. Dispoñible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4925329/
33. Almasry S, Elfayomy A, Hashem H. ultraestructura e análise histomorfométrica dos vasos do cordón umbilical humano en pre-eclampsia: un potencial papel VEGF , VEGFR-1 e VEGFR-2. Rom J Morphol Embryol. .. 2016; 57 (2 suppl): 681-9. Dispoñible en: http://www.rjme.ro/RJME/resources/files/571216681689.pdf
34. Unha Liberis, Stanulov L, Ali E Hassan A, Pagalos A, Kontomanolis E. pre-eclampsia eo crecemento endotelial vascular Factor: un novo aspecto. Clin exp obstet gynecol. .. 2016; 43 (1): 9-13. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/27048010
35. Kanasaki k, Kalluri R. A bioloxía da preeclampsia. Riñón int. .. 2009; 76 (8): 831-7. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4313558/
36. Robb K, Cotechini T, Allaire C, Sperou A, Graham C. A restrición de crecemento fetal inducida por inflamación en ratas está asociada Aumento da acumulación de HIF-1α de placas. PLOS ONE. .. 2017; 12 (4): E0175805. Dispoñible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5397034/
37. Charnock-Jones D. placentária hipóxia, estrés retículo endoplasmático e sensibilización endotelial materna por sFlt1 en pre-eclampsia. J Reprod Immunol. .. 2016; 114: 81-5: 38-42. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4822533/
38. Vianna P, Mondadori A, Bauer M, Dornfeld D, Chies J. HLA-G e CD8 + Células T reguladoras no inflamatorio Ambiente de pre-eclampsia. Reprodución. .. 2016; 152 (6): 741-51. Dispoñible en: http://www.reproduction-online.org/content/152/6/741.long
39. Southcombe J, Redman C, invariantes sangue células T asasinas naturais Sargent I. periféricos durante o embarazo e en mulleres con pre-eclampsia. J Reprod Immunol. .. 2010; 87 (1-2): 52-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2995212/
40. Lockwood CJ, Basar M, Kayisli UA, Guzeloglu-Kayisli O, Murk W, Wang J, et al. Interferon-G protexe as células deciduais de primeiro trimestre contra a metaloprimeasases de matriz aberrante 1, 3 e 9 expresión en preeclampsia. AM J Pathol. .. 2014; 184: 2549-59. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4188280/
41. Lamarca B, Cornelius D, Harmon A, Amaral L, Cunningham M, Faulkner J, et al. Identificar mecanismos inmunes que realizan a hipertensión durante a preeclampsia. AM J Physiol Regul Integr Com Physiol. .. 2016; 311 (1): R1-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4967235/
42. Figueiredo A, Schumacher A. O Tipo de Tipo de Tipo 17 / Regulatory T. Paradigma do embarazo. Inmunoloxía. .. 2016; 148 (1): 13-21. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4819144/
43. Cornelius D, Amaral L, Wallace K, Campbell N, Thomas A, Scott J, et al. A presión de perfusión reducida da presión T-Helper 17 células causa fisiopatoloxía asociada a preeclampsia durante o embarazo. AM J Physiol Regul Integr Com Physiol. .. 2016; 311 (6): R1192-R1199. Disponible en: http://ajpregu.physiology.org/content/311/6/R1192.long
44. Sava F, Toli G, Treszl A, Hajdú J, Harmath Á, Rigó JJ, et al. Subconxuntos de células inmunes, citoquinas e niveis de cortisol durante a primeira semana de vida en neonates nacidos a nais preeclámptas. AM J Reprod Immunol. .. 2017; 77 (6). Dispoñible en: http://onlinelibrary.wiley.com/doi/10.1111/aji.12659/pdf
45. Rabaglino MB, Post-Uiterweer ED, Jeyabalan A, Hogge WA, Conrad CP. Un enfoque de bioinformática revela evidencias de vencemento de maduración endometrial antes e durante o embarazo precoz das mulleres que desenvolveron preeclampsia. Hipertensión. .. 2015; 65 (2): 421-9. Dispoñible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4290371/
46. Ivarsson MA, Michaelsson J, células asasinas Fauriat C. Activando Ig-like receptors na saúde e na enfermidade. Inmunol frontal. .. 2014; 5 (184): 1-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4001058/
47. Li X, Shen L, Tan H. Polimorfismos e nivel de plasma do factor de crecemento transformador-beta 1 e risco para preeclampsia: a Revisión sistemática. PLOS ONE. .. 2014; 9 (5): E97230. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4019528/
48. Wu W, Yang H, Feng y, Zhang P, Li S, Wang X, et al. Polimorfismos en xenes de complemento e risco de preeclampsia en Taiyuan, China. Inflamam Res. .. 2016; 65 (10): 837-45. Disponible en: https://link.springer.com/article/10.1007%2Fs00011-016-0968-4