Traballos orixinais
PAPILARY NEOPLANE páncreas indraductal: resultados clínicos-patolóxicos
Neoplasmos mucinantes papilares intraductos (IPMN) ) do páncreas: resultados clinico-patolóxicos
j. A.-CIENFUEGOS1, F. ROTELLAR1, P. Martí Cruchaga1, V. Valentí1, G. Zozaya1, A. Bueno1, N. Pedano1, MD Lozano2, JJ Solo2 e F. Pardo1
1departamento de cirurxía xeral e dixestivo.
2 Servizo de anatomía patolóxica. Clínica da Universidade de Navarra. Pamplona, Navarra
Dirección para a correspondencia
Resumo
Introdución: a neoplasma papilar mucinosa intraducida (NPMI) do páncreas comprende unha serie de lesións que evolucionan de lesións benignas (adenoma) a carcinoma ductal invasivo.
Obxectivo: analizar os resultados clínicos e patolóxicos de 15 pacientes diagnosticados con NPMI e intervir de acordo coas recomendacións de conferencia de consenso.
Material e métodos: análise retrospectiva de 15 pacientes con NPMI, interveu entre marzo de 1993 e setembro de 2009; Segundo as orientacións para conferencias de consenso internacionais. Datos demográficos, probas de diagnóstico, tipo de intervención, histopatoloxía e supervivencia actuarial recolléronse cun seguimento entre mes e medio e nove anos.
Resultados: 6 Duodenopancreatections, 4 pancreatectomies Total, 2 pancreatectomies Central, 2 pancreatectomies parcial a pancreatectomía distal. Graváronse unha morbilidade do 40%, sen mortalidade operativa, cunha media de 10 días. En 5 casos o NPMI foi mixto, en 4 afectou o conducto pancreático e nos restantes 6 a ramas de accesorios. Dous pacientes presentados no carcinoma situado e 3 carcinoma invasivo con nodos linfáticos negativos. Un paciente, sen carcinoma invasivo, morreu a 66 meses por páncreas adenocarcinoma. A supervivencia actuarial ata a recorrencia ou a morte foron 105.133 meses; Cun rango de seguimento entre o mes e medio e 9 anos.
O NPMI Ducto e Mixto require unha resección completa debido á alta incidencia de carcinoma invasivo ou lesións precursoras de malignidade. Pola súa natureza multifocal, os pacientes deben ser revisados a longo prazo. Hai controversias no accesorio asintomático tipo NPMI e menos de 3 cm.
Palabras clave: Neoplasma papilar mucinosa intraducida. Factores prognósticos Carcinoma invasivo. Supervivencia.
Resumo
Fondo: Neoplasma Papilar Intraductal Papilar (IPMN) mostra a serie de lesións que evolucionan a partir de lesións benignas -denoma a carcinoma invasivo.
Obxectivo: Analizar Os resultados clínicos e patolóxicos de 15 pacientes diagnosticados de IPMN e tratado quirúrgicamente de acordo coas directrices da conferencia de conferencias internacionais.
Material e método: unha análise retrospectiva de 15 patantes tratados quirúrgicamente entre marzo de 1993 e setembro de 2009, segundo a International Recomendación de consenso. As ferramentas demográficas, diagnósticas, o informe quirúrgico, a base de datos patolóxica e a supervivencia actuarial foron analizadas cun seguimento dun mes a medio a través de nove anos.
Resultados: 6 Patants sufriron pancreaticoduodenectomies, 4 Corpo ou Pancreatectomies Central 2 Pancreatectomies parciais (Enucleación ) e 1 pancreatectomía distal. Unha morbilidad de 46 e 0% de mortalidade hospitalaria foi avaliada, cunha estadía de lonxitude media de 10 días. En cinco casos, o IPMN foi combinado do tipo (tanto os dutos pancreaticos principais como a rama) en catro tipos principais de tipo duto e tipo de duto de rama noutros seis tamén. Varios atypia (IPMN Carcinoma en Sitión) foron observados en 2 patantes e un carcinoma invasivo con nodos linfáticos negativos identificáronse en 3 patantes. Un paciente sen carcinoma invasivo morreu a 66 meses de seguimento para páncreas adenocarcinoma. A supervivencia actuarial ata a recorrencia ou a morte foi de 105.133 meses con un rango de seguimento desde 1 mes e medio ata 9 anos.
Concluvision: IPMN ducto principal ou tipo mixto warrants resección completa debido á súa incidencia de carcinoma invasivo ou As lesións precursor da malignidade tamén. Debido ao seu patrón multifocal, deben seguirse pacientes en vixilancia a longo prazo. A xestión da rama de tipo IPMN asintomática de menos de 3 cm é controvertida.
Palabras clave: Neoplasma mucinosa papilar intraducial. Factores de pronóstico. Carcinoma invasivo. Supervivencia.
Introdución
O páncreas Endraducal Neoplasia papilar (NPMI) comprende un espectro de lesións con características biolóxicas e clínicas que espertaron gran interese na última década (1-6).
A primeira serie de casos clínicos de NPMI foi descrita por Ohhashi en 1982 e recibiu o seu nome por Sessa en 1994 (7,8).O feito de que o 20-30% do NPMI é multifocal e que o 5-10% pode afectar toda a glándula, xerou varias controversias en tratamento cirúrxico e seguimento destes pacientes (1-5).
Os feitos máis significativos da NPMI son as súas formas de presentación -Vanitor Ductal, de accesorios de conductos pancreáticos e progresión mixta e secuencial a partir de lesións incipientes, como o adenoma ao carcinoma in situ e ao carcinoma invasivo; Por iso, debe considerarse como unha lesión precursora do cancro de páncreas, especialmente nas lesións do ducto pancreático principal (9-13).
Para aclarar as controversias mencionadas, varias reunións de consenso sobre o diagnóstico e tratamento .. O obxectivo deste traballo é analizar os resultados do tratamento cirúrxico da NPMI eo seu acordo coas recomendacións de conferencias de consenso (14-16).
Material e métodos
entre Marzo de 1993 e setembro de 2009, 38 pacientes foron interviñeron por quistum tumores de páncreas, dos cales 15 foron diagnosticados con neoplasma papilar mucilado intraduccional (NPMI), obxecto deste estudo.
Unha análise retrospectiva das historias clínicas, Obxectar os síntomas principais, aqueles relacionados coa cirurxía, a histopatoloxía, o patrón de supervivencia e recorrencia. A indicación cirúrxica foi creada en sesión interdisciplinar, en base a diferentes exames de imaxe: tomografía multicort computerizada (TC), a ultrassonografia endoscópica (USE) con punção por agulla fina (PAAF), collangiopancreatography resonancia magnética (CPRM) e citologia segundo as directrices do Consenso Reunións mencionadas.
Nas lesións situadas na cabeza do páncreas, realizouse un proceso e corpo de páncreas, cefalic Duodenopancreatectomy (Krauss-Whipple intervención). En lesións centrais, realizouse a pancreatectomía central e no corpo e as lesións de cola, o fluxo ou a pancreatectomía distal foron realizadas. En pacientes con participación de todo o conducto de wirsung, realizouse a pancreatectomía total. En todos os casos, realizouse o estudo intraoperativo dos bordos de resección pancreáticos.
O diagnóstico da NPMI realizouse de acordo coa nomenclatura establecida pola Organización Mundial da Saúde (OMS) (17) ea conferencia de consenso realizado en Osaka en 2004 (15). Os tumores foron excluídos que presentaron un patrón similar ao Stroma de ovario e que foron diagnosticados como tumores químicos mucinosos (17).
O NPMI clasificouse en tres categorías: aqueles que afectaban o principal conducto pancreático, os orixinados no accesorio Ramas e neoplasos mixtos cando afectan ambos compoñentes. Os tumores clasificáronse no NPMI non invasivo e NPMI invasivo; Segundo os criterios de quen e os posteriormente publicados por Singh e Maitra (9,17).
Edges de resección foron estudados de acordo cos estándares AJCC (cancro de posta en escena) (18). A marxe de resección pancreática foi considerada positiva sempre que calquera grao de NPMI foi identificado microscópicamente.
A mortalidade operativa foi definida como a morte no mesmo ingreso hospitalario ou nos primeiros 30 días de período postoperatorio. A fístula pancreática foi definida cando as concentracións de amilase foron tres veces maior que o valor plasmático no drenaje percutáneo (19). A recorrencia foi definida como “local” na cama pancreática, “rexional” na cavidade peritoneal e “remota” se ocorreu no fígado, pulmón, ósos, etc. Os intervalos de confianza foron calculados co programa EPI Info 6.0, 4C. A supervivencia actuarial foi calculada segundo o método Kaplan-Meier, co programa SPSS, a versión 15.0.
Resultados
Na táboa resumiron as características clínicas máis relevantes da serie. A incidencia era similar en ambos sexos e cun rango de idade entre 33 e 79 anos (medianos 61 anos, media de 63,2 anos); Límite de confianza (LC): 95%; 55.95-70.44.
Os síntomas da presentación eran xeralmente anodinos, aínda que cinco pacientes estudados con síntomas específicos, como ictericia, febre, episodios previos de pancreatite e síndrome constitucional.
máis A proba de diagnóstico usada foi a CT-abdominal con ultrasonografía endoscópica (uso) e perforación de agullas fixas. A citoloxía foi positiva para o tumor mucinoso en 8 dos 9 casos nos que se realizou (88,8% de sensibilidade). En dous pacientes, obtívose material insuficiente.
Oito dos neoplasos situáronse na cabeza do páncreas, en tres pacientes, difúndese de forma difusa á principal canle pancreática e no corpo afectado do NPMI restante -Cola, proceso non acurtado e en dous casos ao corpo do páncreas.Separtáronse seis duodenopancreatectionectectections, catro pancreatectomies totais, dúas pancreatectomies centrais, dúas pancreatectomies parciais e unha pancreatectomía distal.
complicacións rexistráronse en 6 pacientes (40%). Catro presentaron “coleccións no leito cirúrxico”, dos cales 3 necesidade de drenaxe transgástrico usar. Un enfermo, que foi practicado unha enucleación, desenvolveu unha fístula pancreática a catro días da descarga e foi tratada con drenaxe percutánea. Outro paciente desenvolvido baleirado gástrico retardado. A estancia media hospital foi de 10 días (alcance 4-22 días). Non houbo mortalidade operativa.
En cinco casos o NPMI foi mesturado e en catro NPMI afectou o ducto pancreático principal (Figura 1). Nos restantes seis a NPMI afectou as ramas de accesorios pancreáticas (Fig. 2). En tres casos, a displasia lixeira foi descrita na marxe de resección pancreática e non se estendeu a resección.
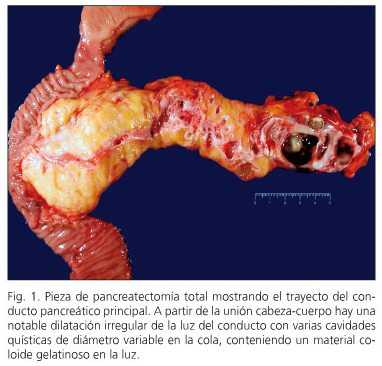
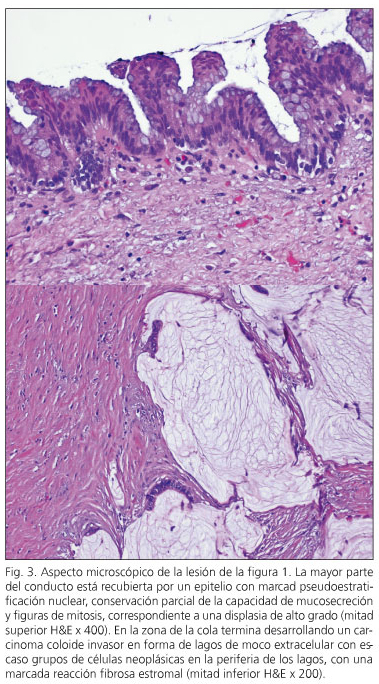
En tres pacientes, a neoplasia intraepitelial pancreática (“PANIN” foi detectada. En dous casos foi o tipo Panin-1A, lesións planas con atypia mínima e unha lesión panin-2 con atypia moderada. Dous pacientes tiñan NPMI con displasia de alta calidade -Cincinoma in situ- (casos de 6 e 10) e outros tres pacientes (casos de 1, 2 e 3) presentaron un carcinoma invasivo con nodos linfáticos negativos (Figura 3). Dous deles están libres de enfermidades aos oito e nove anos de seguimento, mentres que un está libre de enfermidades a tres anos de pancreatectomía e despois de ser reinterente a partir dunha recorrencia rexional a 15 meses de pancreatectomía.
Un paciente (caso 4) morreu a cinco anos e medio dunha recorrencia de ganglion lumpal de páncreas adenocarcinoma. O resto dos pacientes permanecen vivos e libres de enfermidades. Todos os pacientes foron revisados cun rango de seguimento entre un mes e medio e nove anos; Obtendo unha supervivencia actuarial de 105.133 meses cun índice de confianza do 95% (86.264-124,003) e unha supervivencia á recorrencia ou morte de 98.355 meses (intervalo de confianza: 76.761-119.949). Na Figura 4 a supervivencia actuarial é recollida ata a presenza de recorrencia ou morte.
Discusión
A primeira serie de NPMI foi descrita por OHHASI en 1982 (7,20). Posteriormente Sessa et al. Caracterizaron a lesión co termo empregado actualmente (8).
Finalmente, a Organización Mundial da Saúde (OMS) en 1996, con motivo dunha clasificación do exócrino do páncreas, definiu a NPMI como Papilary A proliferación dun columnar epiteliano eluggestor no conducto principal ou nos accesorios de conductos pancreáticos (17). Dita clasificación aclarou unha serie de termos confusos que dificultaron a coñecer a súa evolución natural e realizar avaliacións comparativas entre diferentes autores (5,6).
Na última década houbo unha gran proliferación de publicacións referidas Ao NPMI e estímase que entre 8 e 20% das resecas pancreáticas nos centros de referencia débese a esta entidade (22-24). Un dos aspectos máis únicos son as súas formas de presentación -cutal, accesorio pancreático e unha rama mixta, e a que se considera como unha lesión de premalignación, na que a displasia de secuencia lixeiramente in situ, o carcinoma invasivo está ben establecido. Nas pezas de resección pancreáticas, a neoplasia intraepitelial pancreática (PANIN) foi descrita, dividida á súa vez en varios graos de teléfono móbil (PANIN-1, PANIN-2, PANIN-3). As lesións de Panin-1, á súa vez, están subdivididas en tipo de avión (PANIN-1A) e tipo papilar (PANIN-1B).
Debido a diferentes controversias, realizáronse varias reunións de consenso e emitidas isto (14-16). Aínda que a nosa serie é limitada, representa a segunda na literatura española e expresa todas as lesións NPMI, desde a súa forma máis benigna ao carcinoma invasivo. O perfil demográfico é similar a outras series, presentándose en idades relativamente avanzadas (70-80 anos); O que foi capaz de elevar unha actitude “nihilista” sobre o tratamento cirúrxico destes pacientes.
A localización máis frecuente da cabeza e no corpo do páncreas (9 dos 15 casos) e os síntomas da presentación , coincide cos descritos noutras obras (3,21-25). Na nosa serie, os catro casos con signos de malignidade -carcinoma in situ ou carcinoma invasivo foron aqueles que tiñan afectación do conducto principal ou mixto, un feito que coincide coa maioría dos autores (24.26-29).
Un paciente morreu a 66 meses, desde unha recurrencia de ganglio dun adenocarcinoma páncreas (caso 3) e que presentou o tipo de afectación mixta, o patrón morfolóxico cunha maior incidencia de lesións invasivas na maior serie (24 , 26-30). A posible recorrencia ou tumor “de novo” pancreático apareceu a cinco anos e medio, que é o tempo estimado (5-7 anos) para completar a evolución do adenoma ao carcinoma (9,11,12,24,27). Nunha serie moi similar á nosa, Adsay et al. Describen dous pacientes cun NPMI non invasivo que morreu a 65 meses da cirurxía de difusión locorrexional dun páncreas adenocarcinoma (21). Nun dos pacientes e carcinoma invasivo (caso 13), houbo unha recorrencia peritoneo a 15 meses de pancreatectomía total. Dito enfermo permanece vivo e libre de enfermidades en 3 anos despois de ser reinterado.
A participación multifocal no páncreas foi descrita ata o 30% dos pacientes – con variante “conducto de accesorios” e publicou 10 % Recurrences en pacientes con NPMI non invasivo, sometido a pancreatectomies parciais e marxes negativos (31,32). Adenocarcinoma de páncreas sincronizado ou metracronico foi descrito no 9,2% de 76 pacientes en NPMI (33). Tres dos pacientes presentáronse afectación da marxe de resección pancreática con displasia suave. Hai un acordo no que non é necesario unha resección máis ampla do páncreas (11,16,15,32,34).
O resto dos pacientes permanecen libres de enfermidades cun rango de seguimento entre 6 meses e oito anos. Non houbo mortalidade operativa e a morbilidad do 40% atópase no rango referido por centros acreditados con experiencia en resolucións pancreáticas (35.36). A hospitalización media foi de 10 días, cun alcance de 5 e 22 días. Da experiencia publicada conclúese que os NPMIs de Ductal e Afección Mixta deben resumirse quirúrgicamente coa confirmación intraoperatoria da ausencia de invasión da resección pancreática, estimada unha supervivencia do 80% en cinco anos no caso do NPMI invasivo e 30 % en casos con carcinoma invasivo. Na Táboa II presentamos a recente experiencia de gran serie (26,31,37-41).
Xa comentamos que a incidencia do carcinoma invasivo é máis frecuente nas lesións do conducto principal do Páncreas (75%), que nas lesións orixináronse en dutos de accesorios (25%) (15,24,30,42,43). Estes orixes xustifican o estudo de Salvia et al. No que realizaron 89 pacientes con accesorios de tipo NPMI, asintomático, dun tamaño de menos de 3,5 cm e valores CA-19.9 normais. No devandito estudo, só cinco pacientes (6%) desenvolveron un aumento de tamaño e foron resecados sen signos de malignidade (44,45). Resultados similares foron publicados por Tanno et al., Ao seguimento de 81 pacientes por 61 meses (46).
Seguindo este estudo – grao de evidencia 3- As orientacións prácticas recomendan o seguimento de Estas lesións que afectan exclusivamente os accesorios asintomáticos pancreáticos, menores de 3 cm de diámetro e que non presentan nódulos dentro (15,44,47,48). O intervalo de seguimento – CT e EU – non debe exceder seis meses; Debido á maior incidencia do adenocarcinoma pancreiano metacrónico no resto da glándula pancreática (49,50).
Con base en experiencias previas, podemos concluír que a NPMI co seu principal conducto e tipo mixto é debida con confirmación histolóxica de ausencia de invasión de bordos de resección. En casos de NPMI non invasivos, unha supervivencia estímase en 5 anos do 80% e un 30% nos casos que presentan un carcinoma invasivo. Tablada II resume a experiencia das series máis importantes.
![]() para a correspondencia:
para a correspondencia:
Javier A. Cienfuegos.
Departamento de Cirurxía Xeral.
Clínica Universidade de Navarra.
Avda. Pius XII, 36. 31008 Pamplona, Navarra.
Correo electrónico: [email protected]
Recibido: 24-11-09. Aceptado: 09-02-10.
BIBLIOGRAFÍA
1. Garcea G, NGO SL, Rajesh A, Neal CP, Pollard CA, Berry DP, et al. Lesións císticas do páncreas. Un dilema de diagnóstico e xestión. Pancreatoloxía 2008; 8: 236-51.
2. Goldsmith jd. Neoplasos císticos do páncreas. AM J Clin Pathol 2003; 119 (1): S3-S16.
3. Basturk ou, COBAN I, ADSAY NV. Cistos pancreáticos: clasificación patolóxica, diagnóstico diferencial e implicacións clínicas. Arch Pathol Lab Med 2009; 133: 423-38.
4. Adsay NV. Lesións císticas do páncreas. Patoloxía moderna de 2007; 20: 571-93.
5. I Seixo Ríos S, Lariño Nonia J, igrexas García J, Lozano León a, Domínguez Muñoz JE. Tumor papilar mucinoso e intraduccional: enfoque de diagnóstico e terapéutico. Gastroenterrol Hepatol 2008; 31: 92-7.
6. Fernández-Esprach G, Pellisé M, Ginès A.Tumor Mucinoso Papilar Intraductal del Páncreas: UNA ENTIDAD MÁS DESCONOCIDA QUE INFRECUENTE. Gastroenterol Hepatol 2003; 26: 562-70.
7. Ohhashi K, Murakami Y, Takekoshi T. Catro casos de cancro de pancreático secreto mucoso (Abstr). PROG DIAGE ENDOSC 1982; 20: 348-51.
8. Sessa F, Solcia e Capella C, Bonato M, Scarpa A, Zamboni G, et al. Os tumores papilares papilares intraducitos representan un grupo distinto de neoplasias pancreáticas: unha investigación de diferenciación de células tumorais e anomalías K-RAS, P53 e C-ERBB-2 en 26 pacientes. Virchows Arch 1994; 425: 357-67.
9. Singh M, Maitra A. Precursor Lesións de cancro pancreático: patoloxía molecular e implicacións clínicas. Pancreatoloxía 2007; 7 (1): 9-19.
10. HRUBAN RH, Maitra A, Kern Se, Goggins M. Precursores ao cancro de pancreático. Gastroenterol Clin North Am 2007; 36: 831-49.
11. Maitra A, Fukushima N, Takaori K, HRUBAN RH. Precursores do cancro pancreático invasivo. ADV Anat Pathol 2005; 12: 81-91.
12. Maitra A, Hruban Rh. Cáncer pancreático. Annu Rev Pathol Mech Dis 2008; 3: 157-88.
13. Serikawa M, Sasaki T, Fujimoto y, Kuwahara K, Chayama K. Xestión do Neoplasia Papilar-Mucillario Intraducto do Páncreas: Estratexia de tratamento baseado na clasificación morfolóxica. J Clin Gastroenterol 2006; 40: 856-62.
14. Furukawa T, Klöppel G, Volkan Adsay N, Albores-Saavedra J, Fukushima N, Horii A, et al. Clasificación de tipos de neoplasma papiloso intraduccional-mucinoso do páncreas: un estudo de consenso. Virchows Arch 2005; 447: 794-9.
15. Tanaka M, Chari S, Adsay V, Fernandez-del Castillo C, Falconi M, Shimizu M, et al.; Asociación Internacional de Pancreatoloxía. Pautas de consenso internacional para a xestión de neoplasos papilares papilares intraducitos e neoplasos císticos mucinosos do páncreas. Pancreatoloxía 2006; 6: 17-32.
16. HRUBAN RH, TAKAORI K, Klimstra DS, Adsay NV, Albores-Saavedra J, Biankin Av, et al. Un consenso ilustrado sobre a clasificación de neoplasia intraepitelia pancreática e neoplasos papilares papilares intraductos. Am j Surg Pathol 2004; 28: 977-87.
17. Kloppel G, Solcia e, Longnecker DS, Capella C, Sobin LH. Tipografía histolóxica de tumores do páncreas exocrino. En: Organización Mundial da Saúde Clasificación Internacional de Tumores. 2ª ed. Berlín: Springer; 1996. p. 11-20.
18. EDGE SB, BYRD DR, COMPTON EC, FRITZ AG, Greene FL, Trotti A, Editors. Excrine e endocrino páncreas. En: AJCC. Manual de posta en escena do cancro. 7ª ed. Nova York: Springer-Verlag; 2010. p. 241-9.
19. Bassi C, Dervenis C, Buturrini G, Fingerhut A, Yeo C, Izbicki J, et al.; Grupo de estudo internacional sobre definición de fístula pancreática. Fistula pancreática postoperatoria: como grupo de estudo internacional (ISGPF) definición. Cirurxía 2005: 138: 8-13.
20. Ohhashi K, Takagi K. ERCP e diagnóstico de imaxe de cancro pancreático (Abstr). Endoscopia 1980; 77: 1493-5.
21. Adsay NV, Conlon KC, Zee Sy, Brennan MF, Klimstra DS. Neoplasmos papilos papilares intraductos do páncreas: análise de into e carcinomas invasivos en 28 pacientes. Cancro 2002; 94: 62-77.
22. Raut CP, Cleary Kr, Staerkel GA, Abbruzzesse JL, Wolff Ra, Lee JH, et al. Neoplasos mucinantes papilares intraducitos do páncreas: efecto da invasión e estado de marxe pancreático sobre a recorrencia e a supervivencia. Ann Surg Oncol 2006; 13: 582-94.
23. Ubiña Aznar e, Rivera Irigoin R, Méndez Sánchez I, Fernández Moreno N, García Fernández G, Sánchez Cantos A. Signos endoscópicos de tumor mucínico do páncreas. Rev esp enferm Dig 2007; 7: 413-4.
24. SOHN TA, YEO CJ, Cameron JL, HRUBAN RH, FUKUSHIMA N, CAMPBELL KA, et al. Neoplasos mucinantes papilares intraductos do páncreas: unha experiencia actualizada. Ann Surg 2004; 239: 788-97.
25. Marín Serrano e, Macías Rodríguez MA, Rendón Unceta P, Pérez Requena J, Guillén Mariscal P, Martín Herrera L. Pancreatic Intraducto Papilar Mucinoso Tumor. Rev esp enferm Dig 2005; 11: 836-7.
26. Schnelldorfer T, Sarr MG, Nagorney DM, Zhang L, SMYRK TC, Qin R, et al. Experiencia con 208 resexas para a neoplasia mucinosa pápilar intraduccional do páncreas. ARCH Surg 2008; 143: 639-46.
27. Salvia R, Fernández-del Castillo C, Bassi C, Thayer SP, Falconi M, Mantovani W, et al. Neoplasmas pápilares papilares intraduciais do páncreas do páncreas: predictores clínicos de malignidade e supervivencia a longo prazo seguindo a resección. Ann Surg 2004; 239: 678-85.
28. Yang AD, Melstrom LG, Bentem DJ. Resultados despois da pancreatectomía por neoplasos papilares papilares intraductos do páncreas: unha experiencia institucional. Cirurxía 2007; 142: 529-34.
29. D’Angelica M, Brennan MF, Suriawinata AA, Klimstra D, Conlon KC. Neoplasos mucinantes papilares intraducitos do páncreas: unha análise de características clinicopatolóxicas e resultado. Ann Surg 2004; 239: 400-8.
30. Rodríguez Jr, Salvia R, Crippa S, Warshaw Al, Bassi C, Falconi M, et al.Branch-duct Intraductal pápilar pápilar neoplasos: observacións en 145 pacientes que sufriron resección. Gastroenteroloxía 2007; 133: 72-9.
31. Branco R, D’Angelica M, Katabi n, Tang L, Klimstra D, Fong y, et al. Fate da remanente páncreas tras a resección de neoplasma mucilada intraducial intraducial non invasiva. J am Coll Surg 2007; 204: 987-93.
32. Chari St, Yadav D, SMYRK TC, DIMAGNO EP, MILLER LJ, RAIMONDO M, et al. Estudo da recorrencia logo da resección cirúrxica do neoplasma mucinoso papilar intraduccional do páncreas. Gastroenteroloxía. 2002; 23: 1500-7.
33. Yamaguchi K, Ohuchida J, Ohtsuka T, Nakano K, Tanaka M. Intraducto tumor papilar-mucilado do páncreas concomitante con carcinoma ductal do páncreas. Pancreatoloxía 2002; 2: 484-90.
34. ANDEA A, Sarkar F, Adsay Vn. Correlacións de clínicopatolóxica da neoplasia intraepitelial pancreática: unha análise comparativa de 82 casos con e 152 casos sen adenocarcinoma ductal pancreático. Mod Pathol 2003; 16: 996-1006.
35. Joseph B, Morton JM, Hernandez-Boussard T, Rubinfeld I, Faraj C, Velanovich V. Relación entre o volume hospitalario, os recursos clínicos do sistema e a mortalidade en resección pancreática. J am Coll Surg 2009; 208: 520-7.
36. Van Heek NT, Kuhlmann KF, Scholten RJ, De Castro SM, Busch Or, Van Gulik TM, et al. Volume e mortalidade hospitalaria despois da resección pancreática: unha revisión sistemática e unha avaliación de intervención nos Países Baixos. Ann Surg 2005; 242: 781-8.
37. Wada K, Kozarek Ra, Traverso W. Resultados tras a resección de neoplasos papilares intraduciais invasivos e non invasivos do páncreas. Am j Surg 2005; 189: 632-7.
38. Raut CP, Cleary Kr, Staerkel GA, Abbruzzesse JL, Wolff Ra, Lee JH, et al. Neoplasos mucinantes papilares intraducitos do páncreas: efecto da invasión e estado de marxe pancreático sobre a recorrencia e a supervivencia. Ann Surg Oncol 2006; 13: 582-94.
39. Nakagohri T, Kinoshita T, Konishi M, Takahashi S, Gotohda N. RESULTADO CIRUMICA DE NEOPLASMS PAPILLARES PAPILLARIOS INTADUCALES DO PÁCINA. Ann Surg oncol 2007; 14: 3174-80.
40. Nara S, Shimada K, Kosuge T, Kanai Y, Hiraoka N. Minimally Intrante intraducto carcinoma papilar-mucinoso do páncreas: estudo de clinicopatolóxica de 104 neoplasos papilares papilares intraductos. Am j Surg Pathol 2008; 32: 243-55.
41. Nagai k, doi r, kida a, kami k, kawaguchi y, ito t, et al. Neoplasos mucinarios papilares intraducitos do páncreas: características de clinicopatolóxicas e seguimento a longo prazo despois da resección. World J Surg 2008; 32: 271-8.
42. Terris B, Ponsot P, Paye F, Hammel P, Sauvanet A, Molas G, et al. Os tumores mucénicos papilares intraducitos do páncreas confinados a dutos secundarios mostran características patolóxicas menos agresivas en comparación cos que implican o principal conducto pancreático. Am j Surg Pathol 2000; 24: 1372-7.
43. Kobari M, Egawa S, Shibuya K, Shimamura H, Sunamura M, Takeda K, et al. Os tumores mucinosos papilares intraducitos do páncreas compoñen 2 subtipos clínicos: diferenzas nas características clínicas e xestión cirúrxica. Arch Surg 1999; 134: 1131-6.
44. Salvia R, Crippa S, Falconi M, Bassi C, Guarise A, Scarpa a, et al. Branch-duct Intraductal pápilar pápilar neoplasos do páncreas: para operar ou non operar? Gut 2007; 56: 1086-90.
45. Ghaneh P, NEOPTOLEMS J. Un novo enfoque para xestionar neoplasmas pancreatias papilares papilares intraducias. Gut 2007; 56: 1041-4.
46. Tanno S, Nakano Y, Nishikawa T, Nakamura K, Sasajima J, Minoguchi M, et al. Historia natural da rama Ducto Intraductal neoplasos papilares papilares do páncreas sen nódulos murales: resultados de seguimento a longo prazo. Gut de 2008; 57: 339-43.
47. Bassi C, Sarr MG, Lillemoe KD, Reber Ha. Historia natural de neoplasmas papilares papilares intraductas (IPMN): evidencias actuais e implicacións para a xestión. J Gastrointest Surg 2008; 12: 645-50.
48. Woo sm, ryu jk, lee sh, yoon wj, kim yt, yoon yb. Rama Duct Intraducto neoplasos papilares papilares nunha serie retrospectiva de 190 pacientes. BR J SURG 2009; 96: 405-11.
49. Tanno S, Nakano Y, Koizumi K, Sugiyama Y, Nakamura K, Sasajima J, et al. Adenocarcinomas ductos pancreaticos en pacientes de seguimento a longo prazo con rama neoplasos papilares pápilares. Páncreas 2010; 39: 36-40.
50. Belyaev O, Seeling MH, Muller CA, Tannapfel A, Schmidt Nós, UHL W. Intraductos neoplasos papilares papilares do páncreas. J Clin Gastroenterol 2008; 42: 284-94.