Na antigüidade, houbo unha gran controversia entre os eruditos da física con respecto á composición esencial de todo o que observaron. Neste contexto, algúns filósofos da Grecia antiga levantaron que cada forma de materia estaba composta por partículas que constituían tal sustancia: un anaco de papel podería dividirse case incontables veces ata que se descompoñen en partículas de papel primordiais; Un anaco de óso estaría composto por partículas óseas primordiais; A auga do mar estaría constituída por miles de pequenas partículas de auga de mar. Tales partículas elementais foron chamadas “homeomerias” e representaban a idea incipiente de que as cousas materiais estaban compostas por pequenos ladrillos eternos, idea que evolucionaría máis tarde no concepto de “Atom”. De feito, a palabra “átomo” foi igualmente acuñada polos filósofos gregos (atribuíndo o mérito especialmente ao demócrito e ao seu enfoque “o que sucedería si aos grans de area, que veñen de fragmentar as rochas, aínda estou fragmentado?”) , para designar as partículas “indivisibles” e “indestructibles” que construíron todo o que vemos.
Actualmente, sabemos que, de feito, o asunto que sabemos está constituído por unidades que seguimos chamando átomos. Non obstante, a diferenza da concepción orixinal, temos probas suficientes para afirmar que os átomos non pertencen a un número ilimitado de sustancias: non hai óso, carne ou átomos de auga. Todas estas sustancias complexas xorden, de feito, desde a combinación dun determinado número de especies químicas puras que coñecemos como “elementos químicos”, que recollemos no modelo da táboa periódica, cada unha delas constituída por un tipo específico de átomo. Os átomos dos diferentes elementos químicos combinan entre eles para dar lugar a todas as sustancias que existen e, ademais, son aquelas que dan lugar ás reaccións químicas que ocorren. Por Atom, entendemos, entón, á menor unidade de materia con A súa propia identidade e que é capaz de participar nunha reacción.
Por outra banda, tamén sabemos que os átomos son divisibles en pequenas unidades que coñecemos, como un todo, como “partículas subatómicas”. Hai unha cantidade considerable de partículas subatómicas e non todas forman parte do tema, senón nos átomos, temos unha estrutura moi definida: un núcleo constituído por un conglomerado de partículas con carga positiva (protones) e carga neutra (neutróns) en número variable e unha cortiza de partículas con carga negativa (electróns). As cargas positivas compensan as cargas negativas, de xeito que, nos átomos neutros, o normal é que hai o mesmo número de protóns como electrón.
O número de protóns é dado polo “número atómico” , Que identifica o elemento químico que é. Por exemplo: o átomo con un protón no seu núcleo é do elemento “hidróxeno”; O átomo con dous protóns, de “helio”; o átomo de tres protóns, “litio”, etc. Na táboa periódica, os elementos son ordenados desde inferior a máis dependendo do seu número atómico (Z). Doutra banda, o número de masa (a) representa o número de protóns e neutróns, que son aqueles que concentran a maior parte da masa do átomo. Non obstante, o número masivo dun elemento pode variar, de xeito que cada elemento ten varias versións de si mesmo, o que coñecemos como isótopos. Nos isótopos, o número de neutróns varía, que cambia a masa do átomo; Así, moitos isótopos son inestables e descompoñen co paso do tempo, o que causa “radioactividade”.
Este coñecemento foi o resultado da acumulación progresiva, ao longo do século XIX e XX, de evidencias experimentais que foron Mellorar os modelos atómicos que se desenvolveron a partir da concepción orixinal do átomo. O modelo de Thompson concibiu o átomo como unha sólida esfera positiva de carga cos electróns que foi o primeiro modelo que asociaba as cargas eléctricas ao átomo; o anterior un, o de Dalton, non o contempla. Con todo, con experimentos de Rutherford, foi visto que o átomo era na súa maioría espazo baleiro, con cargas positivas nun núcleo rodeado por unha cortiza de electróns. Bohr definiu que estes electróns foron distribuídos en diferentes niveis de enerxía, baseados en espectros atómicos. Co desenvolvemento, no século XX, da teoría cuántica, o modelo de átomo de Bohr foi modificado ata o modelo actual, o modelo mechanacungal, influenciado polas achegas de científicos como Sommerfield, Schrödinger, Broglie ou Planck.
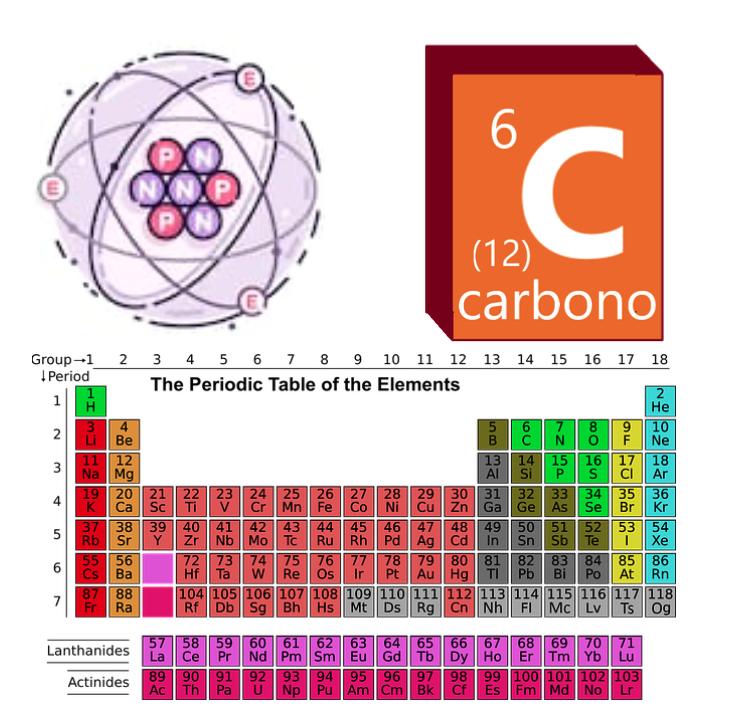
Os átomos non son xa que normalmente están representados, pero realmente non temos moitas formas de atrae-los comprensiblemente.Polo tanto, adoitamos adoptar modelos didácticos sinxelos como o modelo Rutherford ou o modelo Bohr, onde podemos visualizar facilmente que os átomos están constituídos a partir dunha serie de protóns, neutróns e electróns intuitivamente. Na táboa periódica, os átomos son ordenados segundo o seu número atómico (Z). O número de masas pode cambiar. O carbono, por exemplo, ten z = 6 e un número de masa variable. O isótopo máis común é o carbono-12 (en = 12), pero tamén hai outros isótopos moi comúns, como o carbono-14 (AT = 14), que se desintegra de forma radioactiva con certa facilidade e úsase para os restos arqueolóxicos de Dattream.