Un gas ideal ou un gas perfecto é o que a forza da atracción ou a repulsión molecular entre as partículas que o compoñen, polo tanto, considérase insignificante todo o seu interno A enerxía é cinética, é dicir, a enerxía asociada ao movemento.
nun gas así, as partículas adoitan estar moi lonxe de algúns Dos demais, aínda que de cando en vez golpearon entre eles e coas paredes do recipiente.
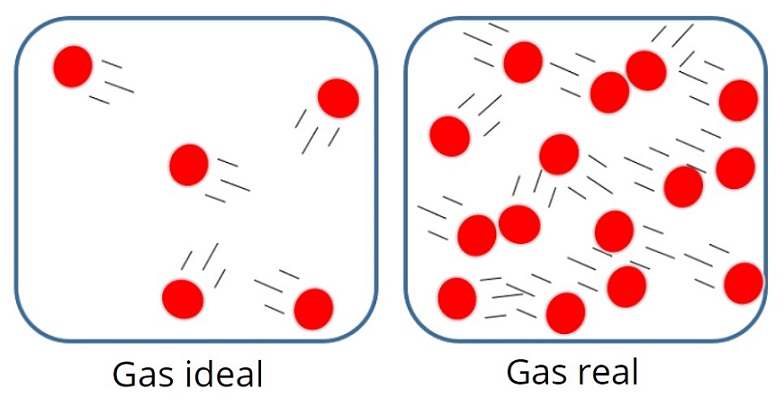
Por outra banda, no gas ideal non importa o tamaño ou a masa das partículas , xa que se supón que o volume ocupado por eles é moi pequeno en comparación co volume do propio gas.
é, por suposto, é só unha aproximación, porque en realidade sempre hai algún grao de interacción entre os átomos e os átomos Moléculas Tamén sabemos que as partículas ocupan espazo e teñen masa.
Sen prexuízo destes supostos funcionan moi ben en moitos casos, como en baixo molecular gases de peso, nunha boa variedade de presións e temperaturas.
Con todo, os gases de peso moleculares elevados, especialmente a altas presións ou baixas temperaturas, non se comportan en todos os gases ideais e outros modelos creados co propósito de describir máis con máis precisión.
primeiros experimentos
As leis que rexen os gases son empíricos, é dicir, xurdiron da experimentación. Os experimentos máis notables realizáronse ao longo do século XVII, XVIII e principios do século XIX.
Primeiro de todo son os de Robert Boyle (1627-1691) e Edme Mariotte (1620-1684), aqueles que de forma independente modificou a presión nun gas e rexistrou o seu cambio de volume, atopando que eran inversamente proporcionales: a maior presión, menor volume.
Para a súa parte, Jacques Charles (1746-1823) estableceu que o volume ea temperatura absoluta foron directamente proporcionales , sempre que a presión permanecese constante.
Amadeo Avogadro (1776-1856) descubriu que dous volumes idénticos de diferentes gases que conteñen A mesma cantidade de partículas, sempre que a presión e a temperatura fosen iguais. E finalmente Joseph de Gay Lussac (1778-1850), dixo que ao manter o volume fixado, a presión nun gas é directamente proporcional á temperatura.
As leis de gases ideais
Estes descubrimentos son expresados por fórmulas simples, pedindo presión, V ao volume, n o número de partículas e t a temperatura ideal de gas:
Lei de Boyle-Mariotte
Tanto A medida que se soluciona a temperatura, ocorre o seguinte:
p⋅v = constante
Lei de Charles
Cando o gas está baixo a presión constante:
v / t = constante
Lussac gay Lei
Manter o gas a un volume fixo é certo que:
p / t = constante
Lei de avogadro
Volumes de gas idénticos, baixo as mesmas condicións de presión e temperatura teñen o mesmo número de partículas. Polo tanto, podemos escribir:
V α n
onde n é o número de partículas e α é o símbolo de proporcionalidade.
Modelo de gas ideal
O modelo de gas ideal describe un gas tal que:
– cando as partículas interactúan por moi pouco tempo, a través de choques elásticos, nos que se conservan a cinética de impulso e enerxía.
-sus partículas constituyentes son puntuais, é dicir, noutras palabras, o seu diámetro é moito menor que a distancia media que corren a través dunha e outra colisión.
As forzas intermoleculares non existen.
-A a enerxía cinética é proporcional á temperatura.
Os gases monatómicos -que os átomos non están ligados entre si e baixo peso molecular, baixo a presión estándar e as condicións de temperatura (presión atmosférica e 0 ºC temperatura), ten un comportamento de tal forma que o modelo de gas ideal sexa unha descrición moi boa para eles.
ecuación ideal de gas de gas
leis do Os gases antes de enunciados combínanse para formar a ecuación xeral que regula o comportamento de gas ideal:
v α n
v α t
Polo tanto:
V α n⋅t
Ademais, da lei de Boyle:
v = constante / p
entón podemos afirmar que:
v = (constante XN⋅T) / p
A constante chámase constante de Gase e denotada por letra R.Con esta elección, a ecuación ideal do gas Estado relaciona catro variables que describen o estado do gas, é dicir, n, r, p e t, quedando:
p⋅v = n⋅r⋅t
Esta ecuación relativamente sinxela é consistente coas leis dos gases ideais. Por exemplo, se a temperatura é constante, a ecuación é reducida á Lei de Boyle-Mariotte.
A constante de gas
Como dixemos antes, baixo condicións estándar de temperatura e Presión, isto é, a 0 ° C (273.15 K) e 1 atmosfera de presión, o comportamento de moitos gases está preto do gas ideal. Nestas condicións, o volume de 1 mol de gas é de 22.414 l.
Neste caso:
r = (p⋅v) / (n⋅t) = (1 ATM x 22.414 L) / (1 mol x 273.15 k) = 0.0821 ATM ⋅ l / mol ⋅ k
A constante de gas tamén se pode expresar noutras unidades, por exemplo no sistema internacional se vale a pena :
r = 8,314 j⋅ mol-1⋅ k-1
Cando un problema está resolto pola lei dos gases ideais, é conveniente prestar atención ás unidades nas que A constante exprésase, xa que como podemos ver, hai moitas posibilidades.
comportamento dun gas ideal
Como dixemos, calquera gas baixo condicións estándar de presión e temperatura e iso É un peso molecular baixo, compórtase moi de cerca o gas ideal. Polo tanto, a ecuación p⋅v = n⋅r⋅t é aplicable para atopar a relación entre as catro variables que o describen: n, p, v e t.
Deste xeito podemos imaxinar unha porción de gas ideal encerrado nun recipiente e formado por pequenas partículas, que ocasionalmente chocan entre si e coas paredes do recipiente, sempre elástico.
é o que vemos na próxima animación dunha porción de helio, un gas nobre e monoatómico:

Exemplos de gases ideais
Un gas ideal é un gas hipotético, é dicir, é unha idealización , con todo, na práctica, moitos gases compórtanse dun xeito moi próximo, facendo posible que o modelo P⋅v = n⋅r⋅t arroxa resultados moi precisos.
Gases nobres
Exemplo de gases que se comportan como ideais baixo condicións estándar son gases nobres, así como gases lixeiros: hidróxeno, osíxeno e nitróxeno.
o globo aerostático

Para o globo de aire da Figura 1 A lei Charles pode ser aplicada: O gas está quente, polo tanto, o aire que enche o globo Expande e como consecuencia sobe.
O helio globos
Helium é, xunto co hidróxeno, o elemento máis común do universo e, con todo, é escaso na Terra. Como é un gas nobre, é inerte, a diferenza do hidróxeno, é por iso que os globos cheos de helio son moi utilizados como elementos decorativos.