orixinais
Estudo de reaccións adversas relacionadas coa infusión de Paclitaxel e DoceTaxel
Estudo sobre o Reaccións publicitarias relacionadas con Paclitaxel e DoceTaxel Infusion
i. J. Castro1, M. Pons Busom1, GI Ballesteros Cabañas1, E. Ramió Montero1, A. Álvarez Méndez2, R. De Castro Chivato3, M. Centelles Ruiz4
1Service of Pharmacy, Capio Hospital Universitari Sagrat Cor, Barcelona, España.
SERVIZO DE PERMARACIÓN DE 2NFERMERA, Capio Hospital Universitario Sagrat Cor, Barcelona, España.
Hospital de día de 3enfermera, Capio Hospital Universitario Sagrat Cor, Barcelona, España.
4Songoloxía, Capio Hospital Universitario Sagrat Cor, Barcelona, España.
Este traballo foi parcialmente presentado como unha comunicación de póster no 56º Congreso Nacional da Sociedade de Pharmacy Santiago que se celebrou en Santiago de Compostela Do 18 ao 21 de outubro de 2011.
Xestión de correspondencia
Resumo
Obxectivo: determinar a incidencia de reaccións á infusión de Paclitaxel e DoceTaxel e as posibles causas que poden desencadearlas.
MÉTODO: Estudo de cohorte de Infusións Paclitaxel e DoceTaxel realizadas nun hospital de terceiro nivel, de xullo de 2010 a decembro de 2011 (18 meses). Para cada infusión, rexistráronse os datos clínicos do paciente e os que se refiren aos taxanos xestionados. Dada a aparición dunha reacción durante a infusión, especificouse: tipo, gravidade e se forzou a suspensión do tratamento. Consultáronse historias clínicas e ordes médicas. O seguimento das infusións realizouse contactando coas enfermeiras do hospital. Un estudo descritivo das variables máis relevantes incluídas no seguimento realizouse e analizou se algún deles podería influír na aparición de reaccións.
Resultados: Durante o período de estudo, 357 infusións de Paclitaxel e DoceTaxel foron administradas a 92 pacientes: idade media de 61,4 anos (de 11,1), 50,0% mulleres. Detectáronse 9 reaccións infusionas que afectaron a 8 pacientes, todos causados por DoceTaxel (χ2 = 8.3, P = 0.004); 14,5% dos pacientes que o levaron, e sempre durante o primeiro ou segundo ciclo de tratamento. As variables asociadas significativamente coa aparición de reaccións foron: pulmón neoplasma (P < 0,005), esquema docetaxel-cisplatin (p < 0,005) , Recibe a droga na primeira liña (p = 0,021) e a enfermidade inconsciente (p = 0,014).
Conclusións: no noso centro hospitalario, Docataxel é o Taxane que causou máis problemas de seguridade durante a súa infusión.
Palabras clave: Paclitaxel; Docataxel; Reacción de hipersensibilidad.
Resumo
Obxectivo: Determinar a incidencia de Reactos de Infusión de Paclitaxel e DoceTaxel e as causas probables que poidan desencadearlas.
Método: estudo de cohorte das infusións de Paclitaxel e DoceTaxel realizadas nun hospital terciario a partir de xullo de 2010 a decembro de 2011 (18 meses). Para cada infusión, rexistráronse os datos clínicos e os datos relacionados coa droga. Cando se produciu unha reacción durante a infusión, especificouse os seguintes datos: tipo, gravidade, se se necesitaba a retirada do tratamento. Revisáronse as ordes de gravación clínica e tratamento. O seguimento das infusións fíxose contactando coas enfermeiras hospitalarias do día. Un estudo descritivo foi feito para as variables máis relevantes incluídas no seguimento e analizamos se algún deles podería ter influencia sobre a aparición das reaccións.
Resultados: Durante o período de estudo, 357 Paclitaxel e DoceTaxel infusións foron administradas a 92 patantes: media idade de 61,4 anos (SD 11.1), 50,0% eran mulleres. 9 reacciones de infusión que afectan a 8 patantes ocorreron, todas elas causadas por DOCETAXEL (χ2 = 8.3, P = 0.004); 14,5% dos pacientes que se regalan e sempre durante o primeiro ou segundo ciclo de tratamento. As variables asociadas significativamente á aparición da reacción: cancro de pulmón (P < 0.005), docetaxel-cisplatin réxime (p < 0,005) , Recibindo a droga como primeira liña (P = 0,021) e enfermidade non avanzada (P = 0,014).
Concluencias: no noso hospital, Docataxel é o taxista que provocou os problemas de seguridade máis frecuentes durante a infusión.
Palabras clave: Paclitaxel; Docataxel; Reacción de hipersensibilidad.
Introdución
Desde fai algunhas décadas, os taxistas Paclitaxel e DoceTaxel demostraron ser efectivos nunha variedade de tumores. Paclitaxel é aprobado para o tratamento da mama, pulmón (células non pequenas) e neoplasos ovipos; e Docetaxel para o peito, pulmón (células non pequenas), cabeza e pescozo, adenocarcinoma gástrico e prostate1,2.A acción citotóxica do taxista está sostida na estabilización da tubulina ea posterior formación de microtúbulos non funcionais que desencadean unha mitosis errónea, polo que as células cancerosas deixan de dividir e remataron por mor do 1-3. En estudos preclínicos, DoceTaxel demostrou ser máis eficaz que Paclitaxel xa que únese á tubulina con maior afinidade, presenta a acción directa antitumoral por activación de vías apoptóticas e unha maior retención en células tumorais4.
Un dos inconvenientes presentados Por estas sustancias é a súa pobre solubilización, polo tanto, requiren o uso de vehículos de surfactantes non iónicos para a súa formulación. O cremóforo, derivado polioxietilado do aceite de ricino, é o solubilizador usado para Paclitaxel e Polysorbate 80 (entre 80), outro derivado polioxietilado, é para Docetaxel. Estes dous vehículos aumentan as interaccións farmacolóxicas con outros antineoplásticos (por exemplo, anhracylines) e poden alterar a farmacocinética das drogas coas que están formuladas, predispostas a unha maior toxicidade, especialmente no caso de Paclitaxel pola súa farmacocinética non lineal4-6. Para minimizar as reaccións adversas, evitar a Premedicación e diminuír os tempos de administración de Paclitaxel e DoceTaxel, desenvolvéronse novas estratexias de formulación como albumin nanopartículas, poliglutamates, prodrugs, emulsións ou liposomas5. Ata a data, só a nova formulación de Paclitaxel baseada en álbumin nanopartículas (Abraxane®) foi comercializada en España.
O perfil de seguridade destes axentes antitumorais é divergente; Mentres Paclitaxel está máis asociado con neuropatías periféricas, myalgias e artralgias, DoceTaxel está á retención de líquidos (ganancia de peso, inflamación dos nocellos ou zona abdominal) 5.7. Aproximadamente coa mesma frecuencia, as dúas drogas poden causar reaccións á infusión (dispnea, dor no peito, angioedema, hipotensión, urticaria e erupción cutánea) que dependen das características do taxista, disolvente ou ambas, e cuxa aparencia é posible que se debe , entre outras causas, á rápida infusión destes preparativos8,9. Estas reaccións, moitas veces tamén chamadas reaccións de hipersensibilidad, xeralmente ocorren durante os primeiros minutos de infusión e, xeralmente, na primeira ou segunda dose, podendo aparecer mesmo con premedicación adecuada baseada en corticosteroides e antihistamíns8.10.
todo Isto motivou o noso interese por determinar a incidencia de reaccións adversas relacionadas coa infusión de Taxans Paclitaxel e DoceTaxel no noso centro e as posibles causas que poden desencadelar.
Método
Estudio observacional, lonxitudinal e prospectivo de todas as infusións de Paclitaxel ou DoceTaxel a partir de xullo de 2010 a decembro de 2011, nun hospital universitario de nivel 3 sen transplantes.
Os pacientes tratados con Paclitaxel recibiron premedicación oral con Dexamethasone 8 mg o día anterior á quimioterapia e, no mesmo día, por intravenosa: Ondansestron 8 mg, dexameton 8-12 mg, dexchlorofeniramine 5 mg e ranitidina 50 mg, 30 minutos SO antes da túa administración. A premedicación utilizada para Docetaxel consistiu de Dexamethasone orais de 8mg dúas veces ao día durante tres días, a partir dun día antes da quimioterapia e tamén o mesmo día por vía intravenosa: Ondansestron 8 MG e Dexamethasone 8-12 mg, 30 minutos antes da súa administración.
As marcas rexistradas foron Paclitaxel Hospital® no caso de Paclitaxel e TaxoTere® e DoceTaxel Hospital® para DoceTaxel. Docetaxel foi administrado en soro fisiolóxico de 250 ml durante 60 minutos e Paclitaxel en soro fisiolóxico de 500 ml en 180 minutos de infusión. En poliquimioterapia, os taxáns sempre foron administrados primeiro, polo que as reaccións que poderían aparecer durante os primeiros minutos de infusión só se poderían atribuílos.
Un seguimento diario realizouse de todas as administracións de Taxanes e As seguintes variables foron rexistradas:
• Datos do paciente: idade, sexo, número de historia clínica e oncólogo responsable.
• clínica Datos: neoplasia, estadio, historia patolóxica, alerxias, medicación habitual e tratamentos quimioterapéuticos previos no caso de que houbese.
• Datos relacionados co tratamento de oncoloxía: tipo de taxista (incluído o nome comercial), a dose, a frecuencia, o ciclo, o ciclo quimioterapia e premedicación.
• Aparencia de calquera reacción adversa (RAM) durante a infusión de Taxane, especificando o tipo e gravidade segundo a CLI-CTCAE Classification V.3.0 2006 do National Cancro Insente11 .
Para rexistrar os datos relacionados co paciente, consultáronse os rexistros médicos.Os datos referidos ao tratamento oncolóxico foron obtidos a partir da prescrición por ciclo do paciente e tratamento. O seguimento de cada infusión foi realizado polo farmacéutico responsable da área de citotática e do farmacéutico residente poñéndose en contacto coa enfermeira do día en cargo de administrar o taxista. A proporción de causalidade das reaccións foi determinada polo algoritmo de Karch-Lasagna modificado12.
A análise estatística das variables cualitativas e cuantitativas realizouse co programa SPSS v.15.0. Foi avaliado se a variable dicotómica principal non o fai, foi asociada significativamente a cada unha das variables independentes. A proba Chi-Square foi utilizada para as variables categóricas e o estudante T para a comparación de medios en mostras independentes, tomando P < 0.05 como razón estatisticamente significativa.
O estudo foi aprobado polo Comité de Ética Clínica Clínica do Hospital e é necesario para a súa implementación a empresa de consentimento informado por parte dos pacientes que cumpriron os criterios de inclusión.
Resultados
durante os 18 meses de estudo , 4.689 medicamentos oncolóxicos foron infundidos, dos cales o 7,6% correspondía aos taxáns incluídos no seguimento. En total 357 infusións de Paclitaxel e DoceTaxel administrou a 92 pacientes (50,0% de mulleres), entre 36 e 79 e unha idade media de 61,4 anos (de 11,1). DoceTaxel foi o taxón máis comúnmente usado en número de pacientes (n = 55, 57,3%) e infusións (n = 188, 52,7%). Non se atoparon diferenzas significativas nas variables basais das dúas cohortes, agás a distribución de neoplasos (Táboa 1): a indicación máis común de Docetaxel foi o cancro de mama (47,3%), mentres que Paclitaxel era o pulmón (53,7%). Máis da metade dos pacientes recibiron o tratamento na primeira liña (62,5%).
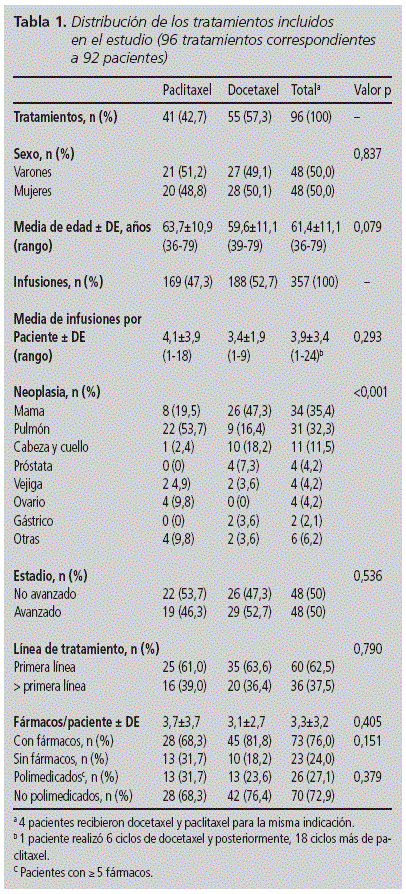
Usouse un total de 36 Protocolos quimioterapéuticos, sendo o esquema máis utilizado tanto para DoceTaxel como PacliTAxel a combinación con carboplatina (cabeza e pescozo e cancro de pulmón, respectivamente) (Táboa 2).
9 Reaccións infusionas correspondentes a 8 pacientes (8,7% de O total), todo causado por DoceTaxel (χ2 = 8.3, P = 0.004) e sempre durante o primeiro ou segundo ciclo de tratamento. Así, un 4,8% de infusións docetaxel causou unha reacción, 66,7% (n = 6) de que apareceu no segundo ciclo de tratamento, e rematou-se que afecta 14,5% dos pacientes que tiñan recibiran esta quimioterapia. Se só se seleccionan as infusións de Docetaxel durante o primeiro ou segundo ciclo, a incidencia de reaccións aumenta ata o 10,5% das administracións. En todos os casos, as reaccións apareceron en pacientes con idade de menos de 65 anos (56,3 anos de 4.1), non polimeedicados, sen alerxias anteriores coñecidas e na primeira liña de tratamento.
O 66,7% ( N = 6) As reaccións foron consideradas como moderadas segundo NCI-CTCAE v.3.011. Nun dos casos, a reacción foi considerada moi grave xa que se requirían medidas de apoio vitais. Este foi o único caso en que a reacción motivou a suspensión do tratamento. En 6 pacientes, a retirada de Docetaxel foi tolerada sen problemas e en dous pacientes foron administrados posteriormente Paclitaxel sen incidentes (Táboa 3). Segundo o algoritmo de Karl-Lasagna modificado12, todas as reaccións foron clasificadas como probables.
No grupo de machos 5 reaccións apareceron como un denominador común cancro de pulmón e esquema Docataxel 75 mg / m2 + cisplatin 75mg / m2 C / 21 días. Este esquema foi administrado a un total de 6 pacientes, polo que o 83,3% dos que recibiron este protocolo presentaron unha reacción á infusión. Nas 3 reaccións que apareceron nas mulleres, o único neoplasma implicado foi o peito, e os protocolos quimioterapéuticos foron 2 veces a combinación con Trastuzumab e nun con carboplatina.
Neste estudo as variables que están correlacionadas Estadísticamente coa aparición de reaccións á infusión de Docataxel foi: pulmón neoplasma (P < 0.005), DOCETAXEL-CISPLATIN SCHEME (P < 0,005) , recibe a droga na primeira liña (P = 0,021) e en enfermidades non avanzadas (P = 0,014). Non obstante, tal correlación non se observou con sexo, idade e variables de medicación habituais.
Discusión
A eficacia dos taxáns pode ser comprometida pola aparición de reaccións de hipersensibilidade durante a súa infusión. Ás veces, estes poden forzar a suspender o tratamento que ten que recorrer a outros esquemas que poden ser menos efectivos.
Na literatura científica descríbese que DoceTaxel e Paclitaxel causan reaccións de hipersensibilidade cunha frecuencia próxima ao 30%, pero diminúe ata un 2-5% se o pretratamento realízase con corticosteroides e antihistamínicos e se o é Reduciu a velocidade de perfusión1,2,8,13,14. No noso estudo, Paclitaxel non causou ningunha reacción coa premedicación utilizada e infundila durante 3 horas2. Non obstante, 9 episodios apareceron con DoceTaxel (14,5% dos pacientes) a administración por unha hora e expertos no hospital do día a premedicación recomendada sobre a seguridade técnica1. A maioría das reaccións (6) foron resoltas reforzando a premedicación e reducindo a velocidade de administración de 250 ml / h a 125 ml / h e posteriormente aumentando a velocidade progresivamente. Algúns autores, ademais de reducir a velocidade da administración tamén recomendan outras opcións como a redución da concentración de medicamentos a administrar ou considerar a aplicación de protocolos de desensibilización aumentando a doses15 perfusións. Hai estudos que tamén defenden por cambiar un taxano por outro cando unha reacción de hipersensibilidade aparece a unha das mesmas19-21. Certamente, cambiar un ao outro pode favorecer a continuación do tratamento, pero hai controversia a este respecto, xa que outros autores como Dizon et al.14 cren que isto non é posible debido á existencia dunha reactividade transversal entre os taxáns. No noso seguimento non houbo tal reactividade cruzada, xa que dous pacientes que presentaron unha reacción infusional a Docetaxel recibiron Paclitaxel sen incidentes. En 6 pacientes, a retirada de Docetaxel foi ben tolerada, con todo, había un paciente que despois de presentar unha reacción moderada a Docetaxel, volvendo a recibir este Taxane e presentaron unha reacción, esta vez considerada como grave e que provocou a suspensión definitiva do tratamento. En calquera caso, o que está claro é que a administración de calquera Taxane está contraindicada se a reacción de hipersensibilidade causada por calquera deles é grave (grao 3-4) 1.2.
Síntomas relacionados con estas reaccións, normalmente aparecen na primeira ou segunda infusión de quimioterapia e, en xeral, a poucos minutos de iniciala, como ocorreu nos 9 pacientes afectados no noso seguimento. Polo tanto, hai que prestar especial atención nas primeiras administracións de Taxane, organizando en todo momento de persoal experimentado e do apoio dun equipo de resucitación no caso de que houbese unha reacción que ameaza a vida do paciente22. Outros coidados que se poderían realizar son o seguimento da presión arterial e a observación do paciente ata 2 horas despois da administración de Taxane.
No noso estudo, a sirtomatoloxía do paciente que tiña unha reacción infusional a Docetaxel moi grave caracterizouse por cianosis , perda de conciencia, crise, insuficiencia respiratoria e hipotensión. A imaxe foi revertida rapidamente despois de deter a infusión e coa axuda de corticosteroides, terapia de osíxeno e fluídoterapia; Esta reacción foi notificada ao Centro de Farmacovixilancia Rexional. Nos outros pequenos casos, as reaccións consistían en eritema cutánea, blush facial, dor lumbar, taquicardia e, nalgúns casos, chills, hipotensión e mareos. En ningún deles había dispnea ou broncospasma.
Dous dos pacientes que presentaron unha reacción de hipersensibilidade DoceTaxel recoñecida non tendo debidamente tomada a dexametasona programada o día anterior á quimioterapia (pacientes 1 e 2, táboa 3). Non hai dúbida, que para reducir o risco de ocorrencia destes eventos é aumentar os pacientes desde a realización adecuada de premedicación que se paguen. Administrar unha premedicación baseada en antihistamínicos e corticosteroides antes de que Taxane sexa de elección xa que demostrou reducir a incidencia e a gravidade da retención de fluídos, así como a gravidade das reaccións de hipersensibilidade1,2,7. Ademais, evita interrupcións no tratamento e permite aumentar as doses acumulativas dos taxanes8.
Non se sabe se estas reaccións dependen do disolvente ou do taxano ou dos dous compoñentes. Tampouco é o mecanismo para o que aparecen. Pénsase que poden ser mediados pola activación do complemento, liberación non específica de histamina, produción de óxido nítrico ou polo lanzamento de citoquinas. Ao contrario do que ocorre con derivados de platino, en principio non relaciona a súa aparición cun mecanismo mediado por IgE, xa que as reaccións adoitan aparecer a poucos minutos de iniciar a infusión durante o primeiro ou segundo ciclo de tratamento, o que suxire que non hai necesidade Para pre-sensibilización23-25.Outro aspecto a ter en conta, e que coa bibliografía consultada non foi esclarecida con precisión8,26, é determinar se hai aspectos clínicos ou subjetivos que poidan predispoñer ao paciente a unha reacción de hipersensibilidade aguda ou calquera outra memoria RAM.
No noso estudo, os factores que estaban intimamente relacionados coa aparición de reaccións infusionas foron: pulmón Neoplasia, DoceTaxelcisplatin Scheme, recibe a droga en primeira liña e enfermidades inconscientes. Destes factores, na literatura consultada só para recibir Docetaxel na primeira ou segunda liña foi considerada unha variable decisiva na aparición destas reaccións.
Por outra banda, é posible que o concomitante O uso de Paclitaxel ou Docetaxel con outros antineoplásticos como Trastuzumab, Carboplatina ou Cisplatin pode mellorar a aparición de reaccións de hipersensibilidade, xa que tamén poden orixinarlles. Trastuzumab, como os taxanes, adoita causar estas reaccións no primeiro ou segundo ciclo, pero estas non se presentan dentro duns segundos de iniciar a infusión27. En contraste, as reaccións dos derivados de platino ocorren principalmente desde o sexto ciclo, durante ou despois a súa infusión25,28. No noso estudo, todas as reaccións apareceron en pacientes en tratamento poliquimiótico con estas drogas: 6 en combinación con Cisplatin, 2 con carboplatina e 1 con Trastuzumab. Non obstante, só se pode atopar relacións nos que se produciron durante o segundo ciclo, que é en que a combinación de drogas foi recibida anteriormente (en 6 das 9 reaccións do noso estudo). Así, en uso combinado, sería recomendable usar unha premedicación completa, monitorizar de cerca os pacientes e saber como diferenciar as reaccións de hipersensibilidade producidas por cada droga, para determinar o axente causal.
referencia a posibles prexuízos ou limitacións de O estudo, probablemente a incidencia de reaccións podería ser maior porque a súa avaliación constitúe unha variable subjetiva ou suave que depende da percepción do observador. Polo tanto, esta circunstancia pode causar unha minoría de reaccións leves porque podían pasar desapercibido. Outro sesgo a destacar, foi o uso de dúas marcas diferentes de DoceTaxel en diferentes fases do estudo (TAXOTERE® e DOCETAXEL HOSPIRA®), así como un cambio de formulación no caso de TAXOTERE®. Esta mesma preparación comercial foi a que presentou todas as reaccións infusionas (dúas delas coa formulación antiga), aínda que é certo que foi o máis utilizado (91,5% das infusións). Os excipientes de ambas as marcas rexistradas son: etanol, polisorbato 80 e ácido cítrico e no caso de TAXOTERE® ademais de Macrogol 300. A composición cuantitativa dos excipientes non se puido obter a partir das follas técnicas, polo que non sabemos se a marca rexistrada ou os seus excipientes poderían influír na aparición das reaccións. Unha limitación importante do estudo, e que hai que ter en conta para o traballo posterior, foron as probas de non provocación a cargo do servizo de alerxia que poderá discernir se as aparicións apareceron foron causadas polo principio activo ou os excipientes.
Finalmente, cos resultados obtidos neste estudo, as medidas que se tomaron no noso centro foron reforzar a premedicación de DoceTaxel e facer unha lenta administración de medicamentos (2-3 horas) no primeiro e segundo ciclo de tratamento. Con Paclitaxel decidiuse continuar coa mesma metodoloxía de traballo, como se indica na folla técnica.
Conclusións
Docetaxel é o taxista que estivo relacionado cun número maior no noso contorno de reaccións adversas durante a súa infusión, superior aos datos descritos na literatura.
Unha premedicación adecuada en ambos días e na casa do paciente, é crucial para reducir a incidencia destes.
É imprescindible facer máis estudos para poder coñecer exactamente a etioloxía destas reaccións e así poder aplicar medidas eficaces que eviten a súa aparencia.
Conflito de interese
Os autores Declarar non ter ningún conflito de intereses.
Bibliografía
1. Ficha técnica DOCETAXEL (TAXOTERE®) (acceso de xuño de 2010). Dispoñible en: www.ageemed.es
2. Ficha técnica Paclitaxel (Taxol®) (acceso xuño de 2010). Dispoñible en: www.ageemed.es
3. BAGNALL A-M, Forbes C, Lewis R, Golder S, Kleijnen J. Unha actualización dunha revisión rápida e sistemática da eficacia e eficacia dos custos dos taxáns utilizados no tratamento do cancro de mama avanzado. O Instituto Nacional de Excelencia Clínica (Centro NHS para comentarios e divulgación). Universidade de York, abril de 2001 (acceso xuño de 2010). Dispoñible en: www.nice.org.Reino Unido / Nicemedia / Live / 11435/32235 / 32235.pdf
4. Gligorov j, loz j-p. Farmacoloxía preclínica dos Taxanes: implicacións das diferenzas. O oncólogo. 2004; 9 (SUPL 2): 3-8.
5. Hennenfent K L, Govindan R. Formulacións novelas de Taxanes: unha revisión. Vello vello nunha nova botella? Anales de Oncoloxía. 2006; 17: 735-49.
6. Dez Tije AJ, Verweiij J, Loos WJ, Sparreboom A. Efectos farmacolóxicos dos vehículos de formulación: implicacións para a quimioterapia do cancro. Clin PharmacOkinet. 2003; 42 (7): 665-85.
7. Markman M. Xestionar as toxicidades de Taxane. Cancro de coidados de apoio. 2003; 11 (3): 144-47.
8. Actualizado. Base de datos. Reaccións de infusión á quimioterapia sistémica; Octubre 2009 (Acceso Marzo 2010). Disponible en: http://www.uptodate.com/contents/infusion-reactions-to-systemicchemotherapy
9. Michaud Lb. Métodos para evitar reaccións secundarias ao cremóforo EL. Ann Pharmachother 1997; 31: 1402-4.
10. Weiss RB, DoneHower RC, Wiernik PH, et al. Reaccións de hipersensibilidade do Taxol. J Clin Oncol. 1990; 8: 1263-8.
11. National Cancer Institute Criterios de toxicidade común para eventos adversos (CTCAE) v3.0; Agosto 2006. (Acceso Marzo 2010). Disponible en: http://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcaev3.pdf
12. Naranjo CA, Busto u, vendedores em, Sandor P, Ruiz I, Roberts Ea, et al. Un método para estimar a probabilidade de reaccións adversas de drogas. Clin Farmacoler. 1981; 30: 239-45.
13. Serie de atención médica de Micromax. Base de datos de drogas. Serie Thomson (Acceso Marzo 2010). Disponible en: www.thomsonhc.com
14. Dizon DS, Schwartz J, Rojan A, Miller J, Pires L, Disilvestro P, et al. Sensibilidade cruzada entre Paclitaxel e Docetaxel nun programa de cancro de mulleres. Gynecol Oncol. 2006; 100 (1): 149-51.
15. Markman M, Kennedy A, Webster K, et al. Reaccións de hipersensibilidade asociada por Paclitaxel: experiencia do programa de oncoloxía ginecolóxica do Centro de Cancro Clínica Cleveland. J Clin Oncol. 2000; 18 (1): 102-5.
16. Castells MC, Tennant Nm, Sloane de, Ida Hsu F, Barrett Na, Hong Di, et al. Reaccións de hipersensibilidad á quimioterapia: resultados e seguridade da rápida desensibilización en 413 casos. J Alerxia Clin Immunol. 2008; 122: 574-80.
17. Feldweg AM, Lee CW, Matulonis UA, Castells M. Desensibilización rápida para reaccións de hipersensibilidade a Paclitaxel e DoceTaxel: un novo protocolo estándar usado en 77 tratamentos exitosos. Gynecol Oncol. 2005; 96: 824-49.
18. Syrigou E, DANNOS I, KOTTAS E, MakriLia N, Tourkantonis I, Dilana K, et al. Reaccións de hipersensibilidad a Docetaxel: avaliación retrospectiva e desenvolvemento dun protocolo de desensibilización. Int arch alergy inmunol. 2011; 156 (3): 320-4.
19. J Lokich J, Anderson N. Paclitaxel Reaccións de hipersensibilidade: un papel para a substitución de Docetaxel. O Centro de Cancer de Boston. Anales de Oncoloxía. 1998; 9: 573-4.
20. Moon C, Verschraegen CF, Bevers M, Freedman R, Kudelka AP, Kavanagh JJ. Uso de DOCETAXEL (TAXOTERE) en pacientes con hipersensibilidade Paclitaxel (Taxol). Drogas anticancerías. 2000; 11 (7): 565-8.
21. Bernstein BJ. Docetaxel como unha alternativa a Paclitaxel despois das reaccións agudas de hipersensibilidade. Ann Pharmachother. 2000; 34 (11): 1332-25.
22. Baker J, et al. Efectos secundarios relacionados coa Docetaxel ea súa xestión. Revista Europea de Enfermería Oncoloxía. 2009; 13: 49-59.
23. Lee C, Gianos M, Klaustermeyer WB. Diagnóstico e xestión de reaccións de hipersensibilidade relacionadas cos axentes de quimioterapia do cancro común. Ann Allergy Asma Immunol. 2009; 102 (3): 179-87.
24. Ardavanis a, tryfonopoulos d, Yiotis I, Gerasimidis G, Baziotis N, Rigatos G. Natureza non alérxica das reaccións de hiper-sensibilidade inducida por DoceTaxel. Drogas anticancerías. 2004; 15 (6): 581-5.
25. Sánchez-Muñoz A, Mediola Fernández C, Poza Guedes P, Canto Diez G, Bezares Montes S, Cortés Funes H. Hipersensibilidad Un Carboplatino e Paclitaxel: Revisión y Recomendaciones Clínicas. Rev Oncol. 2002; 4 (2): 68-71.
26. Cortijo-Cascajares S, Jiménez-Cerezo MJ, Herreros de Tejada A. Revisión de Las ReaCciones de Hipersensibilidade A Antineoplásicos. Farm Hosp. 2012; 36: 148-58.
27. Chung Ch. Xestionar Premedicions eo risco de reaccións á terapia de anticorpo monoclonal infusional. Oncólogo. 2008; 13: 725-32.
28. Markman M, Kennedy A, Webster K, et al. Características clínicas das reaccións de hipersensibilidade a carboplatina. J Clin Oncol. 1999; 17 (4): 1141-5.