Cardioprotección mediada por canles de potasio dependente do ATP.
Dr Fernando Zeledón SA, Dr Orlando Morales Ma, Dr Edgar Méndez JB, Dr. Eduardo Induni LC, Dr Oswaldo Gutiérrez SD.
Resumo
A mitocondria ten un papel central no mantemento do metabolismo cardiomicito durante os fenómenos de Isquemia e reperfusión. Esta “Cardioprotección” parece estar ligada á apertura de canles de potasio dependentes da ATP na membrana mitocondrial, que evita a apertura do poro de permeabilidade transitoria (MPTP), a sobrecarga de calcio e a perda de volume de espazo intermembrana mitocondrial, evitando a morte celular por necrose ou apoptose .
Varios estudos clínicos soster o uso prometedor de drogas que abren as canles de potasio estes e que pode ser unha nova arma terapéutica contra enfermidade isquemia e as súas consecuencias
Palabras chave :. o pre-condicionamentos isquêmico; canles de potasio mitocondrial e sarcolémico; Sobrecarga de calcio; estrés oxidativo; Apoptose, poro de permeabilidade transitoria.
Resumo
Os canles de potasio sensible ao ATP mitocondrial desempeñan un papel importante que impide a morte de células necróticas e a apoptsis durante os fenómenos de ischamia / reperfusión por medio de prevención da transición de transición de permeabilidade mitocondriz (MPTP) Apertura, sobrecarga de calcio intracelular e perda de espazo intermembrana mitocondrial.
Hai evidencia clínica de efectos beneficiosos dun grupo de bebidas chamadas abridor de canles de potasio que a colud é unha nova ferramenta terapéutica contra a enfermidade cardíaca de Ischanics e A súa consistencia.
Palabras clave: canles de potasio precondicionado isquímico e mitocondrial, sobrecarga de calcio, estrés oxidativo, apoptose, poro de permeabilidade mitocondrial de transición.
Introdución
ata a data , o tratamento da enfermidade cardíaca de orixe isquémica centrouse na prevención de danos isquémicos, aumentando a contribución de osíxeno á área de miocardio en perigo ou Diminuíndo o consumo de osíxeno de miocitos cardíacos.
Así mesmo, xa que hai moitos anos sábese que a exposición dos miocitos a breves eventos isquémicos repetidamente, produce protección contra eventos isquémicos post-duradeiros, proceso chamado precondicionado isquémico (1 ).
Actualmente, o interese científico concéntrase en buscar os mecanismos celulares implicados na cardioprotección contra os eventos isquémicos / reperfusión, entre os que as canles de potasio sensibles a ATP (K ATP) parecen ter un papel central (1- 3).
Neste artigo, os conceptos de fisioloxía celular e molecular relacionados co papel do ATP K son revisados na defensa isquémica miocardial.
Estrutura e función das canles de potasio cardíaco .
Potasium (K +) é a segunda ción máis abundante do organismo. Un adulto de 70 kg contén preto de 4200 meq potasio ou uns 50 meq / kg no macho e 40 meq / kg na muller, tendo en conta o axuste por adipocidade e masa corporal. O contido de K + do organismo declina coa idade a uns 2 meq / kg por cada 10 anos mediante a diminución da masa muscular.
Aproximadamente, o 98% de K + está no líquido intracelular, cunha concentración de 150 MEQ / L, mentres que fóra das células é de 4 meq / l, cun rango de normalidade estreita entre 3,5 a 5,5 meq / l.
A cantidade de inxestión de K + nos países occidentais é case 50 a 100 meq / día ou máis ou menos 0,7 a 1.3 meq / kg de peso corporal por día. Por exemplo, nunha persoa que consome 80 MEQ nun día, o riñón será o responsable de excretar 70 meq, o tracto gastrointestinal 9 MEQ e a pel ao redor de 1 meq.
O potasio está nun saldo corporal estreito , parte da que se debe a unha redistribución entre os diferentes compartimentos celulares, se ese devandito Ion se traduce do medio intracelular ao extracelular ou ao viceversa (4). Para que se produza tal fenómeno, a célula usa proteínas transmembrana que funcionan como canles.
As canles iónicas teñen tres propiedades esenciais:
1) un túnel central ou por un por que flúe de iones con respecto ao seu gradiente electroquímico.
2) Un filtro de selección, que determina o que ion permitirá pasar polo poro, chamado Rexión P
3) unha estrutura que exerce a función da porta controlando a probabilidade conformacional de abrir e pechar a canle e, polo tanto, a permeabilidade da devandita proteína (4,5,6,7).
As canles de potasio están compostas por alfa e subunidades beta. Responsable da condución de iones a través de Lipid Bicayer é a subunidade alfa.Dependendo da súa topoloxía e do número de rexións P (selectividade por poros), estableceuse unha clasificación de canles de potasio (4,7,8).
Así, por exemplo, as canles de potasio que aumentan a diminución a súa permeabilidade dependendo da tensión transmembrana, teñen seis segmentos transmembrana (TM) e un poro (1 p) e chámanse canles de K + dependentes de tensión (KV, Figura 1, A); Os que presentan 2 TM-1P son canles que permiten o paso de potasio cara a intracelular cando a membrana plasmática está a unha tensión máis negativa que o seu potencial de equilibrio e está pechado para o potencial máis positivo, polo que son chamados, os rectificadores de canles de potasio (KIR) , K Rectifyer Inwardly) (7,9,10,11,12,13).
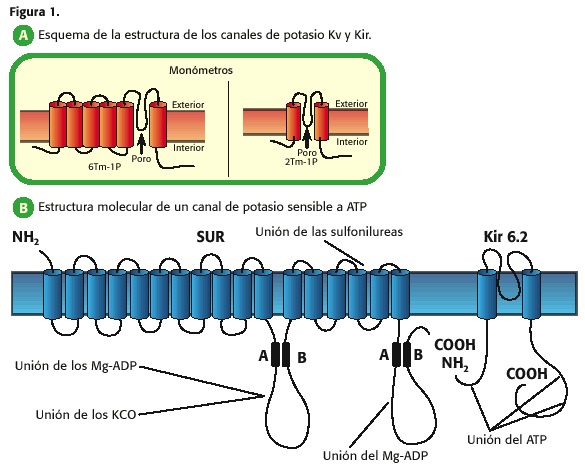
Cada unha destas familias de canles de potasio pode á súa vez as subfamilias actuais, dependendo da electrofisioloxía da canle ou o ligando que medía a apertura de tales proteínas, a táboa 1.
Táboa 1. Nomenclatura e estrutura de canles de potasio (14).
Dentro das canles rectificadoras en internas hai dúas subfamilias importantes na fisioloxía cardíaca: 1) As canles K reguladas por G Proteína, que están activadas polo R. Ecetrators M3 (Kach) e 2) canles sensibles a ATP (KATP), este último obxecto central da revisión (7,9,10,13).
A función do ATP K é mellor Coñecido nas células pancreáticas beta, onde cambia o acoplamento na excitabilidade eléctrica da membrana plasmática e do lanzamento de insulina, en relación coa concentración de glucosa no sangue. Non obstante, tamén estiveron involucrados na protección neuronal en eventos isquémicos e epilepsia, regulación de ton pulmonar e sistémica), recolución de glucosa no músculo esquelético e protección contra a isquemia do miocito cardíaco, tema desta revisión (10).
Estas propiedades derivan da capacidade das canles de KATP para parar o metabolismo celular á actividade eléctrica, detectando cambios no citosol de niveis de ATP e Difosfato de Adenosina (MG-ADP), que opera o ATP como bloqueador de canles e o MG- ADP como activador ou promotor da súa apertura (10,11).
O poro das canles de potasio é un tetrámero e porque o kir ten 2 TM-1P, catro destas unidades únense para formar o Poro, denominado no nivel cardíaco KIR 6.2 e KIR 6.1. Ademais, hai outra proteína chamada receptor de sulfonilurea (sur, receptor de sulfonilo, figura 1, b (15))
que regula a apertura ou peche do poro kir 6.2 ou KIR 6.1: o ATP inhibe A canle xa que se une á subunidade Kir 6, mentres que o MG-ADP activa-lo a través da súa interacción coa subunidade meridional (10,11,12,13,14).
Función central da mitocondria en A cardioprotección
mitocondria atópanse en case todas as células, con excepción do HEMATITIL e o seu número varía segundo o tipo de célula; Por exemplo, cada hepatocito ten 1.022 a 2.000 mitocondrias, que mide 3 μm de lonxitude aproximadamente.
A mitocondria posúen dúas membranas, un interior e outro interno, o que resulta en compartimentos intermembranos e a matriz mitocondrial. Na matriz mitocondrial e na membrana interna, é onde se desenvolven a maioría das actividades relacionadas coa cadea respiratoria (16). Nas mitocondrias hai varias proteínas que xogan funcións particulares, xa sexa a promoción da cardioprotección ou a detrimento da función cardíaca; E están interrelacionados polo KATP por diferentes mecanismos.
Dentro dos máis importantes son:
1) O poro de permeabilidade transitoria (MPTP, a transición de transición de permeabilidade mitocondrial) que está composta por:
– Canle de anión dependente de tensión (VDAC, canle de anión dependente da tensión), que está situado na membrana mitocondrial externa (MME)
– o transportador de nucleótidos de adenina (formiga, Translocator de nucleótidos de adenina), situado na membrana interna (MMI)
– a cina de creatina (CK), no espazo intermembrántico (eim)
2) os contadores de contadores Na + / H +, Na + / CA ++, K + / H +, H + / Piruvato, CA ++ COTRANSPORTER e as coñecidas proteínas da cadea respiratoria, beta-oxidación e Ciclo de Krebs (17,18) ( Figura 2).
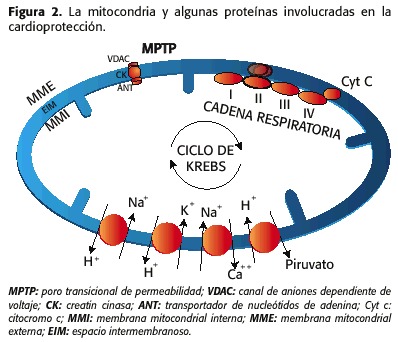
Os eventos máis importantes implicados na xénese de isquemia / repercusión son:
1. Cambios no volume da matriz mitocondrial
2. O estado EIM
3. A permeabilidade do MMI
4. A ruptura do MME e
5. A sobrecarga de calcio intramitocondrial-sodio.
Fisioloxía mitocondrial do manexo de calcio.
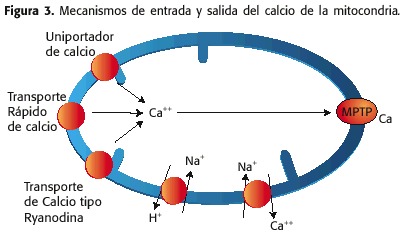
O calcio desempeña un papel fundamental na fisioloxía mitocondrial, cuxas concentracións están en rangos estreitos. O calcio pode ser recapturado cara á matriz da mitocondria a través do MMI por tres mecanismos:
1) unha bomba de calcio, coñecida como a uni-calcio ou up,
2) unha canle que permite A entrada rápida de calcio, coñecida como proteína de transporte rápido de calcio ou ram (modo de recuperación rápida) e
3) un ríoodinia ou RYR (receptor de Ryanodine).
Por outra banda a man, a saída de calcio da matriz mitocondrial débese a:
1) o contador de contador NA + / CA ++, baixo condicións fisiolóxicas
2) o MPTP, baixo condicións patolóxicas (Figura 3)
Función primaria de calcio a nivel de A mitocondria é a estimulación da cadea respiratoria en varios niveis, causando un aumento na produción de ATP ea súa exportación ao citosol para atender a demanda metabólica de miocit.
tamén sabe que o proceso de fosforilación oxidante xera A Pe. Cantidade de radicais libres como produto de complexos I, coenzima Q e complexo III, e que lonxe de ser prexudicial, é necesario que a transdución de sinal de múltiples camiños metabólicos intramitócritos (19).
mecanismos que promoven sobrecarga de calcio intramitocondrial. Durante a isquemia miocardial, o aumento da glicólise provoca unha acumulación progresiva de ácido láctico, diminuíndo o pH mitocondrial e que exercerá comentarios negativos que eventualmente
inhibirán a glicólise e a produción ATP. A activación do anti-go + / h + anticuidora que expulsa as hidrogenes da mitocondria busca a normalización do pH intramatricial, pero no proceso será alentado unha sobrecarga de sodio, que non pode ser bombeada fóra da célula, desde entón A Na + / K + -Apase é inhibida pola perda de ATP (19). En consecuencia, a actividade do contra-transportador NA + / CA ++, que normalmente exporta o calcio da mitocondria e a célula, diminuíu ou incluso actúan inversamente (porque este é un mecanismo de transporte activo secundario) para que nos diferentes compartimentos móbiles Inicia un feedback positivo que promueve moito unha sobrecarga de calcio. Neste punto, a homeostasia iónica non se pode manter, as concentracións de sodio intracelular e de calcio aumentan progresivamente, con diminución dos nucleótidos de adenina e aumento do fosfato.
Ademais, o aumento do calcio mitocondrial promove a formación radical libre nas mitocondrias polos seguintes mecanismos:
1) A sobrecarga de calcio mitocondrial promove un aumento no fluxo de electróns na cadea respiratoria
2) tamén estimula o óxido de sintetasa nítrica, formando óxido nítrico (non)
3) Sábese que non inhibe a cadea respiratoria no IV nivel complexo que
4) aumenta a formación de radicais libres (ROS, especies reactivas de osíxeno) por ciclo q
5) Os complexos I e II da cadea respiratoria tamén poden ser inhibidos polo aumento do calcio e non, contribuíndo aínda máis á formación de ROS
6) o calcio tamén se discacia citocromo c de proteína cardiolipina en MMI e finalmente Mo
7) O aumento do calcio promove a apertura do MPTP, permitindo a liberación do citocromo, a través de MME (19).
A pesar de todo o anterior, durante a isquemia mitocondrial PH (PHMI) permanece baixo e este fenómeno, como se discutirá nas seguintes seccións, é o suficientemente potente como para manter a MPTP pechada, sempre que o evento isquémico non prolonga ou supera a reperfusión temida.
O poro de permeabilidade transitorio (MPTP)
A MPTP foi descrita por Haworth e Hunter hai máis de 25 anos, con todo, ata hai uns anos que a súa función tomou gran importancia nos estados de isquemia- Reperfusión (20,21,22). Nun estado estable ou homeostasia mitocondrial, a MPTP está pechada, a distancia
entre MME e MMI é óptima e así hai un acoplamento entre o VDAC-CK-Ant, que permite que o principal mecanismo de enerxía do Mitocondria é o sistema de creatina-fosfocroatina e en segundo lugar o de ATP / ADP (Figura 4) (23). Ademais, a permeabilidade da ant-VDAC é baixa neste estado e as canles de potasio dependentes de ATP están pechadas (18,23,24).

Por outra banda, o Antipersporter K + / H + leva potasio A matriz a cambio dunha hidrogenión, e tamén ten unha baixa cinética en condicións estacionarias, para garantir o mantemento da fosforilación oxidativa, o volume de matriz adecuado e un potencial de membrana mitocondrial negativo, xa que como se sabe, o potencial das hidrogenencias entre o EIM eo Matrix mitocondrial mantense á impermeabilidade do MMI aos diferentes iones, que permite a xeración ATP polo complexo V situado no MMI.
En conclusión, desde un punto de vista fisiolóxico, a regulación Do volume da matriz mitocondrial ten consecuencias importantes para o metabolismo enerxético de miocus eo estado impermeable do poro contribúe a devandita homeostia (17,24,25).
O poro de permeabilidade transitoria durante a isquemia e durante a repercusión .. En condicións de isquemia miocárdica, a MPTP ábrese nunha cantidade máis baixa, permitindo que o MMI sexa permeable a calquera molécula < 1,5 kda. Dúas consecuencias importantes ocorren entón. En primeiro lugar, as proteínas intramitocondriais non poden atravesar o poro e exercer presión coloidosmótica no inchazo da matriz. O MMI por mor da súa consistencia non sofre a lisis, con todo, tal fenómeno ocorre en MME, co lanzamento de proteínas a EIM, como o citocromo C eo factor inductor da apoptose que desempeña un papel crítico na morte celular por este mecanismo .. En segundo lugar, o MMI vólvese permeable aos protóns, que desencadeou a cadea respiratoria, a diminución da produción de ATP e terceira, o funcionamento inverso do ATP sintético é promovido, é dicir, en vez de sintetizar a ATP é promovida a hidrólise deste por mor do mantemento Un gradiente de H + e un potencial de membrana mitocondrial negativo (18,26,27,28,29).
Con todo, en tal situación, as concentracións ATP diminuíron rapidamente, conducindo a unha alteración iónica da homeostase metabólica E a activación de enzimas que promoven a degradación, como fosfolipases, nucleases e proteases. A menos que se produza o peche de MPTP, estes cambios causan un dano de células irreversibles, resultando na necrose celular.
Un factor clave na apertura do MPTP é a sobrecarga de calcio intraláatricial, especialmente cando se acompaña o estrés oxidativo, o esgotamento de Nucleótidos adenosina, altas concentracións de fosfato iónico e despolarización do MMI, microambiente que se presenta en Isquemia. Polo tanto, a apertura do MPTP é un paso crítico na transición do dano de células reversibles a irreversibles (18.23).
Como se mencionou anteriormente, a MPTP está formada pola formiga VDAC e por outra Proteína, que se chama Cyclophiline-D (CYP-D), que ten que unirse á formiga para causar a súa apertura, a unión que é promovida polo aumento da concentración de calcio, polo esgotamento das reservas de nucleótidos da adenosina, aumentando a PHMI e as alteracións de volume de matriz. Con todo, un poderoso inhibidor da apertura dos poros é a redución do PHMI, un fenómeno que ocorre durante a isquemia, que establece un equilibrio entre os factores que favorecen a súa apertura (sobrecarga de calcio mitocondrial, depleção de ATP, aumento do estrés oxidativo) e os que se pechada ( baixo PHMI), Figura 5.
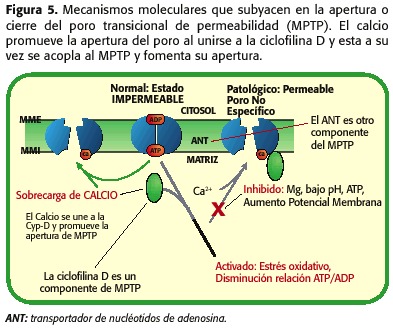
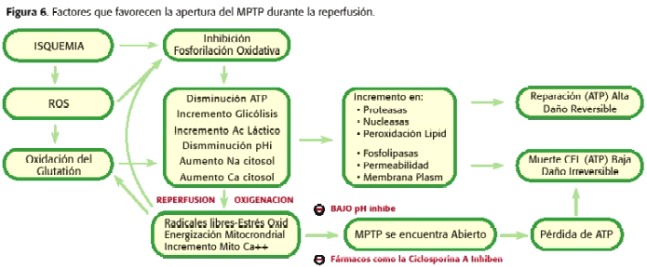
tanto, durante a isquemia a MPTP Abre, pero a pouca cantidade, xa que a micro-nación celular non é óptima para que se produza un fenómeno. Doutra banda, durante a reperfusión hai unha serie de fenómenos intramitocondriais que promoven a apertura do MPTP aínda máis que durante a isquemia. Cando a reperfusión ocorre, a mitocondria é nuevamente capaz de respirar e xerar un potencial de membrana que permite a síntese de ATP, co aumento da produción de radicais libres como os produtos da cadea respiratoria, o PHMI comeza a aumentar e aínda persiste sobrecarga de calcio e deflexión de ATP. Polo tanto, neste punto promove a apertura do MPTP (30,31,32,33,34,35) (Figura 6). Dependendo da proporción de poros abertos e do tempo restante en tal estado, necrose ou apoptose (18,23,24) irá a promover (Figura 7).
Deste xeito, a mitocondria convértese nun obxectivo terapéutico, xa que promove a inhibición directa do MPTP ou indirectamente, impedindo que os fenómenos que promocionen a súa apertura, como
1) A sobrecarga de calcio que se pode alcanzar co propofol36 ou co aumento das concentracións de MG ++ que inhibe o contador de contadores NA + / CA ++ e os canles de calcio tipo L (37)
2) Mellorar a bioenergética mitocondrial ou o volume de matriz, os dous fenómenos propiciados con drogas que abren canles de potasio (KCO, abridor de canles de potasio) ver a continuación
3) mantendo un pH baixo durante a reperfusión, Por exemplo, inhibindo o antipersportador NA + / H + con medicamentos como amiloruro ou engadindo piruvato (38) á mitocondria que fomenta o aumento do ácido láctico.
todo a Nterta abre unha inmensa porta na investigación en ciencias básicas e en terapéutica para pacientes que padecen isquemia miocardia ou as súas consecuencias.
Canles de potasio sensibles a ATP: a súa función na prevención da apertura do MPTP mitocondrial e Na membrana sarcoplasmática
Durante as situacións de estrés miocardio, no que o ATP é reft, as canles de K + aumentan o seu estado de apertura con consecuencias benéficas para o microambiente de MyOCIT (39,40, 41).
A apertura do Mitocondrial K ATP causa un modesto aumento na influencia K + cara ao interior da matriz, o que causa dous efectos diferentes dependendo do estado bioenergético do cardiomyocito. En primeiro lugar, cando a célula está en repouso, o potencial de membrana mitocondrial é alta e a entrada de ións de potasio promove a tartaruga mitocondrial e alcalización da matriz, que fomenta un lixeiro aumento na produción de radicais libres. En segundo lugar, se a célula está no estado da isquemia, a mitocondria está desplegada (baixa potencial), que promove a saída de K +, un fenómeno que é contrarrestado polas canles de K ATP e, polo tanto, a contracción do volume de Mortrix que faría Se non ocorre (42).
A renda de potasio á matriz mitocondrial xera unha lixeira produción de radicais libres (ROS) e como se demostra, estes desempeñan un papel importante como segundo mensaxeiro nunha variedade de sinais intracelulares (39). Esta produción de ROS nunha célula de descanso tamén promove a reconquista de K + a cambio dunha H + (antitransportadora K + / H +), que crea o gradiente para o intercambio dun fosfato (PI) polo cotransportador de electróns PI / H + .. A reconquista de Pi é moito menor que a de K +, porque o PI está presente en moito menos concentración que a K +. Por este motivo, o pH da matriz sempre aumenta cando o volume da matriz tamén aumenta, fenómenos promovidos pola reconquista Pi e K + (23).
Cando as canles aínda non entraron en función do katp durante os eventos isquémicos, a matriz mitocondrial sofre unha contracción e aumentos de EIM, coa disposición do VDAC da formiga polo CK, o que aumenta a condutancia ao intercambiador de nucleótidos polo VDAC e a formiga, ao contrario do que é Pasando en repouso, contribuíndo así ao desvío de matriz e ATP citosólico (Figura 3). Polo tanto, a apertura do KATP durante a isquemia, por exemplo promovida por diazóxido, mantén o volume do EIM, reduce a taxa de perda de ATP, reduce a taxa de degradación dos nucleótidos de adenina de tal xeito que existirán reservas ADP para a posterior A fosforilación durante a reperfusión e, finalmente, reduce os cambios no potencial de membrana mitocondrial ea acumulación de CA ++, evitando a sobrecarga de calcio, xa que o ATP permanece en concentracións adecuadas para o funcionamento mínimo de Na + / K + Atpasa e outras bombas.
Estes efectos preservan a función mitocondrial e deste xeito pódese enfrontar a reperfusión con mellores resultados fisiopatolóxicos. Durante a reperfusión, a posterior apertura de canles de KATP permite a compartimentación de nucleótidos de adenina, o que significa que a primeira fonte de enerxía é fosfato de fosfocreatina e non o ATP (baixa condutancia do VDAC (23), Figura 3).
Polo tanto, a activación das canles ATP mitocondriais durante a reperfusión de isquemia impide a formación do poro de permeabilidade transitoria ao inhibir o estrés oxidativo, provocado polos ingresos do CA ++ (18,23,24).
Vanden Hoek et al. Mostrou que o aumento dos radicais libres nas mitocondrias durante a precondición isquémica era necesario para protexer a miocus contra un posterior estrés oxidativo durante a reperfusión.Así foi a hipótese de que hai dúas etapas no lanzamento de radicais libres, o primeiro que contribúe á apertura das canles de potasio sensibles ao ATP e posterior durante a repercusión, que é prexudicial e desencadea a apoptose remodelada e cardíaca ( 42). Na membrana sarcolemical de miocito cardíaco e músculo liso, a apertura de canles de potasio tamén promove os efectos de protección.
Hiperpolarización celular que impide a sobrecarga de CA ++, diminuíndo a duración do potencial de acción, limitando a celular Danos e preservar reservas de enerxía celular e, polo tanto, a supervivencia da miocita. Ademais, esta secuencia pode ser a figura aguda e crónica (8,42,44). No nivel vascular, a apertura destas canles promueve a vasodilatación, debido á hiperpolarización e á redución da célula na entrada de CA ++, con maior fluxo coronario e diminución da postación posterior.
Perspectivas clínicas
Debido ás propiedades combinadas da cardioprotección e da vasodilatación, pódese considerar medicamentos que permiten a apertura de canles de potasio (KCO) para certas condicións cardíacas (Táboa 2). Estes inclúen a protección do miocardio en circulación extracorpórea, preservación corazón de doador en transplante de corazón, o tratamento de enfermidades isquemia cardíaca, da hipertensión arterial sistémica e pulmonar, enfermidade vascular periférica e arritmias relacionadas coa repolarização anormal (41-50).
Na cirurxía cardíaca, o KCO podería desempeñar un papel importante para Solucións Cardioplegia. En varios modelos de cirurxía cardíaca con circulación extracorpolporeal, varios KOC, incluíndo Nicorandil, Aprikalim e Pinacidil, promovieron unha maior cardioprotección que con cardioplexia convencional (51.52).
En pacientes que se realizaron cirurxía de pontes (bypass) coronario, O tempo necesario para chegar ao arresto cardíaco, os cambios no segmento de ST despois da aorte de aorte, os niveis de plasma do CPK-MB e a dose de axentes inotrópicos foron todo menor que o grupo tratado con Nicorandil en comparación cos controis tratados con terapia convencional ( 53).
O uso de solucións cardioplexicas con KCO como diazóxido, minoxidy (54), propofol (que inhibe a sobrecarga de calcio ++ (36)), magnesio (que inhibe a sobrecarga de calcio37), os digitales (que fomentar a cardioprotección por vías de sinalización celular que converxen coas de KCO (23.55)), piruvato (que incentiva a acidose intracelular e Normalización de grao de pH polo peche de MPTP (38)), os inhibidores do contador de transportadores na + / H ++ como amilorida (que tamén evitan a perda do baixo efecto protector do baixo), adenosina (que tamén é un kco , actuando a través de proteínas G, impide a sobrecarga de calcio xa que a hiperpoto cardiopegia promove (52.56)), pode ser obxectivos fortes para a preservación da función cardíaca en cirurxías de alto risco e pode evitar as complicacións potencialmente mortais como a síndrome de gasto post-bomba e moitos Outros, con redución dos custos económicos ao reducir as estancias do hospital.
Por outra banda, o uso de antioxidantes parece ser beneficioso só en certas circunstancias, xa que o seu uso en ensaios de laboratorio bloqueou o pre-revestimento isquémico , porque os radicais libres son liberados en menor cantidade (23.25).
en síndrome coronario agudo, valor Do KCO está mellor documentado clínicamente con Nicorandil que demostrou ser beneficioso con efectos adversos mínimos ao manexar a angina estable e inestable (57). Nun estudo multicentero que inclúe máis de 5.000 pacientes con Angor estable, o uso a longo prazo de Nicorandil asociouse coa redución de eventos cardiovasculares como a morte cardíaca, o infarto de miocardio e a hospitalización debido á dor no peito (58,59).
en Os pacientes con rabia inestable, o Nicorandil engadido a un tratamento anti-isquímico agresivo reducido episodios de isquemia miocardial / necrose e arritmias cando se compara cos pacientes tratados con terapia convencional. En pacientes sometidos á angioplastia coronaria, o Nicorandil predominou o corazón, mellorou a hemodinámica coronaria e a viabilidade miocárdica preservada antes da reperfusión (60,61,62).
Nicorandil tamén diminúe a precarga e posterior, aumenta o lanzamento de nítrico Oxide por células endoteliais e, a diferenza da nitroglicerina, non desenvolve a tolerancia cara aos seus efectos antiagines (63).
Na Angina Vasospastal, Nicorandil é un poderoso vasodilatador e demostrou diminuír os episodios da angina variante, diminúe o segmento de St segment e mellora a perfusión coronaria. O KOC tamén demostrou mellores resultados en cirurxía de bypass coronario usando enxertos arteriales (arterias torácicas internas, gastroepiploico, radial) como evita o posterior vasespassm (64.65.66)). A experiencia e os datos científicos son necesarios co uso de KCO nestas situacións clínicas.
A activación do katp sarcolémico é responsable da corrente eléctrica subliñando a elevación do segmento de ST, o clásico indicador electrocardiográfico do dano isquémico transmural mioocardial ( 41). Pacientes con diabetes mellitus tratados con sulfonilureas e que son un infarto agudo ao miocardio, presentan unha magnitude atenuada en St Elevation, o que dificulta o diagnóstico inicial, xa que as sulfonilureas son inhibidores de canles de KATP dependentes (41).
Conclusión
Como prácticamente todas as enfermidades humanas, a terapéutica da enfermidade isquémica cardíaca baséase en novos coñecementos na fisioloxía celular e fisiopatoloxía. A modulación das canles de KATP é un proceso crítico na homeostase metabólica da célula e segundo a investigación biomédica dilúe novos conceptos sobre a estrutura, a función, a regulación ea selectividade dos tecidos destas canles, os novos axentes terapéuticos poden ser desenvolvidos con enormes vantaxes para a poboación en risco.
Referencias
1. Ardehali H, O’Rourke. Canles de katp mitocondrial en supervivencia celular e morte. J Mol Cell Cardiol 2005; 39: 7-16.
2. Kloner Ra, Bolli R, Marban E, Reinilib L, Braunwald E. Implicacións médicas e celulares da sorprendente, hibernación e condición previa: un taller NHLBI. Circulación de 1998; 97: 18: 48-67.
3. Murray CE, Jennings RB, Reiner Ka. Preconcondicionamento con Isquemia: atraso de lesións de células letales en miocardio isquémico. Circulación 1986; 74: 11: 24-36.
4. COGAN MG. Líquidos e electrólitos: fisioloxía e fisiopatoloxía. Manual moderno. México, 1993; 145-168.
5. Sansom MSP, Shrivastavava IH E at. Canles de potasio: estruturas, modelos, simulacións. Biochimica et Biofysica Acta 2002, 1565: 294-307.
6. Biggin PC, Roosild T, Choe S. Potasium Channel Estrutura: dominio por dominio. A opinión actual Bioloxía Estrutural 2000, 10: 456-461.
7. Giblin JP, Leaney JL e Tinker A. A Asemblea Molecular de canles de potasio sensible ao ATP: Determinantes na subunidade de forma de parede. J Biol Chem 1999, 274: 22652-22659.
8. Choe S. Potasium Channel Structures. Nat Rev Neurocience 2002, 3: 115-121.
9. Lousearon N, Rose T, Nichols CG. Bases estruturais da gating de canle de potasio rectificado cara a dentro. Tendencias Cardiovasc Med 2002; 12: 253-258
10. Nishida M, MACKINNON R. Structural Bases de rectificación interna: poro citoplasmático do girk1 rectificador interno de proteína G con 1,8 a resolución. Cell 2002; 111: 957-965.
11. Yamada M, Inanobe A, Kurachi Y. G Regulación de proteínas de canles iónicos de potasio. Comentarios farmacolóxicos 1998; 50: 724-747.
12. Bichet D, Haass F, Yeh Jan L. Fusionando estudos funcionais con estruturas de canles de rectificadores rectificadores internos. Revisións de natureza 2003; 4: 957-67.
13. Aguilar-Bryan L, Clement IV J, González G, Kunjilwar K, Babenko A, Bryan J. Para comprender a montaxe e estrutura das canles de KATP. Comentarios fisiolóxicos 1998; 78: 227-242.
14. Elizari M, Chiale P. Arritmias cardíacas: fundamentos celulares e moleculares, diagnóstico e tratamento. Panamericana, Bos Aires, 2003; 31-40.
15. Campbell JD, Sanson MSP, Ashcroft F. Regulamento de canles de potasio. Revisións da natureza 2003; 11: 1038-1042.
16. Méndez Je, Zeledón SF, Zamora JF, Cortés VA. Un achegamento á cinética de osíxeno Parte 1. Rev Costarr Caridiol 2004; 6: 27-32.
17. Suleiman M, Haletrap AP, Griffiths E.j. Mitocondria: un obxectivo para a protección miocardial. Farmacoloxía e terapéutica 2001; 89: 29-46.
18. Haletrap AP, Clarke J, Sabzali A, Javadov A. Transición de permeabilidade de permeabilidade mitocondrial Apertura de pares durante a reperfusión miocárdica: un obxectivo de cardioprotección. Cardiovasc 2004; 61: 372-385.
19. Brookes P, Yoon e, Robotham J et al. Calcio, ATP e ROS: Triángulo de odio mitocondrial. AM J Physiol Cell Physiol 2004; 287: C817-C833.
20. Cazador dr e haworth ra. A transición de membrana inducida polo CA ++ en mitocondria I. Os mecanismos de protección. Arch Biochem Biophys 1979; 195: 453-459.
21. Cazador dr e haworth ra. A transición de membrana inducida polo CA ++ en mitocondria II. Natureza do Sitio de Trigger CA ++. Arch Biochem Biophys 1979; 195: 460-67.
22. Cazador dr e haworth ra. A transición de membrana inducida polo CA ++ en mitocondria III.Relación de transición CA ++. Arch Biochem Biophys 1979; 195: 468- 77.
23. Garlid KD, Dos Santos P, XIE ZJ, Costa A, PAUCEK P. Transporte de potasio mitocondrial: o papel da canle K + sensible ao ATP mitocondrial en función cardíaca e cardioprotección. Biochem Biophys ACTA 2003; 1606: 1-21.
24. Maccallas e, liem d et al. Función mitocondrial: o corazón da conservación miocárdica. J Lab Clin Med 2003; 142: 141-9.
25. Facundo H, Fornazari M, Kowaltowski A. Protección de tecido mediada por canles k + mitocondrial. Biochem Biophys ACTA 2005; 1701: 1-11.
26. HALESTAP AP. A transición de permeabilidade mitocondrial: o seu mecanismo e papel molecular en lesións de reperfusión. En: Brown GC, Nicholls DG, Cooper CE, editores. Mitocondria e morte celular. Simposia da sociedade bioquímica. Londres: Portland Press; 1999, vol. 66, p. 181- 203.
27. Halestrap AP, McStay GP, Clarke SJ. A transición de transición de permeabilidade complexa: outra vista. Biochimie 2002; 84: 153-66.
28. Halestrap AP, Kerr PM, Javadov S, Woodfield Ky. Elucidando o mecanismo molecular da transición de permeabilidade do poro eo seu papel na lesión da reperfusión do corazón. Biochim Biophys ACTA 1998; 1366: 79-94.
29. Halestrap AP, Brenner C. O nucleótido de adenina translocase: un compoñente central do poro de transición de permeabilidade mitocondrial e xogador clave na morte celular. Curr med Chem 2003; 10: 1507-25.
30. Duchen Mr, McGuinness O, LA Brown, Crompton M. Sobre a implicación dunha ciclosporina-un poro mitocondrial sensible en lesións de reperfusión miocardia. Cardiovasc Res 1993; 27: 1790-4.
31. Lemasters JJ, Nieminen al, Qian T, Tost LC, Herman B. A transición de permeabilidade mitocondrial en lesións tóxicas, hipóxicas e reperfusión. Mol Cell Biochem 1997; 174: 159-65.
32. Lemasters JJ, Trollinger Dr, Qian T, Cascio Nós, Ohata H. Fotos confocales de CA2 +, pH, potencial eléctrico e permeabilidade da membrana en células vivas individuais. Métodos Enzymol 1999; 302: 341-58.
33. Xu MF, Wang YG, Hirai K, Ayub A, Ashraf A. O precondicionamento de calcio inhibe a transición de permeabilidade mitocondrial e apoptose. AM J Physiol 2001; 280: H899- 908.
34. Miyata H, Lakatta, por exemplo, Stern MD, Silverman HS. Relación de calcio libre mitocondrial e citosólico á recuperación do miocito cardíaco despois da exposición a anoxia. CIRC RES de 1992; 71: 605-13.
35. Griffiths EJ, Ocampo CJ, Savage JS, et al. Camiños de transporte de calcio mitocondrial durante a hipoxia e a reoxigenación en cardiomyocitas de ratos. Cardiovesc Res 1998; 39: 423-33.
36. Lim Khh, Modi P, Nicholson e, et al. Un modelo de porco de arresto cardiopxglicos de sangue quente para investigar os efectos cardioprotectores do propofol. J Physiol 2001; 536p: 82p.
37. Headrick JP, McKirdy JC, Willis RJ. Efectos funcionais e metabólicos do magnesio extracelular en miocardio normóxico e isquémico. AM J Physiol 1998; 275: H917-29.
38. Mallet RT. Piruvato: protector metabólico do rendemento cardíaco. Proc Soc Exp Biol Med 2000; 223: 136-48.
39. Oldenburg O, Cohen M et al. Canles de katp mitocondrial: papel en cardioprotección. Cardiovasc Res 55: 429-437, 2002.
40. Minners J, McLeod C, saco N. Plasticidade mitocondrial en precondición isquémica clásica que se move máis aló da canle katp mitocondrial. Cardiovas Res 2003; 59: 1-6.
41. Kane G, Liu X, Yamada S, Olson T, Terzic A. Cardiac KATP Canles en Saúde e Enfermidade. J Mol Cell Cardiol 2005; 38: 937-943.
42. Wang Y, Haider H, Ahmad N, Aschraf M. Mecanismos por que os abridores de canles de KATP producen unha cardioprotección aguda e atrasada. Farmacoloxía Vascular 2005; 42: 253-264.
43. Vanden Hoeck T, Becker L.B, Shao Z, as especies de osíxeno reactivas de Schumacker P. liberados de mitocondrias durante breve hipoxia inducir precondicionamento en cardiomiócitos. J biol. Chem. 1998; 273: 18092-98
44. Jahangir a, Terzic A. KATP Terapéutica da canle á beira da cama. J Mol Cell Cardiol 2005; 39: 99-112.
45. Kane GC, Behfar a, Yamada S, Pérez-Terzic C, O’Cochlain F, et al. Hoenicke EM, Sun XW, RG estraño, Damiano RJ. Preservación do corazón doador cunha novela hiperpolarización solución: protección superior en comparación coa solución da Universidade de Wisconsin. J Thorac Cardiovasc Surg 2000; 120: 746-54.
46. Quast u, Guillon JM, Cavero I. Farmacoloxía celular dos abridores de canles de potasio en músculo liso vascular. Cardiovesc Res 1994; 28: 805-10.
47. Okada Y, Yanagisawa T, Taira N. BRL 38227 (Levcromakalim) – A hiperpolarización inducida reduce a sensibilidade a ca2 + de elementos contráctiles na arteria coronaria canina. Naunyn Schmiedebergs Arch Pharmacol 1993; 347: 438-44.
48. Donnelly R, Elliott HL, Meredith PA, Reid Jl. Estudos clínicos co activador de canles de potasio Cromakalim en temas normotensivos e hipertensivos. J cardiovasc farmach 1990; 16: 790-5.
49. Simpson D, Wellington K.Nicorandil: unha revisión do seu uso na xestión de pectoras de angina estable, incluíndo pacientes de alto risco. Drogas 2004; 64: 1941-55.
50. McCully JD, Levitsky S. canles de potasio sensible ao ATP mitocondrial en cardioprotección cirúrxica. Arch Biochem Biophys 2003; 420: 237-45.
51. Kevelaitis E, Oubenaissa A, Peynet J, MOUAS C, Menasche P. Precondicionamento por openadores de canles de potasio sensible ao ATP mitocondrial – un enfoque eficaz para mellorar a preservación dos trasplantes cardíacos. Circulación de 1999; 100: 345-50.
52. SteensRud T, Nordhaug D, Husnes KV, Aghajani e, Sorlie DG. Substituíndo o potasio con Nicorandil en Cold St. Thomas ‘Hospital Cardiopegia mellora a preservación de enerxética e función en corazones de porco. Ann Thorac Surg 2004; 77: 1391-7.
53. Hayashi Y, Sawa Y, Ohtake S, Nishimura M, Ichikawa H, Matsuda H Controlou a Protección Formyocardial de Nicorandia durante a Protección Formyocardial durante a arteria coronaria o injerto por bypass cardiopulmonar. J Cardiovasc Pharmacol 2001; 38: 21-8.
54. Garlid PD, PUCED P et al. Efecto cardioprotector da diazóxido ea súa interacción con canles k + sensibles ao ATP mitocondrial: posible mecanismo ou cardioprotección, CIRC RES de 1997; 81: 1072-182.
55. Xic Z. Ouabain Interacción con Cardíaco NA / K- ATPASA revela que a enzima pode actuar como unha bomba e como un transdutor de sinal. Cell Mol Biol 2001; 47: 383-390.
56. Jovanovic A, López J, Alekseev a et al. A adenosina impide a CA21 inducida por K1: Insight of Cardioprotection durante Cardioplegia. Ann Thorac Surg 1998; 65: 586-91.
57. Simpson D, Wellington K. Nicorandil: unha revisión do seu uso na xestión de pectoris de angina estable, incluíndo pacientes de alto risco. Drogas 2004; 64: 1941-55.
58. Markham A, PLOSKER GL, GOA KL. Nicorandil-unha revisión actualizada do seu uso en enfermidades cardíacas isquémicas con énfase nos seus efectos cardioprotectores. Drogas 2000; 60: 955-74.
59. O grupo de estudo IONA. Proba para mostrar o impacto de Nicorandil en Angina (IONA): deseño, metodoloxía e xestión. Corazón de 2001; 85: E9.
60. ITO H, Taniyama Y, Iwakura K, Nishikawa N, Masuyama T, et al. Nicorandil intravenoso pode preservar a integridade microvascular e a viabilidade miocardial en pacientes con infarto de muro de muro anterior. J am Coll Cardiol 1999; 33: 654-60.
61. Schlepper M, Thormann J, Berwing K, Strasser R, Mitrovicv. Efectos de Nicorandil sobre a perfusión rexional e función ventricular esquerda. Drogas cardiovascas de 1995; 9: 203-11.
62. Sakatay, Kodama K, Komamura K, Limyj, Ishikura F, et al. efecto salut de administración intracoronária nicorandil subrogante na restauración do fluxo sanguíneo do miocardio ea mellora funcional en pacientes con agudo de miocardio infarction.Am Heart J. 1997; 133: 616-21.
63. Simpson D, Wellington K. Nicorandil: unha revisión do seu uso na xestión de pectoris de angina estable, incluíndo pacientes de alto risco. Drogas 2004; 64: 1941-55.
64. Kaski JC. Xestión de rol de angina vasústica de Nicorandil. Drogas cardiovascas de 1995; 9: 221-7.
65. Chen JW, Lee Wl, Hsu NW, Lin SJ, Ting CT, Wang Sp, et al. Efectos do tratamento a curto prazo de Nicorandil sobre a isquemia miocardial inducida por exercicio e a actividade autonómica anormal cardíaca na angina microvascular. Am j cardiol 1997; 80: 32-8.
66. AKAR F, UYDES-DOGAN BS, TUFAN H, ASLAMACI S, KOKSOY C, KANZIK I. A comparación da capacidade de resposta do mamário interno illado humano e as arterias gastroeppleoicas a Levcromakalim: un enfoque alternativo á xestión do espasmo de enxerto. BR J Clin Pharmacol 1997; 44: 49-56.
A Departamento de Fisiología, Universidade de Ciencias Médicas (Ucimed), Sabana Oeste, San José, Costa Rica. Teléfono (506) 296-3944, correo electrónico: [email protected], [email protected]
B Cátedra de Cirugía, Hospital México, Ucimed, San José, Costa Rica.
C Cátedra de Cirugía, Hospital México, Universidade de Costa Rica (UCR), San José, Costa Rica.
D Cátedra de Fisiopatología, Hospital México, UCMed e UCR, San José, Costa Rica