Introdución
A esclerose lateral amyotrófica (ELA) ten como principal característica a perda selectiva das neuronas motoras no cerebro, o tronco cerebral e a medula espinal1. A maioría dos casos de ELA son esporádicos, pero aproximadamente o 10% dos pacientes teñen unha historia familiar2 e estes pacientes, o 20% teñen mutacións no CU2 + / ZN2 + Superóxido dismutase1 (SOD1) 3. Ademais, o TDP-43 e a proteína / TLS de FIG poden estar asociados en pacientes cunha familia e esporádica ELA4.5 e a maior porcentaxe de casos estiveron ligados a unha expansión intronada dunha repetición GGGCC de hexanucleótidos no xene C9OURF726 .
O mecanismo polo cal as neuronas motores fanse de forma selectiva vulnerable e morren en pacientes con ELA aínda é descoñecida. O patrón de progresión clínica que se atopa nos ratones SOD1 transxénicos mutados podería indicar que a enfermidade difunde centrífuga dunha rexión afectada a unha área adxacente; Polo tanto, podería especular que os produtos tóxicos xerados nunha área difunden a lesión, afectada polas neuronas adxacentes e así difundir a enfermidade e unha posibilidade é que estes factores poderían ser vehicados a través do fluído cerebrospinal (LCR) 7. Este suposto levou a varios investigadores a desenvolver experimentos a investigar se a incubación in vitro nas culturas de neuronas e as liñas de células neuronais con CSF de pacientes con ELA (ELA-LCR) podería causar danos celulares, que foi confirmado na maioría dos estudos7-22 como unha revisión , aínda que non en ALL23. O noso grupo determinou que ELA-LCR afecta á viabilidade das neuronas cortas corticales cerebrais de ratas mantidas en cultivos primarios; Non obstante, este efecto parece ser mediado por un mecanismo de glutamato independente, aínda que a ELA-LCR provocou unha elevación da concentración base de CA2 + Citose () do motor neuronas24,25. Estes datos admiten a presenza de factor (s) tóxicos no (s) o (s) LCR (s) responsable (s) para causar danos das neuronas de motores en experimentos in vitro, pero é posible que non en todos os pacientes ou en todas as fases da enfermidade26. A pregunta é se a ELA-LCR tamén podería causar danos cerebrais in vivo. De feito, a inxección intratecal ou intracerebrloventricular aguda de ELA-LCR produce cambios na actividade neuronal, na expresión dos receptores de glutamato e as canles de ións, na fosforilación de proteínas despois de só 2 tarde despois da inxección27-29 ou induce as alteracións mitocondriais, o estrés oxidativo ou a disfunción lisosomal30.
Estes experimentos producidos con inxeccións puntuais non imitan o curso temporal do ELA e, polo tanto, non a reproducen. Polo tanto, parecía apropiado levar a cabo os experimentos que imos describir aquí: o exame dos cambios cerebrais histopatolóxicos e funcionais que se producen despois da infusión continua de ELA-LCR por 20 ou 43Dias, alcanzado polo uso dun minibús conectado ao Rat Cerebral Ventrícula a través dunha cánula, a fin de determinar as consecuencias da exposición máis prolongada do citotóxico ELA. Aínda que non atopamos cambios funcionais similares ao ELA, atopamos unha maior expresión precoz das moléculas de sinalización neuroprotectora, unha reacción neuroinflamatoria precoz acompañada de microglásica activada e astroglyiosis, así como a sobreexpresión das proteínas citoplasmáticas ligadas a ELA como TDP-43, Cystatinac e Transferrina.
Material e métodos HEFFALPOQUIDO e Cytotóxica ELC Preparación (CELA-LCR)
As mostras de LCR foron recollidas pola punción lumbar en 32 pacientes con ALA diagnosticada segundo os criterios de diagnóstico do Escorial31 (25). ** extraído entre 1,5 e 3cc de cada paciente, centrifucado a 1.500 rpm durante 10 minutos, e dividido en 4 a 5 aliquetas para fins de estudo. Obtivo un consentimento informado de cada paciente. Dezaseis pacientes foron mulleres; A idade media da serie foi de 59 anos no momento da extracción de LCR. Catro pacientes tiñan a familia eo resto eran esporádicos; 11cases presentáronse como unha forma de aspecto bulbar, 20 casos sufriron o tipo de columna vertebral e un paciente presenta síntomas en ambos os lugares. Dos pacientes con ELA, só 4 mutacións presentadas no xene SOD1 e un era asintomático, o que significa que o CSF de pacientes con un mecanismo de SOD1 Genetics tivo unha presenza moi baixa no grupo ELA-LCR.Vinte mostras (68,7%) mostraron unha citotoxicidade significativa (Cela-LCR) usando o método descrito a continuación. As mostras de LCR utilizadas como controis (NO-ELA LCR) obtivéronse a partir de pacientes que padecen dor de cabeza ou convulsións e requiriron a punción lumbar durante un exame de rutina. Tamén se obtivo un consentimento informado dos controis. As mostras de LCR permaneceron conxeladas a -80 ° C ata que foron utilizadas.
Para demostrar citotoxicidade, as culturas celulares de neuronas de neuronas, como se describiu anteriormente24. Para estes experimentos, as neuronas obtivéronse da motocicleta cerebral de embriones de rata de 20 días. As células obtidas foron sementadas a unha densidade de 105 tacóns / ml en placas de 48 puntos que conteñen 0,25 ml de medio neurobasal complementados con B-27 e cultivados por 8-10 días. Logo deste tempo, as culturas foron incubadas por 24 horas cun 10% ELA-LCR e a viabilidade das neuronas medíase con ensaios MTT32. A ela-LCR xestión para os animais foi preparado por compartición de frascos de LCR que exhibiu efectos citotóxicos in vitro (a perda de polo menos o 20% de neuronas motores), e máis CSF incluídos no grupo que foi feita de pacientes con elo esporádica. As mostras de control de LCR para non tóxicos de 3 pacientes tamén foron considerados antes da ICV de administración.
Os animais
Os animais foron manipulados segundo os principios de laboratorio de coidados animais publicados polo Comité de Ética Española (RD 1201/2005) e a Directiva Europea 86/609 / CEE; O procedemento foi aprobado polo Comité de Ética para a atención e uso de animais de investigación no Hospital Clínico San Carlos de Madrid, España. As 28 ratas Wistar Albinas Os adultos masculinos foron obtidos dos laboratorios do río Charles. Todos os animais foron aloxados baixo un ciclo de luz / escuro 12h con acceso gratuíto a comida e auga. Foron enganados individualmente en condicións de colonias estándar no hospital clínico da zona San Carlos. O grupo LCR foi administrado ás ratas en 4 períodos. No primeiro período, 14 ratos entre 1 e 5 meses de idade (media de 3.25mes) e no segundo período, 12 ratos entre 2,5 e 5 meses de idade (media de 4,1 meses) foron inxectados co LCR descrito anteriormente. O intervalo entre os 4 períodos foi de aproximadamente 3 meses.
Grupos experimentais
Tres grupos experimentais foron deseñados para este estudo. O Grupo1 incluíu 9 ratas ás que se implementaron ICV minibumps cheas de pacientes non ELA (NO-ELA-LCR). Group2 estaba composto por 15 ratas implantadas ICV con minibumps citotóxicos ELA-LCR (CELA-LCR). Finalmente, as 4 ICV as ratas implantadas con minibumps cheas de salina fisiolóxica formaron o Grupo3 (grupo de tratamento simulado ou Sham).
Administración intríndicada de Cela-LCR ou NO-ELA-LCR
As ratas foron anestesizadas con TRIBROMETHANOL e Un minibús osmótico (0,15L / h; Alzet 2006, Alzet Palo Alto, CA, EUA) foi implementado por subcutáneamente. Introduza as escápulas. Antes do implante, os minibumps osmóticos foron cubertos coa preparación correspondente para cada grupo experimental. Os minibumps estaban conectados a unha cánula de infusión cerebral (Alzet) a través dun tubo de polietileno e prepáranse por inmersión en salina normal a 37 ° C por 24h. Estes procedementos realizáronse baixo condicións estériles. A cánula foi implantada no ventrículo cerebral lateral dereito (-0,5 mm anteroposterior, -1,4mm lateral e -3,3 mm dorsoventral (coordenadas baseadas no atlas paxinos) 33 e foron fixados ao cranio con cemento dental.
O volume de tanque das bombas garante o bombeo polo menos durante 42 días. O LCR foi inxectado intratecalmente a unha taxa de 0,15L / h por un período de 43, excepto as ratas sacrificadas ata a data 20. Os animais que permanecen no estudo que permaneceu Ata o día 82 estaban implantados cun tubo de polietileno selado mecánicamente para evitar a irritación local debido á atracción continua da auga á bomba.
Avaliación clínica
Os animais foron probados clínicamente a menos un día por semana desde unha semana despois da cirurxía. Todas as probas realizáronse cos examinadores cegos ao grupo experimental ao que pertencía cada rata. As avaliacións do estudo incluíron a medición do peso corporal, a resposta á proba de avión inclinada e á escala de motor Matsumoto34. Para medir o peso corporal, os animais foron pesados cada 4 tempada cunha escala dixital.Para a proba de avión inclinada, 20 ratas foron colocadas lateralmente contra o eixe longo do plano inclinado para medir o ángulo máximo no que poderían manter a súa posición no avión durante 5 anos. Para avaliar a forza de ambas as extremidades por igual, os animais foron colocados no plano inclinado co seu lado dereito do corpo contra a parte descendente da superficie inclinada, entón co lado esquerdo do corpo que vai baixando. Unha puntuación de menos de 70? Na proba plana inclinada, correlaciona ben coa aparición da debilidade muscular nos ratos transxénicos SOD1-G93A34. Para determinar a escala de motor Matsumoto34, a capacidade dos animais de endereitarse foi probada dentro dos 30 anos de ser manipulada a ambos os dous lados (reflexo do enderezamento). As ratas que foron capaces de enderezar a ambos os dous lados foron examinados pola súa capacidade de permanecer na súa gaiola de vivenda espontaneamente durante 1min. Se mostraron un pequeno movemento nas súas gaiolas, trasladáronse a outra gaiola para activar a motivación de exploración. Se as ratas non mostraron anomalías segundo estas avaliacións, foron examinadas a fondo para ver se tiñan déficits funcionais observables, como a parálise das extremidades ou os síntomas da debilidade do músculo xeral no campo aberto. Unha puntuación de 5 significa que o animal é normal e unha puntuación de 0 é unha rata completamente paralizada. A escala de motores de Matsumoto demostrouse correlacionada coa perda de neuronas do motor espiñal nun modelo de rato transxénico mutado de SOD1-G93A34
Exame electromiográfico
Un electromiograma de ratas de Cela-LCR e ratos non ELA -lcr foi realizado por día 82 por un neurólogo experto nesta técnica. A agulla foi inserida nas extremidades dianteiras e traseiras e nos músculos parábaros para tratar de atopar signos de gastos como actividade espontánea de inserción (ondas positivas, fibrilacións ou fasciculacións). As ratas estaban sedadas con isoflurane nun 1,5% en 0,7L / min. (60 mg / kg) e fentanil (0,3 mg / kg). En primeiro lugar, 10μL de colorante azul Evans foi inxectado a través dun catéter ventricular para confirmar a localización correcta. Os animais foron sacrificados pola perfusión intracadíaca cun 0,9% de salina seguido de paraformaldeído a 4% de buffer (0,1 millóns de buffer fosfato). Despois da perfusión, o cerebro ea medula espiñal foron disecados, lavados con 0,1 millóns de PB e crioproteccionados por inmersión ao 30% de sacarosa e en oct. O material foi almacenado a -80 ° C ata uso. Crioseciones (50μM) do motor Cortex e os segmentos cervical e lumbar da medula espiñal (C5-C6 e L3-L5) foron cortados; Os recortes foron colocados nunha solución de crioprotección que contén a glicol de etileno e a sulfóxida de dimetil e úsase para a preservación dos tecidos cerebrais. Das 9 ratas do grupo non ELA-LCR, foi sacrificado ata 20, de 7 a 45 días e un día 82. Das 15 ratas do grupo Cela-LCR, 4 foron sacrificados ata 20, 7 a día 45 e 6 por día 82 despois do implante. Finalmente, das 4 ratas do grupo de tratamento simulado, foi sacrificado o día 20, 2 a 45 días e un a 82 días.
Histoquímica e análise de inmunofluorescencia
4 cortes de manchas de inmunofluorescencia foron lavadas con PBS, Permeabilized Con 0,1% TRITON X-100 e bloqueado cun soro de cabra normal do 10%. Os seguintes anticorpos primarios foron entón aplicados durante a noite a 4 ° C: Anti-Periferin (1: 200, MilliPore, AB 9282); anti-s100b (1: 200, miliporo, 04-1054); anti-caspase-3 (1: 200, miliporo, 04-1090); Ácido fibrillar glial anti-proteína (GFAP) (1: 500, Dakocitomation, Z0334); Anti-gtl1 (1: 200, miliiporo, AB 1783); Anti-gfap (1: 600, miliiporo, MAB360); Anti-Tardbp (1: 200, ABCAM, AB42474); anti-ubiquitin (1: 100, abcam ab7780); anti-transferrin-r (1: 200, abcam, ab22391); Anti-Colin acetiltransferase (1: 100, ABCAM, AB68779); Anti-Metallothionein (1: 100, ABCAM, AB12228); Anti-Stefin (1: 100, ABCAM, AB68290); Anti-MHC II (1: 500, ABCAM, AB6403); Anti-Iba-I (1: 1.000, Wako, de 019-19741); Anti Panakt (sinalización celular 2920) e anti fosfoakt (sinalización celular 4060). As diapositivas foron lavadas en 3veces PBS, e os anticorpos primarios foron probados con Cy3 (1: 1,000, Jackson) ou con anticorpos secundarios conxugados Alexa 488, 555 ou 647 (1: 500, Invitróxeno). As seccións de 3veces foron lavadas en PBS, contrastadas con DAPI e montados co reactivo de fluorva (calbiochem).
Cantidade de datos inmunohistoquímica
Imaxes de fluorescencia foron adquiridas cun microscopio confocal de Olympus AF1000.Un estudo inmunohistoquímico descritivo realizouse dentro dos 3 períodos de tempo establecidos, unha análise dos cambios observados en marcadores inmunohistoquímicos ao longo do tempo e comparación entre os grupos de control e ELA-LCR. As análises histolóxicas examinaron as áreas estreitamente relacionadas con ELA, específicamente o motivo Cortex, a lámpada espinal e os segmentos espinales C5-C6 e L3-L5.
GFAP, IBA1, caspase-3 e MHC-II
Imaxes confocales que eran Adquirido coa mesma configuración e distribución de fluorescencia usando Olympus Confocal Software (Olympus flooview fv1000). A análise cuantitativa realizouse mediante a versión 1.42Q do software de análise ImageJ (EUA). O número de células inmuno-histoquímica positiva foi contado tomando forma aleatoria 368μm2 de cada zona analizada a partir de 3 a 4 seccións diferentes do cerebro coronal.
Periferin, S100B, Panakt, Fosfoakt e Medición de metalotioneína
para medir S100B, Panakt , Fosfoakt, METATOTHIONEIN e periferina, foi seguido unha versión modificada do método físico dissector descrito por Reed, usando o principio de Brick imparcial do 3D35 Dissector. A análise realizouse por medidas de densidade óptica (procesamento de imaxes binarias de branco e negro), obtendo a porcentaxe da área do campo analizado. 8 zonas por animal aleatoria foron seleccionados por un experimentador cego utilizando o software ImageJ 1,42 (NIH).
análise estatística
Os datos foron procesados mediante o software Graphpad Prism 5. Eles foron reportados como valores medios ± estándar Erro da media (SEM). Os gráficos dos resultados foron realizados usando o mesmo programa. O criterio para a importancia estatística foi P
0.05. Todos os animais sobreviviron ao implante ICV do minibús osmótico e ningún deles mostrou signos de infección (absceso, edema ou descarga purulenta no implante); Ningunha sufriu convulsións, agresión, piloería ou postración. A infusión foi feita durante 20 ou 43Dias eo curso temporal dos efectos da LCR ou a infusión de salina foi avaliada a 20, 45 e 82 días despois da implantación da bomba mini-emótica. Avaliación clínica e electromiográfica
Non se atoparon diferenzas significativas entre as ratas do grupo Cela-LCR e os outros grupos en calquera das avaliacións clínicas, incluído o peso corporal, o comportamento durante a proba de avión inclinada e as escalas de Matsumoto, que eran todos normais. En canto ás electroagramas, as ondas agudas atopáronse positivas nas extremidades traseiras, as extremidades dianteiras e os músculos parábaros sen a potencial de fibrilación ou fascismo en 6 das ratas do grupo Cela-LCR aos 82Dias despois do implante, o que non se produciu no controis, aínda que non se observou un patrón de denervación.
A activación e expresión microglial de GFAP, S100B, GLT1 e CASA-3
era obvio reactivo brillante, activación microglial e expresión de caspase-3 na cortiza de motor en Os 3 grupos experimentais aos 20 días despois do implante. Estes resultados poderían atribuírse a unha resposta inflamatoria secundaria á intervención cirúrxica. Non obstante, os 45 días despois da cirurxía, houbo un aumento significativo da reactividade glial e da resposta microglial en todas as rexións do grupo Cela-LCR (figs 1 e 2). Nos segmentos da medula espiñal dos animais que recibiron CELA-LCR, observouse que algúns motorionurons estaban envoltos por células microgliais. A cuantificación inmunohistoquímica do marcador IB-1 revelou alteracións na morfoloxía da microglía, pasando dun estado de descanso caracterizado por un som microglial con procesos finos e ramificados a unha microglía activada con escasas ramificacións. Os corpos móbiles alargados foron observados con procesos longos e máis espesos aos 20 anos despois do implante, mentres que as células ameboides atopáronse con corpos redondos con procesos curtos, grosos e robustos a 45 e 82 días, indicando unha activación de células fagocíticas na proximidade do motor neuronas. Estas células expresan MHC-II, que marca fases inflamatorias. En grupos de tratamento simulado e non ELA-LCR, a expresión de MHC-II foi 3 veces menor que a observada no grupo Cela-LCR (Figura 3). Un punto interesante foi a forte expresión dos astrocitos eo descubrimento de astrocitos hipertróficos que sobreexpresaron a GFAP nas proximidades das neuronas corticales do motor e a medula espiñal. Os cambios máis pronunciados foron observados nos 45 días despois da cirurxía. Houbo tamén unha expresión de MHC-II, pero a niveis máis baixos, aos 82 días (Fig. 3). Ao contrario dos datos observados no Grupo Cela-LCR, atopouse unha diminución da expresión de GFAP e Caspase-3 nos outros 4 grupos, incluídos os 82 días despois da cirurxía.Do mesmo xeito, observouse un lixeiro aumento na expresión do transportador de glutamato GTL1, que foi ligado ao ELA, ea súa expresión é modificada por ELA-LCR36. O GTL1 atopouse nas proximidades das neuronas do motor espinal do grupo Cela-LCR que se correlaciona coa expresión de GFAP como unha activación de astrocitos. A sobreexpresión de S100B apareceu a 45 e 82 días no Grupo Cela-LCR só.
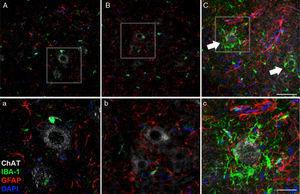
45 días despois da cirurxía, aumentou a reactividade glial e a resposta microglial no grupo CELA-LCR en todos Estudaron as rexións cerebrais, era evidente. Por exemplo, no corno anterior (segmento lumbar) de ratas de Cela-LCR, atopamos unha maior expresión de GFAP con abundantes astrocitos hipertróficos (panel C, C); Ademais, identificouse unha maior densidade das células positivas IB-1 con procesos ampliados, moitas veces en estreita proximidade coas neuronas motoras ou mesmo que rodean estas neuronas (frechas no panel C, frechas e detalles do panel C). Estes cambios non foron observados nos grupos Sham e Non-LCR, nos que as células microglías illadas ocasionalmente observaron preto das neuronas do motor. Escala: A-C: 60μM; Detalles AC: 30μM.
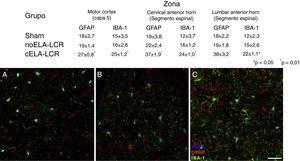
Imaxe de microscopía confocal do motor Cortex, exemplar os datos presentados en táboas (diferentes momentos do estudo) O aumento das células IB-1 e GFAP positivo nos animais do grupo Cela-LCR (C) é evidente, en comparación co grupo Sham (a) eo grupo Nola-LCR (B). Capa de casca de motor 4-6, 45 anos despois da cirurxía. Escala de barras: 50μM.
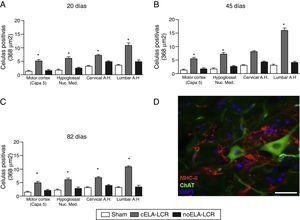
AC) Análise cuantitativa da expresión de MHC-II en varias rexións do cerebro e mediante a medula espiñal, nos 3 períodos de tempo estudados. O grupo Cela-LCR mostrou un aumento significativo no número de células microgliais, que é unha evidencia clara dunha etapa neuroinflamatoria. D) Imaxe representativa de células positivas para MHC-II na rexión lumbar. Estas células tamén foron observadas nas proximidades das neuronas motoras. Escala: 50 m; * p0.05; Os datos móstranse como media.
(0.28MB).
de Panakt e fosfoakt
Para comprender se o aumento da caspase-3 foi acompañado dun aumento da expresión proteica estreitamente relacionada coa resistencia á supervivencia e da apoptose, Tales como Fosfoakt e Panakt, levouse a cabo a súa cuantificación. Basicamente, o grupo de tratamento simulado eo grupo NO-ELA-LCR mostraron cambios significativos ao longo do estudo (20, 45 e 82 días).Non obstante, no grupo Cela-LCR, os aumentos significativos en Panakt e Fosfoakt foron atopados a 45 días, cunha expresión inmunohistoquímica que era 3 veces maior que os niveis observados nos outros grupos, pero a 82 días despois da cirurxía estes datos eran similares ao grupo de tratamento simulado (fig. 4).

Expresión Panakt (AKTPAN) e Fosfoakt (AKTFOSFO) en varias rexións do sistema nervioso central do 3 grupos de ratas. A) Fotos de microscopía confocal da expresión de PANAKT, FOSFOAKT e periferina (perip). B) Análise de Fosfoakt e Panakt de cuantificación de densidades ópticas. As maiores expresións de Aktpan e Fosfoakt foron observadas a 45 días no grupo Cela-LCR (A e B). Un fenómeno interesante no grupo Cela-LCR foi o aumento da expresión de periféricos, fosfoakt e Panakt en neuronas (a). O día 82 despois da cirurxía, as concentracións de AKT (PAN e FOSFO) eran similares ás dos grupos de Sham e non ELA-LCR, a expresión volveu a niveis similares aos observados nos outros grupos a 82 días de post cirurxía ( B) Cirurxía. Escala: 50μm.
A expresión periferina
periferina ten un papel importante no transporte axonal nas neuronas do motor espiñal. Recentemente, a periférica tamén se asociou con algunhas neuropatoloxías que caracterizan o esporádico ELO, xa que se atopa no bun ferroviario. Polo tanto, consideramos relevantes para analizar os periféricos nas neuronas motores, xa que a súa expresión está relacionada cos elams esporádicos. Todas as seccións do grupo Cela-LCR mostraron neuronas motoras con expresión periférica positiva (figuras 5 e 6), pero nos animais sacrificados a 45 días, os niveis 4 veces maior que os dos outros grupos e os puntos de tempo analizados (Fig . 6). Doutra banda, as células con máis inmunoreactividade do periférico tamén expresaron con Panakt e Fosfoakt. Estas células mostraron o marcador periférico cun patrón filamentario, que tamén se observa en condicións normais; Con todo, o grupo Cela-LCR, tamén foron observados células que conteñen a etiqueta periférico en inclusións citoplasmáticas lembrando estruturas robustas ou granulares, que pode, posiblemente, provocar a formación de precipitados ou inclusións de proteínas (Fig. 5).
Expresión periferina (peri), Ubiquitin (UBIQ) e transferrina despois da infusión de Cela- LCR. Aos 45 e 82 días despois de que os animais de cirurxía con trato de cesamento LCR mostraron inclusións en citoplasma e tiñan etiquetaxe positiva de ubiquitina en neuronas. As inclusións ubiquitinas (frechas) foron colocadas con periféricos e, ocasionalmente, con transferrina. Escala A-C: 20μm; AC e D: 2μM.
Immunofluorescence imaxes que amosan a expresión do periférico (Peri) ao longo do curso do estudo no grupo CELA-LCR (A: 20Dias, B: 45 días, C: 82Days). Un aumento temporal do periférico foi observado nas neuronas do motor o día 45, que volveu ás condicións basais por día 82. O aumento da expresión periférica foi asociado cos eventos da lesión da columna, mentres que a expresión é baixa en condicións normais Escala: 40μm.
Co-expresión de cistatina C, transferrina, ubiquitin e TDP-43
No grupo Cela-LCR, a 45 e 82 días despois das células de cirurxía observáronse cunha maior expresión de ubiquitina , transferrina (Fig. 5) e Cistatinac. Estes datos están intimamente ligados a formas esporádicas de ELA38. Doutra banda, observouse que había unha translocación de TDP-43 no citoplasma das neuronas do motor (Fig. 7). Curiosamente, a análise inmunohistoquímica por microscopía confocal revelou inclusións de TDP-43, Ubiquitin e Cystatinac, e estas proteínas foron colocadas no citoplasma das neuronas motoras. O aumento destas inclusións a 82 días foi acompañado dunha diminución da expresión periférica (fig. 6).
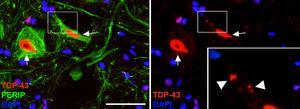
Imaxes en que se observa que os animais tratados con Cela-LCR mostraron inclusións citoplasmáticas de TDP- 43 Nas neuronas da medula espiñal (frechas). En detalle, obsérvanse inclusións (frechas). Escala: 40μM.
Como algúns estudos suxeriron que a homeostase de cobre e zinc podería contribuír á patoxenesia do ELA, estudouse a expresión de metalothioneina39.40. A expresión de metalotioneines estaba relacionada co curso temporal de cambios despois da cirurxía (45 e 82 días) e só ocorreu no grupo Cela-LCR, no que se observou nas neuronas motoras que co-expresaron Ubiquitin e transferrina. O aumento do S100B medido a 45 e 85 días despois da cirurxía estaba intimamente relacionada co aumento dos periféricos nas proximidades das neuronas motoras. As células que expresan S100B correspondían ao fenotipo de astrocitos (GFAP +) de neutrófilos adxacentes á neurona do motor. Os astrocitos que expresan S100B están intimamente relacionados co equilibrio de calcio, cinc e cobre. S100B é unha proteína de unión de calcio expresada exclusivamente por células gliales. Discusión
O presente estudo ten como obxectivo determinar as consecuencias da administración sostida ELA-LCR en ratas para comprender os efectos que poden ocorrer en pacientes que presentan citotoxicidade na súa CSF. Isto demostra que a infusión de ICV sostida de CELA-LCR en ratas produce cambios citohistoquímicos no cerebro e medula espiñal que se asemella aos que se atopan en pacientes con ELA esporádico. Estes cambios non foron observados en ratas infundidas con salinas ou en animais infundidos con NO-ELA-LCR. A infusión realizouse durante 20 ou 43Dias e os tecidos foron analizados a 20, 45 e 82 días despois da implantación da cánula. Os animais do estudo que foron sacrificados aos 82 días recibiron a infusión durante os primeiros 43dies só.
Os cambios relevantes nas células en 45 días foron unha activación microglial seguida da astrogliosis. A activación e proliferación da microglía antes da aparición de signos clínicos tamén se producen en pacientes con ELA41, así como os ratos transxénicos SOD1-G93A42. Ademais, en ratones transxénicos, a microglia activada aparece antes da aparición da perda neuronal43. Isto mantense en liña coa observación de que a expresión reducida de SOD1-G93A nas células microgliais retarda a progresión da enfermidade e prolonga a supervivencia44. Pola contra, as células microgliais que expresan o aumento do SOD1-G93A na neurotoxicidade e aumento da produción de citoquinas, sen e MCP-1 despois da activación en vitro45. Estes descubrimentos apoian a idea de que a activación de Microglia pode desempeñar un papel relevante no desenvolvemento de ELA46.47. Ás 45 anos despois do implante (43 días de infusión con ELA-LCR) atopamos células de microglia nas neuronas da medula espiñal.Estas células mostraron a morfoloxía típica da activación concomitante con maior expresión de MHC-II, que se considera que é un marcador da resposta inflamatoria dependente do complemento4.49. A astrogliosis está claramente presente, aínda que a súa participación na patoxenesia do ELA aínda é descoñecida e se aparece antes ou despois da activación microglial. Outro descubrimento notable foi a sobreexpresión de S100B en astrocitos a 45 e 82 días. Esta proteína foi correlacionada con supervivencia en ELA50.51 e está regulada en astrocitos e neuronas motoras da medula espiñal en pacientes52, así como en ratas infundidas durante 48 horas con ELA-LCR53. Os astrocitos con inclusións tamén están presentes en ratones mutantes SOD154. Do mesmo xeito, observouse que a astrogliose ea sobreexpresión do GFAP apareceron despois da activación de Microglia. Isto podería apoiar a idea dun mecanismo de neuroinflamación como evento precoz na patoxenesia da enfermidade.
Nos últimos anos, a énfase foi colocada sobre a translocación citoplasmática do TDP-43, unha proteína codificada por O xene cuxas mutacións de Tardbp asociáronse a ELA4. Observamos que TDP-43 atópase en inclusións ubiquitinas no ELO esporádico, pero non nos casos SOD1 mutado. A presenza citosólica do TDP-43, colocada con ubiquitina, a 45 e 82 días no grupo Cela-LCR apoia a idea de que estes cambios están relacionados coa ELA esporádica. Isto é reforzado polos nosos resultados que os primeiros cambios nas neuronas motores incluíron a sobreexpresión da cistatina, a transferrina e a periférica, 3 proteínas que están intimamente ligadas aos corpos de Buni no ELA37.55.56 esporádicos. De feito, as mutacións periféricas xa foron asociadas coa ELA57 esporádica.
Outra variable que foi avaliada foi a PILA de sinalización PI3K / AKT relacionada coa supervivencia celular58. Atopamos un aumento na expresión de Panakt e Fosfoakt un día 45 en ratas tratadas con Cela-LCR. Este foi un interesante descubrimento considerando que a periferina tamén é un substrato PI3K. É interesante notar que o aumento da expresión PI3K, pero non a AKT, atopouse na medula espiñal dos pacientes con ELA59. Non obstante, o aumento de Fosfoakt foi observado en medias espiñales dos ratos SOD1-G93A na PHASE60 asintomática. Doutra banda, os estudos in vitro indican que PI3K / AKT está alterado en células de ratas mutadas SOD1-G93A61. Polo tanto, a vía periférica e PI3K / AKT podería aumentar como resposta ao estrés celular causado por CELA-LCR. O aumento da caspase-3 como sinal de apoptose nestas ratas é compatible con este punto de vista e co achado de neuronas motoras apoptóticas en ELA62-64.
O último descubrimento que debería mencionarse O aumento da expresión de metalothionein en ratas infundido con CELA-LCR. Isto está de acordo cos niveis máis altos de niveis máis altos de metalóticos en ratones mutados SOD165-67; Un aumento similar no seu ARNm tamén foi descrito nestes ratón68. Deportes con isto, é a observación que nos ratos que proveñen do cruzamento de roedores con ELA e deficiente de metalothionein, a progresión da enfermidade68 é acelerada e que a súa maior expresión representa un mellor. En contraste, a expresión de metalotione e o seu ARNm diminuíu en ELA70. Os metalotiones son proteínas de unión CU / ZN que reducen os produtos reactivos de osíxeno e contrarrestar a toxicidade do metal. Neste contexto, a procura dunha maior expresión metálica pode significar que se desenvolve unha reacción neuroprotectora en resposta á infusión crónica de Cela-LCR na rata; Isto mantense en liña co descubrimento, a maior expresión da metalothionein nas neuronas motoras da medula espiñal de ratones mutados con ELA, que intenta evitar a perda de neuronas e inhibe a progresión da enfermidade71.
Os descubrimentos histopatolóxicos descritos son compatibles coa hipótese de que CSF citotoxicidade nas ratas, as semanas inducidas de infusión de ICV prolongada de CELA-LCR, producen cambios nunha medula espiñal e medula espiñal similar ás formas esporádicas de ELA. O noso estudo mostra algunhas limitacións. En primeiro lugar, os síntomas clínicos están ausentes nos 3 períodos estudados (20, 45 e 82 días). Nos ratos SOD1-G93A-ELA, os primeiros síntomas clínicos aparecen a 90-100 días de idade, pero os roedores con outras mutacións poden comezar a mostrar síntomas clínicos a posterior38. Observáronse as primeiras anomalías, como a fragmentación de Golgi ata a idade de idade; Tamén parece posible que os cambios sutís ocorren antes que a idade de 2004. En ratones con mutacións SOD1, as primeiras alteracións aparecen na medula espiñal cervical38.Tamén se observaron cambios na medula espiñal cervical e lumbar similar aos observados no cortexo do motor cerebral, o que indica que o efecto nocivo da Cela-LCR infundido no ventrículo cerebral estendeuse distal á medula espiñal. Esta observación é compatible coa hipótese de que a progresión da enfermidade pode ser mediada en parte a través do CSF. En segundo lugar, aínda se detectaron varios marcadores de proteínas que están sobreexpresados en 45 anos, aínda que en concentracións menores, a 82dias (é dicir, periféricos, GFAP, PANAKT e FOSFOAKT); Noutros, está sobreexpresado por igual a 45 e 82Dias (é dicir, a cistatina, a transferrina, a Ubiquitin e a translocación TDP-43), aínda que coa limitación que os tamaños de mostra de grupos de estudo non eran similares e o número de ratas dos grupos de control era baixo .. Non obstante, a expresión anormal destas proteínas no grupo Cela-LCR está clara e os diferentes resultados nos grupos de control confirman que os cambios non se deben aos artefactos do método. En terceiro lugar, Cela-LCR foi infundida por ICV para 43Dias, que foi o prazo máximo para o volume de Minibump. A pesar do feito de que CELA-LCR non foi administrado entre o día 43 e o día 82, só se observaron as neuronas do motor apoptótico nos animais examinados no día82. Isto suxire que o proceso nocivo podería permanecer activo despois do día 43 e, polo tanto, parece posible que a extensión da infusión de CELA-LCR máis aló de 43Dias e / ou o próximo curso temporal da enfermidade máis aló de 85 días podería revelar as manifestacións clínicas dun das neuronas motores similares aos das formas esporádicos dela.
En conclusión, o presente estudo presenta as primeiras consecuencias da LCR-ELA citotoxicidade tras semanas de infusión ICV sostida con CSF de pacientes con ELA, que fora previamente Comprobou que mostraron efectos citotóxicos nunha cultura primaria de neuronas motoras. Aos 45 e 82 días despois do inicio da infusión, o motor Cortex, o Talloam ea medula espiñal cervical-lumbar mostraban varios cambios nos marcadores típicos da enfermidade de ELA humana. Estes descubrimentos poden mellorar a nosa comprensión da patoxenesia e evolución do ELA e axudar a atopar novos obxectivos terapéuticos útiles para o desenvolvemento de novos compostos que atrasan ou incluso arrestan a progresión da enfermidade.
Financiamento
Este estudo foi apoiado por catro bolsas concedidas a JMG por Mutua Madrileña, España, en 2008 e 2009. Tamén foi apoiado polas seguintes bolsas concedidas a AGG polas institucións españolas: 1) NDE07 / 09, Axencia de Entralgo de Laín, Comunidade de Madrid; 2) Eugenio Rodríguez Fundación Pascual; 3) Fundación Cien, Carlosii Institute of Health; 4) Renevas-Retics-RD06-026, Instituto Carlosiii; 5) SAF 2010 a 21795, Ministerio de Economía e Competitividade, España e 6) MAT2011-28791-C03.
Conflito de intereses
Os autores declaran que non hai conflitos de interese.
Recoñecementos
Os autores queren agradecer a colaboración de Pablo González e M. Cruz Rodríguez para a coordinación dos procedementos de coidados de animais e a Fundación Teófilo Hernando para o seu continuo apoio.