Originals
Étude des effets indésirables liés à PaclitaxEL Infusion et de DOCETAXEL
Etude sur le Réactions publicitaires liées à Paclitaxel et à la perfusion de docétaxel
i. J. Castro1, M. Pons Busom1, GI Ballesteros Cabañas1, E. Ramió Montero1, A. Álvarez Méndez2, R. De Castro Chivato3, M. Centelles Ruiz4
1Servicio de Farmacia, Capio Hospital Universitari Sagrat Cor, Barcelone Espagne.
Service de pharmacie 2NFERmera, Hôpital Capio Universitari Sagret Cor, Barcelone, Espagne.
3NEFERmermera Day Hospital, Hôpital Capio Universitari Sagret Cor, Barcelone, Espagne.
4Songologie, l’hôpital de Capio Universitari Sagret Cor, Barcelone, Espagne.
Ce travail a été partiellement présenté comme une communication d’affichage dans le 56e Congrès national de la société pharmacie espagnole qui s’est tenue à Santiago de Compostelle Du 18 au 21 octobre 2011.
Gestion de la correspondance
Résumé
Objectif: Déterminer l’incidence des réactions à la perfusion de PaclitaxEL et de DOCETAXEL, et les causes possibles qui peuvent les déclencher.
Méthode: Étude de cohorte des infusions PaclitaxEL et du docétaxel effectuées à l’hôpital de troisième niveau, de juillet 2010 à décembre 2011 (18 mois). Pour chaque perfusion, les données cliniques du patient et ceux qui se réfèrent aux taxanes gérés ont été enregistrés. Compte tenu de l’apparition d’une réaction pendant la perfusion, il a été spécifié: type, sévérité et s’il a forcé la suspension du traitement. Des histoires cliniques et des ordonnances médicales ont été consultées. Le suivi des infusions a été mené en contactant les infirmières de l’hôpital de la journée. Une étude descriptive des variables les plus pertinentes incluses dans le suivi a été réalisée et analysée si l’un d’entre eux pouvait influencer l’apparition des réactions. Résultats: Au cours de la période d’études, 357 perfusions de paclitaxel et de docétaxel ont été administrées à 92 patients: moyenne de 61,4 ans (de 11,1), 50,0% de femmes. 9 réactions infusionnelles ont été détectées qui ont affecté 8 patients, tous causés par le docétaxel (χ2 = 8,3, p = 0,004); 14,5% des patients qui l’ont pris et toujours pendant le premier ou le deuxième cycle de traitement. Les variables associées de manière significativement liée à l’apparition de réactions étaient: le néoplasme pulmonaire (p < 0,005), schéma docétaxel-cisplatine (p < 0.005) , Recevez le médicament sur la première ligne (p = 0,021) et une maladie sans connaissance (p = 0,014).
Conclusions: Dans notre centre hospitalier, la docétaxel est le taxane qui a provoqué davantage de problèmes de sécurité pendant votre perfusion.
Mots-clés: Paclitaxel; Docétaxel; Réaction d’hypersensibilité.
Résumé
Objectif: Déterminer l’incidence des réactions associées à la perfusion PaclitaxEL et de DOCETAXEL et les causes probables qui peuvent les déclencher.
Méthode: Étude de cohorte des infusions PaclitaxEl et de docétaxel effectuées dans un hôpital tertiaire de juillet 2010 à décembre 2011 (18 mois). Pour chaque perfusion, les données cliniques et les données liées à la drogue ont été enregistrées. Lorsqu’une réaction s’est produite lors de la perfusion, les données suivantes ont été spécifiées: type, sévérité, si le retrait de traitement était nécessaire. Les tableaux cliniques et les ordonnances de traitement ont été examinés. Le suivi des infusions a été fait en contactant les infirmières de l’hôpital de garderie. Une étude descriptive a été réalisée pour les variables les plus pertinentes incluses dans le suivi et nous avons analysé si l’un d’entre eux aurait pu avoir une influence sur la survenue des réactions. Résultats: Au cours de la période d’étude, 357 infusions de Paclitaxel et de docétaxel ont été administrés à 92 Patatifs: Âge moyen de 61,4 ans (SD 11.1), 50,0% étaient des femmes. 9 perfusion réagissants affectant 8 Patatifs ont eu lieu, tous causés par le docétaxel (χ2 = 8,3, p = 0,004); 14,5% des patients le reconvient et toujours pendant le premier ou le deuxième cycle de traitement. Les variables associées de manière significative à la survenue de la réaction: cancer du poumon (p < 0,005), régime de docétaxel-cisplatin (p < 0.005) , Recevoir le médicament comme première ligne (p = 0,021) et maladie non avancée (p = 0,014).
Conclusions: À notre hôpital, le docétaxel est le Taxane qui a provoqué les problèmes de sécurité les plus fréquents pendant la perfusion.
mots clés: paclitaxel; Docétaxel; Réaction d’hypersensibilité.
Introduction
Depuis quelques décennies Il y a quelques décennies, les taxans paclitaxel et le docétaxel se sont révélés efficaces dans une variété de tumeurs. Paclitaxel est approuvé pour le traitement de la poitrine, des pulmonaires (cellules non-petites) et des ovaires; et docétaxel pour sein, poumon (cellules non-petites), tête et cou, adénocarcinome gastrique et prostate1,2.L’action cytotoxique du taxane est maintenue dans la stabilisation de la tubuline et la formation ultérieure de microtubules non fonctionnels qui déclenchent une mitose erronée, de sorte que les cellules cancéreuses cessent de la division et de la fin par la mort1-3. Dans des études précliniques, il a été démontré que le docétaxel a été démontré plus efficace que Paclitaxel, car il rejoint Tubulin avec une plus grande affinité, présente une action directe antitumororiale par activation des voies apoptotiques et une plus grande rétention dans les cellules tumorales4.
L’un des inconvénients présentés Par ces substances, leur faible solubilisation nécessite donc l’utilisation de véhicules de tensioactifs non ioniques pour leur formulation. Le cremophor, dérivé polyoxyéthylé de l’huile de ricin, est la solubilisation utilisée pour le paclitaxel et le polysorbate 80 (Tween 80), un autre dérivé polyoxyéthylé, est pour le docétaxel. Ces deux véhicules augmentent les interactions pharmacologiques avec d’autres antinéoplastiques (par exemple, des anthracyclines) et peuvent modifier la pharmacocinétique des médicaments avec lesquelles ils sont formulés, prédisposés à une toxicité plus grande, en particulier dans le cas de Paclitaxel par sa pharmacocinétique non linéaire4-6. Pour minimiser les réactions indésirables, éviter la prémédication et réduire les temps d’administration PaclitaxEL et DOCETAXEL, de nouvelles stratégies de formulation telles que les nanoparticules d’albumine, les polyglutamats, les promédicaments, les émulsions ou les liposomes5 ont été développés. À ce jour, seule la nouvelle formulation paclitaxel basée sur des nanoparticules d’albumine (Abraxane®) a été commercialisée en Espagne.
Le profil de sécurité de ces agents antitumores est divergent; Bien que Paclitaxel soit plus associé à des neuropathies périphériques, des myalgies et des arthralgies, la prise en charge des liquides (gain de poids, inflammation des chevilles ou de la zone abdominale) 5.7. Approximativement avec la même fréquence, les deux médicaments peuvent causer des réactions à la perfusion (dyspnée, douleur thoracique, angioedème, hypotension, urticaire et éruption cutanée) qui dépendent des caractéristiques du taxan, du solvant ou des deux, et dont l’apparence est possible. , entre autres causes, à la perfusion rapide de ces préparations8,9. Ces réactions, souvent également appelées réactions d’hypersensibilité, se produisent généralement pendant les premières minutes d’infusion et généralement dans la première ou la deuxième dose, pouvant apparaître même avec une prémédication adéquate à base de corticostéroïdes et antihistaminiques8.10.
tout Cela a motivé notre intérêt à déterminer l’incidence des effets indésirables liés à la perfusion des taxans paclitaxel et de docétaxel dans notre centre, et les causes possibles pouvant les déclencher.
Méthode
Étude observationnelle, longitudinale et prospective de tous les infusions paclitaxel ou de docétaxel de juillet 2010 à décembre 2011, dans un hôpital universitaire du niveau 3 sans greffes.
Les patients traités avec paclitaxel ont reçu la prémédication orale avec dexaméthasone 8 mg le jour précédent à la chimiothérapie, et le même jour par voie intraveineuse: Ondansestron 8 mg, Dexameton 8-12 mg, Dexchlorofeniramine 5 mg et ranitidine 50 mg, 30 minutes OS avant votre administration. La prémédication utilisée pour le docétaxel était composée de dexaméthasone orale de 8 mg deux fois par jour pendant trois jours, à partir d’une journée avant la chimiothérapie, ainsi que la même journée intraveineuse: Ondansestron 8 mg et dexaméthasone 8-12 mg, 30 minutes avant votre administration.
Les marques de commerce utilisées étaient Paclitaxel Hospira® dans le cas de Paclitaxel et de Taxotere® et de Docetaxel Hospira® pour le docétaxel. Le docétaxel a été administré dans un sérum physiologique de 250 ml pendant 60 minutes et paclitaxel dans un sérum physiologique de 500 ml en 180 minutes d’infusion. En polyquimiothérapie, les taxanes ont toujours été administrées en premier, de sorte que les réactions pouvant apparaître au cours des premières minutes de perfusion ne pouvaient être attribuées qu’à eux.
Un suivi quotidien a été effectué de toutes les administrations de taxanes et Les variables suivantes ont été enregistrées:
• Données du patient: âge, sexe, nombre d’historique clinique et oncologue responsable.
• Clinique Données: néoplasie, stade, histoire pathologique, allergies, médicaments habituels et traitements chimiothérapeutiques antérieurs au cas où il y en avait.
• Données concernant le traitement de l’oncologie: Type de taxan (y compris le nom commercial), la dose, la fréquence, le cycle, le concomitant Chimiothérapie et prémédication.
• Apparence de toute réaction indésirable à la drogue (RAM) lors de la perfusion de taxane, de type et de sévérité en fonction de la classification NCI-CTCAE V.3.0 2006 du cancer national ISITUTE11 .
Pour enregistrer les données relatives au patient, les dossiers médicaux ont été consultés.Les données faisant référence au traitement oncologique ont été obtenues à partir de la prescription par le cycle du patient et du traitement. Le suivi de chaque infusion a été effectué par le pharmacien responsable de la zone de cytostatique et du pharmacien des résidents en contactant l’infirmière de l’hôpital de la journée chargée de l’administration du Taxane. Le rapport de causalité des réactions a été déterminé par l’algorithme de Karch-Lasagna modifiée12.
L’analyse statistique des variables qualitatives et quantitatives a été réalisée avec le programme SPSS V.15.0. Il a été évalué si la variable dichotomique de RAM principale ne le fait pas, il était associé de manière significative à chacune des variables indépendantes. Le test chi-carré a été utilisé pour les variables catégoriques et l’étudiant T pour la comparaison de moyens dans des échantillons indépendants, prenant P < 0,05 comme rapport statistiquement significatif.
L’étude a été approuvée par le comité d’éthique de la recherche clinique de l’hôpital et requis pour sa mise en œuvre du cabinet de consentement éclairé par des patients atteints des critères d’inclusion.
résultats
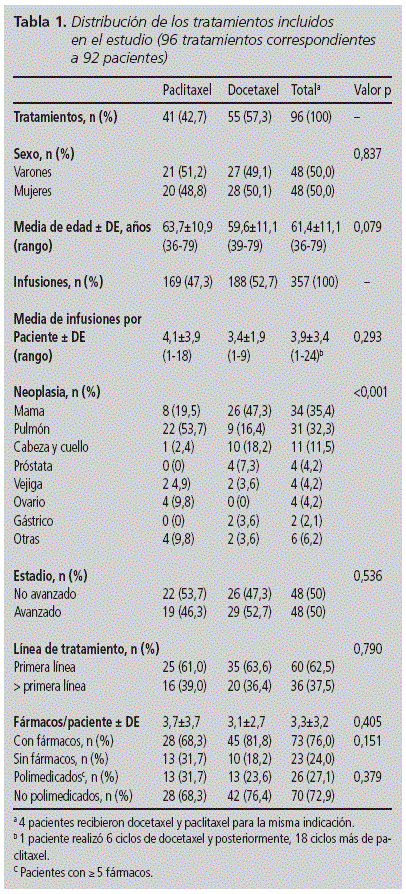
au cours des 18 mois d’études , 4 689 médicaments oncologiques ont été infusés, dont 7,6% correspondaient aux taxes incluses dans le suivi. Au total, 357 perfusions de paclitaxel et de docétaxel administrées à 92 patients (50,0% des femmes), âgées de 36 à 79 ans et d’un âge moyen de 61,4 ans (à partir de 11.1). Le docétaxel était le taxan le plus couramment utilisé par le nombre de patients (N = 55, 57,3%) et des infusions (n = 188, 52,7%). Aucune différence significative n’a été trouvée dans les variables basales des deux cohortes, à l’exception de la répartition des néoplasmes (tableau 1): l’indication la plus courante pour le docétaxel était le cancer du sein (47,3%), tandis que pour Paclitaxel était le poumon (53,7%). Plus de la moitié des patients ont reçu le traitement sur la première ligne (62,5%).
Un total a été utilisé de 36 protocoles chimiothérapeutiques, étant le système le plus utilisé pour la docétaxel et le paclitaxel la combinaison avec la carboplatine (tête et cou et cancer du poumon respectivement) (tableau 2).
9 réactions infontrices correspondant à 8 patients (8,7% de le total), tout causé par le docétaxel (χ2 = 8,3, p = 0,004) et toujours pendant le premier ou le deuxième cycle de traitement. Ainsi, 4,8% des infusions de docétaxel ont provoqué une réaction, dont 66,7% (n = 6) sont apparues au deuxième cycle de traitement et ont finalement atteint 14,5% des patients ayant reçu cette chimiothérapie. Si seulement les infusions de docétaxel administrées pendant le premier ou le deuxième cycle sont sélectionnées, l’incidence des réactions augmente jusqu’à 10,5% des administrations. Dans tous les cas, les réactions sont apparues chez des patients âgés de moins de 65 ans (56,3 ans de 4,1), non polymédiées, sans allergies précédentes connues et sur la première ligne de traitement.
Les 66,7% ( n = 6) des réactions ont été considérées comme modérées selon NCI-CTCAE V.3.011. Dans l’un des cas, la réaction a été considérée comme très grave depuis que des mesures de soutien vital étaient nécessaires. C’était le seul cas dans lequel la réaction a motivé la suspension du traitement. Chez 6 patients, la retraite de docétaxel a été tolérée sans problèmes et chez deux patients ont été administrés par la suite paclitaxel sans incident (tableau 3). Selon l’algorithme de Karl-Lasagna Modified12, toutes les réactions ont été classées comme probables.
dans le groupe des mâles 5 Les réactions sont apparues sous la forme d’un cancer du poumon de dénominateur commun et de schéma Docetaxel 75 mg / m2 + cisplatine 75 mg / m2 C / 21 jours. Ce système a été administré à un total de 6 patients, de sorte que 83,3% de ceux qui ont reçu ce protocole ont présenté une réaction à la perfusion. Dans les 3 réactions apparues chez les femmes, la seule néoplasme impliquée était la poitrine et les protocoles chimiothérapeutiques étaient 2 fois la combinaison avec Trastuzumab et en une avec de la carboplatine.
dans cette étude les variables qu’elles sont corrélées Statistiquement avec l’apparition de réactions à la perfusion de DOCETAXEL étaient les suivants: néoplasme pulmonaire (p < 0,005), docétaxel-cisplatin (p < 0,005) , recevez le médicament sur la première ligne (p = 0,021) et dans une maladie non avancée (p = 0,014). Cependant, une telle corrélation n’a pas été observée avec des variables de sexe, d’âge et d’habitude.
discussion
L’efficacité des taxes peut être compromise par l’apparition des réactions d’hypersensibilité au cours de sa perfusion. Parfois, celles-ci peuvent forcer à suspendre le traitement devant avoir recours à d’autres régimes pouvant être moins efficaces.
Dans la littérature scientifique, il est décrit que le docétaxel et le paclitaxel provoquent des réactions d’hypersensibilité avec une fréquence près de 30%, mais diminue jusqu’à 2 à 5% si le prétraitement est effectué avec des corticostéroïdes et des antihistaminiques, et s’il est réduit le taux de perfusion1,2,8,13,14. Dans notre étude, Paclitaxel n’a causé aucune réaction avec la prémédiation utilisée et l’infuse pendant 3 heures2. Cependant, 9 épisodes sont apparus avec du docétaxel (14,5% des patients) l’administrant pendant une heure et des experts à l’hôpital de la journée la prémédication recommandée sur la sécurité technique1. La plupart des réactions (6) ont été résolues en renforçant la prémédication et en réduisant la vitesse d’administration de 250 ml / h à 125 ml / h et augmentant ensuite la vitesse progressivement. Certains auteurs, mis à part la réduction de la vitesse de l’administration, recommandez également d’autres options telles que la réduction de la concentration de drogue à administrer ou à examiner l’application de protocoles de désensibilisation en augmentant les perfusions Doses15. Il existe également des études qui préconisent également de modifier un taxan par un autre lorsqu’une réaction d’hypersensibilité apparaît à l’une d’elles19-21. Certes, les changements peuvent favoriser la poursuite du traitement, mais il existe une controverse à cet égard, car d’autres auteurs tels que Dizon et al.14 estiment que cela n’est pas possible en raison de l’existence d’une réactivité croisée entre les taxanes. Dans notre suivi, il n’existait aucune réactivité croisée de ce type, car deux patients présentés une réaction infontronomie à la docétaxel ont reçu Paclitaxel sans incident. Chez 6 patients, la retraite de docétaxel a été bien tolérée, cependant, il y avait un patient qui après avoir présenté une réaction modérée à la docétaxe, réenregistrez-le de ce taxan et a de nouveau présenté une réaction, cette fois considérée comme sévère et qui a provoqué la suspension définitive du traitement. En tout état de cause, ce qui est clair, c’est que l’administration de tout taxane est contre-indiquée si la réaction d’hypersensibilité causée par l’un d’entre elles est grave (3-4 grade) 1.2.
symptômes connexes avec ces réactions, ils sont généralement apparaissent dans la première ou la deuxième infusion de chimiothérapie et, généralement, dans quelques minutes de la base, comme cela s’est produit chez les 9 patients concernés dans notre suivi. Par conséquent, une attention particulière doit être accordée dans les premières administrations de taxane, organiser à tout moment du personnel expérimenté et le soutien d’une équipe de réanimation en cas de réaction qui menace la vie du patient22. Les autres soins qui pourraient être effectués sont la surveillance de la pression artérielle et de l’observation du patient jusqu’à 2 heures après l’administration des taxanes.
Dans notre étude, la symptomatologie du patient qui avait une réaction infontronomie à la docétaxel très grave était caractérisée par une cyanose. , perte de conscience, crise, insuffisance respiratoire et hypotension. L’image a été inversée rapidement après avoir arrêté la perfusion et avec l’aide de corticostéroïdes, de thérapie à l’oxygène et de fluideothérapie; Cette réaction a été notifiée au centre de pharmacovigilance régional. Dans les autres cas les plus moins, les réactions consistaient en érythème cutané, rouleau du visage, douleur lombaire, tachycardie et dans certains cas frissons, hypotension et vertiges. Dans aucun d’entre eux, il n’y avait pas de dyspnée ou de bronchospasme.
Deux des patients présentés une réaction d’hypersensibilité DocETaxEL reconnaissait ne pas avoir correctement pris la dexaméthasone prévue la journée avant la chimiothérapie (patients 1 et 2, tableau 3). Il ne fait aucun doute que pour réduire le risque d’occurrence de ces événements est de soulever des patients contre une prise de prémédication adéquate de prémédication payée. L’administration d’une prémédication basée sur des antihistaminiques et des corticostéroïdes avant la taxane est de choix car il a été démontré qu’il a été démontré de réduire l’incidence et la gravité de la rétention de liquide, ainsi que la gravité des réactions d’hypersensibilité1,2,7. En outre, il évite les interruptions du traitement et permet d’augmenter les doses cumulatives des taxanes8.
On ignore si ces réactions dépendent du solvant, du taxan ou des deux composants. Le mécanisme pour lequel ils n’apparaissent pas non plus. On pense qu’ils peuvent être médiés par l’activation du complément, la libération non spécifique de l’histamine, la production d’oxyde nitrique ou par la libération des cytokines. Contrairement à ce qui se passe avec les dérivés de platinum, en principe ne relie pas son apparence avec un mécanisme médié par l’IGE, car les réactions apparaissent généralement dans quelques minutes de démarrage de la perfusion lors du premier ou deuxième cycle de traitement, ce qu’il suggère qu’il n’y a pas besoin de pour la pré-sensibilisation23-25.Un autre aspect à prendre en compte et qu’avec la bibliographie consultée, il n’a pas été élucidé avec l’accuracy8,26, il est de déterminer s’il existe des aspects cliniques ou subjectifs susceptibles de prédisposer le patient à une réaction de l’hypersensibilité aiguë ou à toute autre RAM.
Dans notre étude, les facteurs qui étaient étroitement liés à l’apparition de réactions infusionnelles étaient les suivants: la néoplasie pulmonaire, le programme de docétaxelcisplatin, reçoivent le médicament sur la première ligne et l’inconscience de la maladie. De ces facteurs, dans la littérature consultée uniquement pour recevoir le docétaxel dans la première ou la deuxième ligne, a été considérée comme une variable décisive dans l’apparition de ces réactions.
d’autre part, il est possible que le concomitant L’utilisation de paclitaxel ou de docétaxel avec d’autres antinéoplastiques telles que le trastuzumab, la carboplatine ou la cisplatine, peut améliorer l’apparence des réactions d’hypersensibilité, car elles peuvent également les provenir. Trastuzumab, comme les taxanes, provoquent généralement ces réactions au premier ou au deuxième cycle, mais elles ne sont pas présentées dans quelques secondes de démarrage de la perfusion27. En revanche, les réactions des dérivés du platine se produisent principalement du sixième cycle, au cours de leur infusion25,28. Dans notre étude, toutes les réactions sont apparues chez des patients en traitement polyquimiotique avec ces médicaments: 6 en combinaison avec la cisplatine, 2 avec de la carboplatine et 1 avec du trastuzumab. Cependant, seule la relation peut être trouvée chez celles qui se sont produites au cours du deuxième cycle, dans laquelle la combinaison de médicaments a déjà été reçue (dans 6 des 9 réactions dans notre étude). Ainsi, lors de l’utilisation combinée, il serait souhaitable d’utiliser une prémédication complète, de surveiller de près les patients et de savoir comment différencier les réactions d’hypersensibilité produites par chaque médicament, afin de déterminer l’agent de causalité.
référence à des biais ou à des limitations possibles de L’étude, probablement l’incidence des réactions aurait pu être plus importante car son évaluation constitue une variable subjective ou molle qui dépend de la perception de l’observateur. Par conséquent, cette circonstance peut avoir provoqué une minorité de réactions légères car elles auraient pu passer inaperçus. Un autre biais à souligner était l’utilisation de deux marques de doctorataxel différentes dans différentes phases de l’étude (Taxotere® et Docetaxel Hospira®), ainsi qu’un changement de formulation dans le cas de Taxotere®. Cette même préparation commerciale était celle qui a présenté toutes les réactions infusionnelles (deux d’entre elles avec la formulation antique), bien qu’il soit vrai que c’était le plus utilisé (91,5% des infusions). Les excipients des deux marques sont les suivants: éthanol, polysorbate 80 et acide citrique, et dans le cas de Taxotere® en outre macrogol 300. La composition quantitative des excipients n’a pas pu être obtenue à partir des feuilles techniques. Nous ne savons donc pas si la marque de commerce ou ses excipients pourraient influencer l’apparence des réactions. La limitation importante de l’étude, qui doit être prise en compte pour des travaux ultérieurs, était les tests de non-provocation chargés du service des allergies pour pouvoir discerner si les apparences apparaissaient étaient causées par le principe actif ou les excipients.
Enfin, avec les résultats obtenus dans cette étude, les mesures prises dans notre centre ont été de renforcer la prémédiation de la docétaxe et de faire une lenteur de drogue (2-3 heures) dans le premier et deuxième cycle de traitement. Avec Paclitaxel, il a été décidé de poursuivre la même méthodologie de travail, comme indiqué sur la feuille technique.
Conclusions
La docétaxel est le taxan qui a été lié à un plus grand nombre dans notre environnement. de réactions indésirables pendant votre perfusion, supérieure aux données décrites dans la littérature.
Une prémédication appropriée dans la maison et la maison du patient, est cruciale pour réduire l’incidence de ceux-ci.
Il est essentiel de faire plus d’études pour pouvoir connaître exactement l’étiologie de ces réactions et donc pouvoir appliquer des mesures efficaces qui évitent leur apparence.
conflit d’intérêts
Les auteurs déclarer aucun conflit d’intérêts.
bibliographie
1. Fiche technique DOCETAXEL (TAXOTERE®) (accès juin 2010). Disponible à l’adresse suivante: www.agemed.es
2. Fiche technique Paclitaxel (Taxol®) (accès juin 2010). Disponible à l’adresse suivante: www.agemed.es
3. Bagnall A-M, Forbes C, Lewis R, Golder S, Kleijnen J. Une mise à jour d’un examen rapide et systématique de l’efficacité et de la rentabilité des taxes utilisés dans le traitement du cancer du sein avancé. Institut national d’excellence clinique (Centre NHS pour critiques et diffusion). Université York, avril 2001 (accès juin 2010). Disponible à: www.nice.org.UK / NICEMEDIA / LIVE / 11435/32235 / 32235.PDF
4. Gligorov J, lotz J-p. Pharmacologie préclinique des taxes: implications des différences. L’oncologue. 2004; 9 (Supl 2): 3-8.
5. Hennenfent k l, govindan R. Nouveaux formulations de taxanes: un examen. Vieux vin dans une nouvelle bouteille? Annales d’oncologie. 2006; 17: 735-49.
6. Dix Tije AJ, Verweij J, Loos WJ, Sparréboom A. Effets pharmacologiques des véhicules de formulation: implications pour la chimiothérapie du cancer. Clin Pharmacokinet. 2003; 42 (7): 665-85.
7. Markman M. Gestion des toxicités de taxane. Soutenir le cancer du soin. 2003; 11 (3): 144-47.
8. À jour. Base de datos. Réactions de perfusion à la chimiothérapie systémique; Octube 2009 (acceso Marzo 2010). DISPONIBLE EN: http://www.uptodate.com/contents/infusion-reactions-to-systemicchemotherapy
9. Michaud lb. Méthodes de prévention des réactions secondaires à Cremophor el. Ann Pharmacother 1997; 31: 1402-4.
10. Weiss RB, Donehower RC, Wiernik PH, et al. Réactions d’hypersensibilité du taxol. J Clin Clin Oncol. 1990; 8: 1263-8.
11. Critères de toxicité commune de l’Institut national du cancer des événements indésirables (CTCAE) v3.0; Agosto 2006. (Accesto Marzo 2010). Disponible fr: http://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcaev3.pdf
12. Naranjo Ca, Busto U, Vendeurs Em, Sandor P, Ruiz I, Roberts Ea, et al. Procédé d’estimation de la probabilité de réactions indésirables aux médicaments. Clin pharmacol ther. 1981; 30: 239-45.
13. Série de soins de santé Micomedex. Base de données des médicaments. Série Thomson (Accesto Marzo 2010). Disponible en: www.thomsonhc.com
14. Dizon DS, Schwartz J, Rojan A, Miller J, Pires L, Disilvestro P, et al. Sensibilité croisée entre PaclitaxEL et DOCETAXEL dans un programme de cancers pour femmes. Gynecol Oncol. 2006; 100 (1): 149-51.
15. Markman M, Kennedy A, Webster K, et al. Réactions hypersensibilité associées au paclitaxel: Expérience du programme d’oncologie gynécologique du Centre de cancer de la clinique de Cleveland. J Clin Clin Oncol. 2000; 18 (1): 102-5.
16. Castells MC, NM Tennant, Sloane de, Ida Hsu F, Barrett Na, Hong di, et al. Réactions d’hypersensibilité à la chimiothérapie: résultats et sécurité de désensibilisation rapide dans 413 cas. J Allergy Clin Immunol. 2008; 122: 574-80.
17. Feldweg am, Lee CW, matulonis UA, Castells M. Desensibilisation rapide des réactions d’hypersensibilité à Paclitaxel et de DocetAxEL: Un nouveau protocole standard utilisé dans 77 traitements réussi. Gynecol Oncol. 2005; 96: 824-49.
18. Syrigou e, Dannos I, Kotteas E, Makrilia N, Tourkantonis I, Dilana K, et al. Réactions d’hypersensibilité à la docétaxe: évaluation rétrospective et développement d’un protocole de désensibilisation. INT Arch Allergy Immunol. 2011; 156 (3): 320-4.
19. J Lokich J, Anderson N. PaclitaxEL Réactions d’hypersensibilité: un rôle de substitution de docétaxel. Le centre de cancérologie de Boston. Annales d’oncologie. 1998; 9: 573-4.
20. Moon C, Verschraegen Cf, Bevers M, Freedman R, Kudelka AP, Kavanagh JJ. Utilisation de DOCETAXEL (TAXOTERE) chez les patients atteints d’hypersensibilité Paclitaxel (Taxol). Médicaments anticancéreux. 2000; 11 (7): 565-8.
21. Bernstein BJ. DOCETAXEL comme alternative au paclitaxel après des réactions d’hypersensibilité aiguës. Ann Pharmacother. 2000; 34 (11): 1332-25.
22. Baker J, et al. Effets secondaires liés au docétaxel et leur gestion. Journal européen des infirmières en oncologie. 2009; 13: 49-59.
23. Lee C, Gianos M, KlaRustermeyer WB. Diagnostic et gestion des réactions d’hypersensibilité liées aux agents de chimiothérapie cancéreuse courants. Ann Allergy Asthma Immunol. 2009; 102 (3): 179-87.
24. Ardavanis A, Tryfonopoulos D, Yiotis I, Gerasimidis G, Baziotis N, Rigatos G. Nature non allergique des réactions d’hyper-sensibilité aiguë de Docetaxel. Médicaments anticancéreux. 2004; 15 (6): 581-5.
25. Sánchez-Muñoz A, Mediola Fernández C, Poza Gardedes P, Canto Diez G, Bézares Montes S, Cortés Funes H. Hipeviolidad A Carboplatino Y Paclitaxel: Revisión Y Recomendaciones Clínicas. Rev Oncol. 2002; 4 (2): 68-71.
26. Cortijo-Cascajares S, Jiménez-Cerezo MJ, Herreros de Tejada A. Revisión de las Reacciones de Hipeverssibilidad A Antineoplásicos. Ferme hosp. 2012; 36: 148-58.
27. Chung ch. Gestion des prémédies et le risque de réaction à la thérapie anti-anticorps monoclonale infontrye. Oncologiste. 2008; 13: 725-32.
28. Markman M, Kennedy A, Webster K, et al. Caractéristiques cliniques des réactions d’hypersensibilité à la carboplatine. J Clin Clin Oncol. 1999; 17 (4): 1141-5.