Sommaire: Trois éléments de la chaîne inflammatoire spécifique des patients ont été évalués à l’hémodialyse: LBP; IL-6 et PCR, tels que les marqueurs d’inflammation et de prévision. IL-6 est un risque indépendant de risque de mort chez les patients HD, plus puissant que PCR. Ce meilleur profil comme un marqueur de risque de décès devrait être en partie, à sa plus faible variabilité et en partie, d’ajouter à l’évaluation du risque de décès cardiovasculaire, de PCR propre, de l’évaluation du risque de décès par des infections, associées à la malnutrition. Dans la clinique, la PCR devrait continuer à être utilisée comme marqueur d’inflammation, car il est plus facile de mesurer, mais dans des travaux de recherche, les niveaux IL-6 devraient être utilisés. Le LBP peut servir à détecter l’exposition des patients aux endotoxines. Il est toujours de voir s’il s’agit d’un marqueur de risque de mort.
Introduction
Patients présentant une défaillance rénale chronique présente des modifications dans la réponse immunitaire, Spécifique et non spécifique 1. L’hémodialyse peut être considérée comme immunodéfique 1. L’hémodialyse ne résout pas la plupart de ces troubles et même ajoute de nouvelles, en augmentant l’exposition du patient à des matériaux bioinchalatibles, des endotoxines et des substances telles que l’acétate de dialyse liquide. Cette situation est accompagnée d’une prédominance de cytokines proinflammatoires sur les médicaments anti-inflammatoires 1,2, de sorte que certains de ces patients maintiennent une réaction de phase aiguë « chronique ». Les réactifs de phase aiguë positifs, tels que la protéine C réactive C et le fibrinogène, sont souvent augmentés dans le sérum et les négatifs, tels que l’albumine et la préallbumine, diminués. Ces réactifs de phase aiguë sont capables de prédire le risque de décès chez ces patients, même après avoir ajusté la mortalité à d’autres facteurs, tels que l’âge, le sexe, le diabète, etc. 3-7
La mortalité des patients dialysés est plusieurs fois supérieure à celle du reste de la population, corrigée pour l’âge et le sexe. Chez ces patients, les causes de la mort cardiovasculaire sont les plus fréquentes. Cette prédominance de la mort de la cause cardiovasculaire est beaucoup plus prononcée dans le nord de l’Europe et des États-Unis d’Amérique que dans le sud de l’Europe. Dans le registre espagnol du traitement rénal de 2002 de 2002, visible à l’adresse www.senefro.org, le taux de mortalité dû aux causes infectieuses représente une quantité similaire à cardiovasculaire. La mortalité infectieuse est liée au déficit immunologique et au statut nutritionnel de ces patients. Un bon facteur prédictif du risque de décès dans l’hémodialyse devrait donc évaluer non seulement le risque cardiovasculaire, mais également la nutrition et la quantité et la qualité de la dialyse. Ces facteurs de risque cardiovasculaires et infections sont imbriqués dans le syndrome décrit chez les patients de l’hémodialyse 8. La prévention de celle-ci doit être l’objectif principal de réduire la mortalité élevée des patients de l’hémodialyse.
Le substrat de la mort cardiovasculaire est L’artériosclérose, qui chez ces patients est notée 9.10. L’urémie, en soi, est capable d’accroître les plaques d’athéroma 10. Dans l’évolution des plaques d’athéromes, le stress oxydatif, l’angiotensine II et les cytokines proinflammatoires telles que l’influence de l’IL-6. Les radicaux d’oxygène activent et entravent l’inhibition du facteur nucléaire inflammatoire nucléaire NF-K-B. Tous ces mécanismes athérogènes sont modifiés chez les patients atteints de dialyse. D’autre part, les plaques d’athérome de patients urémiques présentent des particularités car c’est le fait qu’ils sont les plus fréquemment calcifiés. La plus forte tendance aux calcifications d’extraosus des patients dialysés est liée à ce processus, en étant une hyperphosphatémie l’un de ses principaux facteurs de conditionnement 3,10-15.
Les patients dialysés ont des facteurs de risque de souffrir d’événements cardiovasculaires courants au général. Population: hypertension artérielle; Dyslipémie; fumeur; Obésité, sédentaire. Tous doivent être prévenus et traités, en tenant compte des particularités de ces patients. En outre, les patients dialysés urémiques présentent des facteurs de risque spécifiques, des personnes à charge d’urémie et d’autres de la technique de dialyse. Nous avons mentionné les déséquilibres existants entre les agents oxydants et antioxydants, les cytokines proinflammatoires et les cytokines anti-inflammatoires, l’angiotensine II, l’exposition à des substances toxiques, telles que les chloramines ou l’exposition, de fortes concentrations, des substances telles que l’acétique dans l’hémodialyse et le glucose dans la dialogyse péritonéale . La plus grande exposition aux substances pyrogènes, capable de stimuler les cellules de présentateur antigène, parmi lesquelles des endotoxines se démarquent, méritent un commentaire séparé.Ces substances peuvent non seulement provenir du fluide de dialyse 16,17, mais également d’infections cliniques et sous-cliniques ou de passer de l’intestin par une barrière intestinale altérée. Sa capacité à stimuler les monocytes et provoquer une inflammation est énorme, surtout, lorsqu’il existe d’autres stimuli ou adjuvants. La rétention de substances urénières difficiles à éliminer par la dialyse conventionnelle telle que la DMA asymétrique (diméthyl-l-arginine) ou le facteur D du complément, est un autre facteur à prendre en compte 18.19. Tous ces facteurs spécifiques doivent être traités ou éliminés. Il n’y a pas une solution unique car ce n’est pas la récupération de la fonction d’intégrum annonce rénale.
Parmi les déclencheurs d’inflammation spécifiques chez les patients hémodialysis met en évidence la membrane du dialyseur et sa capacité à stimuler directement ou à l’activation du complément aux monocytes, augmenté la production de cytokines. Le comportement des membranes d’hémodialyse dans cet aspect est très variable. Certains sont clairement plus biocompatibles que d’autres. D’autre part, la présence de substances pyrogènes et d’acétate dans la LD sont deux autres stimuli des monocytes 20-22. La présence concomitante des trois est le plus grand stimulus pour l’inflammation spécifique de l’hémodialyse.
Liquide de dialyse comme inducteur d’inflammation:
dialyse liquide (LD) C’est l’un des les éléments fondamentaux du traitement à l’hémodialyse. Des problèmes tels que l’amylose dialytique qui a été cru fondamentalement lié à la membrane de dialyseur, dépend également de la pureté du même 23,24. Ainsi, les unités hémodialysis (HD) qui ont amélioré le problème de la contamination bactérienne de LD et de son niveau d’endotoxines (ET) parviennent à réduire radicalement l’incidence du syndrome du tunnel carpien 23,24. La malnutrition et l’artériosclérose sont d’autres aspects liés à la pureté de LD 3.25. Le syndrome « MIA », la malnutrition, l’inflammation et l’artériosclérose, seraient médiés par des cytokines (CQ) et des molécules d’adhésion et auraient dans l’endotoxémie une de ses principaux déclencheurs.
Le dialyse liquide (LD) est aussi important que le dializer ou le moniteur HD. De plus, ces trois éléments interagissent les uns avec les autres. Par exemple, il est inutile d’utiliser un dialyseur avec une membrane très biocompatible et une haute perméabilité si nous avons une LD contaminée, avec un grand nombre de pyrogènes. Le dialyseur et la machine sont garantis par des maisons commerciales responsables de leur qualité et de se conformer aux règles à cet égard. Au contraire, LD est fabriqué dans l’unité de dialyse, à l’époque, sans possibilité de contrôles de qualité avant leur utilisation et sans aucun doute sous la responsabilité du médecin traitant. Pour tout ce qui précède, je pense que la qualité de la LD est actuellement l’une des sujets les plus importants et les plus difficiles pour le personnel de santé d’une unité de dialyse.
endotoxines dans le liquide de dialyse (substances inductives de la production de cytokines par monocytes)
Le patient urémique en traitement par hémodialyse est soumis à un état inflammatoire chronique 4 -6 Cette situation est liée à certains des facteurs qui conditionnent leur forte mortalité et leur mauvaise qualité de vie, et parmi lesquels figurent une artériosclérose accélérée, une malnutrition, une anémie, un stress oxydatif et une amylose dialutique 2-6, 23-30. En fait, à l’heure actuelle, l’artériosclérose, la malnutrition et l’inflammation doivent être conçues comme trois expressions du même processus.
Le processus inflammatoire est médié par des cytokines produites par le stimulus de la cellule monocytaire 4-6. Chez les patients en HD, cette stimulation est multifactorielle, des endotoxines et d’autres substances bactériennes 31. L’origine de cette endotoxynémie est multiple. D’une part, des infections répétées interviennent, certaines chroniques, soumises à ces patients, telles que celles dépendantes de l’accès vasculaire ou de la piste urinaire. D’autre part, depuis il y a quelques années, le rôle des endotoxines qui vont au sang du liquide de dialyse surviennent et qui sont produits par la contamination bactérienne de ses composants.
Nous sommes continuellement exposés à ETS et que nous sommes nés, chaque processus infectieux que nous subissons est une nouvelle exposition. En fait, si dans les IgG de la population normale et les anticorps anti-antis anti-IgM, on observe comment leurs niveaux augmentent de la naissance pour stabiliser environ 16 ans. Se concentrer sur les patients de l’hémodialyse, il a été démontré que les ETS peuvent aller dans le sang à travers le dialyseur.Cette étape dépend non seulement de la quantité d’ET mais aussi de sa qualité et, bien que le transport soit principalement effectué par le rétroofiltre 20, ceux du petit poids moléculaire peuvent également aller par la pulsion. Les ETS peuvent parcourir tout type de membrane d’hémodialyse, bien qu’il ait été montré qu’avec des membranes à haute perméabilité, la rétrocilration est plus courante et les réactions pyrogènes sont plus fréquentes qu’avec les bas. Il y a des membranes de dialyse avec une capacité adsorber et une capacité de polysulfone et de polyamide, qui peut diminuer son passage 17.
une fois dans le sang, ETS est capable d’activer les monocytes et d’induire une formation de CQ. Cette activation monocytaire n’est pas linéaire et différents facteurs pouvant augmenter ou diminuer la production de CQ. Il s’agit d’un processus multifactoriel, dans lequel la quantité et le type de toxine influencent le type de membrane, des facteurs de plasma différents et l’action concomitante d’autres systèmes d’activation et d’inactivation des monocytes 21. Il est connu que la présence de protéines ou du sang total c’est un facteur amélioré de ce processus d’activation et actuellement, au moins deux protéines, un convoyeur (PBP, une protéine de liaison lipolisacaridos) et une autre capacité de perméabilité (BPI), sont nécessaires pour que ce processus soit effectué 32. La présence concomitante d’autres stimulus ou des signaux sont très importants, tels que l’activation du complément et enfin, pour compliquer davantage ce phénomène, certains CQ entreront en jeu, tels que IL-10 33. Ce qui précède justifie l’importance que le statut de nutrition et le système immunitaire avoir dans ce champ.
En plus des endotoxines, il existe d’autres agents capables de stimuler les monocytes. Ce sont ces éléments bioinchasibles du système de dialyse et entre ceux qui soulignent la membrane de dialyseur. Le contact du sang avec cela produit une série de réactions qui affectent la plupart des cellules sanguines et des protéines. Dans ce processus, l’effet de l’activation du complément induit de différentes membranes de dialyse est très important. D’autre part, nous ne devons pas oublier que certaines membranes sont capables d’adsorbeurs endotoxines et de médiateurs diminuant l’effet bioincompatible.
Le monocyte, en tant que cellule effectrice, intègre les différents stimuli et produit une libération chronique de cytokines. La connaissance des récepteurs membranaires de ces cellules est venue de confirmer la manière dont les endotoxines sont leur stimulus principal, CD14 20 récepteurs, mais il y aurait la nécessité d’autres stimuli concomitants, tels que le complément CD16, de sorte que CQ ait été sécrété 34.
CQ et fondamentalement IL-6 sont capables de déclencher une réaction de phase aiguë, dont l’expression principale est la variation de la synthèse des protéines à travers le foie. Certaines des protéines, telles que l’albumine et la préalbumine, commencent à synthétiser en une quantité inférieure et d’autres, d’autre part, d’augmenter sa production, comme avec la protéine C-réactive (PCR) et la substance sérique amyloïde A (SAA) . Il semble que PCR ne serait pas seulement un marqueur de phase aiguë, mais aurait un rôle de médiateur d’inflammation et de blessure vasculaire. Les niveaux de PCR chez de nombreux patients hémodialysis sont accrus de manière chronique et concernent certains facteurs du patient, tels que la mortalité, l’artériosclérose, le statut nutritionnel et certains comorbidités impliquant une inflammation-infection. Les niveaux de PCR avec des caractéristiques de la technique d’hémodialyse, tels que: la rétrollylration, les endotoxines de la LD et son retrait par filtres 6,20.
Pour éviter cette situation inflammatoire, nous devons agir à différents niveaux: prévenir et traiter les contaminations bactériennes de DD; Retirez les LDTS par des filtres appropriés dans le circuit hydraulique des machines HD; Éviter ou traiter les infections chroniques de patients en HD; Utilisez des matériaux biocompatibles pour éviter des stimuli concomitants de monocytes et éliminer l’acétate, même à des niveaux faibles, de LD. Le maintien d’un bon statut nutritionnel chez nos patients en HD peut influer sur une meilleure réponse immunitaire. L’action sur le LBP ou l’IBP ou sur les destinataires des monocytes ou du CQ, est toujours en phases d’études très préliminaires.
une série de travaux effectués dans les unités de dialyse de la zone 1 de Madrid Certaines d’entre elles en collaboration avec des unités de dialyse italienne coordonnées par le Dr Panichi 20. Il existe trois éléments fondamentaux de la cascade pro-inflammatoire spécifique des patients à l’hémodialyse: protéine C-réactive (PCR); IL-6 et protéines de liaison lipopolysaccharidiques (LBP).L’objectif de ces études était de relier ces trois médiateurs ayant des facteurs cliniques et biochimiques et même avec la mortalité de ces patients
la protéine C réactive en tant que marqueur de mortalité en HD.
Cette étude vise à relier la PCR avec d’autres facteurs HD et à son tour, avec le pronostic des patients.
chez 84 patients HD non sélectionnés, de notre unité d’hôpital, une mesure basale a été effectuée, à trois mois. et annuellement de PCR et IL6, ils ont été suivis pendant quatre ans. La PCR a été déterminée par un gros test immunoréactif, 0,001 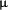 MG /
MG / 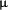 ml, (technique de néfélométrie laser, diagnostics), avec normale Valeurs comprises entre 0,1 et 4 mg / l.
ml, (technique de néfélométrie laser, diagnostics), avec normale Valeurs comprises entre 0,1 et 4 mg / l.
La PCR a été soulevée par rapport aux commandes supérieures à 5 mg / l, dans 47 des 84 patients et supérieure à 20 mg / l de 17 de 17 ans, (N = 84, 15,2 ± 18,9 mg / l). Il y avait une bonne corrélation de la PCR avec IL6, N = 84, R = 0,65, pigrablement, corrélée à d’autres réactifs de phase aiguë: Prealbumin, R = -0,47; VGS, R = 0,32 et albumine R = -0,27. Sur 15 patients, son altitude pourrait être due à la souffrance des maladies intercanadantes qui conditionnent une inflammation. Chez 25 patients, il y avait une pathologie vasculaire et leur PCR était également supérieure à celle des patients sans maladies intercountrices, les différences peu fréquentes de PCR en fonction de la membrane de dialyse et de la dialyse utilisées, mais ils n’ont pas atteint une signification statistique.
La différence moyenne entre les deux déterminations de la PCR était de 5 mg / L, beaucoup plus faible chez les patients présentant des valeurs normales, 1,2 mg / l.
PCR ne s’est pas comporté comme une variable de distribution normale. Il n’était pas non plus comporté selon d’autres normes de distribution. Ce n’est que lorsque sa transformation logarithmique a été effectuée avait une distribution gaussienne. La corrélation entre deux valeurs consécutives chez chaque patient était R = 0,95, la corrélation PESTA a été maintenue pendant deux ans qui perdent plus tard.
des 84 patients 38 sont morts au cours des 4 années de suivi. La survie des patients présentant des niveaux initiaux élevés de PCR était de: 79%, 60%, 44% et 35% par an, 2e, 3ème et 4e années. Chez les patients qui avaient des niveaux normaux, il était: 95%, 87%, 76% et 64%. (Rang de journal p = 0,0032). La différence des deux courbes de survie a été établie au cours des deux premières années, 29% pour rester dans cette fourchette jusqu’à 4 ans. L’étude longitudinale permettant d’évaluer l’effet de la variation temporaire de la PCR sur la survie démontrée, dans la cohorte étudiée, la diminution progressive de sa valeur prédictive. L’analyse de Cox a donné des cofacteurs prédictifs de la mort, de la PCR, de P = 0,0001, de l’âge p = 0,0011 et de la créatinine p = 0,026.
Dans cette étude, il a été conclu que la PCR est un facteur prédictif indépendant de la mort. Il maintient sa valeur prédictive au cours des deux premières années suivant sa détermination. Chez de nombreux patients, la réaction de phase aiguë est intermittente et non continue.
IL-6 en tant que marqueur de mortalité en HD.
IL-6 stimule la synthèse de la PCR dans le foie. Chez les patients hémodialysis, il a été démontré que la PCR et l’IL-6 ont une valeur prédictive puissante de la mort 35,36. Ce qu’on ne sait pas, c’est si la valeur prédictive de l’IL-6 reflète simplement ce que PCR, étant plus facile à mesurer. L’objectif de cette étude était de savoir si IL-6 fournit des informations pronostiques plus ou différentes que la PCR fournie.
Une cohorte de 218 patients à hémodialyse a été suivie au cours d’une médiane de 3,5 ans. Son âge moyen était de 59,5 ans, 63% d’hommes et de 18% de diabétiques. Pendant le suivi, 75 sont morts, 41 de causes cardiovasculaires. IL-6 (EIA, Système RD Boringher), PCR (méthode modifiée de néphélométrie élevée de sensibilité, de diagnostic Berhing, GmbH, Rarburg), albumine sérique, hématocrite, lipides sériques et IPTH a été déterminée. Une analyse de régression de la COX a été utilisée pour examiner la relation entre l’IL-6 et la PCR et la mortalité.
résultats: le quartile mineur (13,5 pg / ml pour IL-6 et > 14,0 mg / L pour PCR) était de 4,52 (intervalle de confiance de 95%: 2.26-9.05) Pour IL6 et 2.41 (1.33-4.37) pour PCR. Lorsque les deux variables ont été incluses dans le même modèle, l’estimation était de 4,01 (1,69-9.50) pour IL-6 et 1,08 (0.51-2.59) pour PCR. En tant que variables continues, la relation entre les deux et la mortalité devient linéaire après la transformation logarithmique des variables. Pour une unité de la déviation typique du journal (variable), le RR était de 2,07 (1,50-2,85) pour IL-6 et 1,65 (1,20-2,56) pour PCR.
Lorsqu’il est inclus dans le même modèle, l’estimation était de 1,90 (1.28-2.81) pour IL-6 et 1,15 (0,80-1,66) pour PCR Ces résultats n’ont pas changé de substance lorsque la seule mortalité cardiovasculaire a été examinée. Le phénomène était encore plus prononcé après avoir ajusté pour tous les facteurs de confusion potentiels.
Conclusions: IL-6 a une valeur prédictive supérieure à celle de la PCR pour toutes les causes de mortalité et de cardiovasculaire. Il semble fournir des informations pré-fournissant des informations indépendantes et plus pratiques que la PCR. Plus d’études sont nécessaires pour déterminer si les résultats dépendent de la plus petite erreur de mesure de l’IL-6, ou de sa variabilité plus faible ou s’il reflète un vrai phénomène biologique.
une hypothèse pour expliquer ces résultats, ce serait : L’IL-6 a des effets sur la nutrition et l’immunité, deux conditionnements importants de l’évolution des infections, ceux-ci étant en Espagne une cause de mortalité aussi importante que cardiovasculaire.
La protéine de liaison de lipopolysaccharide (LBP) en tant que marqueur d’inflammation en HD.
Le LBP est une protéine de 60 kD synthétisée dans l’hépatocyte. Ses niveaux plasmatiques augmentent dans les situations d’exposition aux endotoxines (ET). Il rejoint les ETS et les transfère à leur récepteur monocytaire, CD14, améliorant sa réponse. En raison de son apparition précoce dans la chaîne inflammatoire, il pourrait s’agir d’un marqueur utile dans le diagnostic et le pronostic du patient avec des complications liées à l’exposition aux bactéries et aux endotoxines. Dans ce travail, le LBP a été étudié chez les patients en HD et dans leurs relations avec d’autres facteurs considérés comme impliqués dans le syndrome de réponse inflammatoire systémique.
Patients et méthodes: LBP (immunoassay spécifique, a été déterminé. Immulite®) , dans 220 non sélectionnés des patients en HD. Simultanément IL-6, PCR, albumine, préalbumine, fibrinogène, hémoglobine (HB), ist et dose d’EPO ont été mesurées. Les caractéristiques cliniques des patients et de l’hémodialyse ont été collectées. L’âge moyen était de 62,2,2 ± 14,9 ans. 121 étaient des hommes et 99 femmes. Le temps moyen en HD était de 70 ± 67 mois.
Résultats: Le niveau moyen de LBP était de 14,9 ± 8,8 ug / ml, les valeurs normales étant avec le processus inflammatoire chronique ou aigu ( n = 69, p = 0,000), épisodes d’avva (n = 33, p = 0,034), vasculopathie périphérique (n = 60, p = 0,04), maladie cardiaque non ischémique chronique (N = 111, p = 0,001) avait Niveaux de LBP supérieurs à ceux qui ne le font pas. Il n’y avait aucune différence dans les niveaux plasmatiques de LBP selon le sexe, l’existence (n = 42) ou non de fistules anciennes, que le FAV était autologue (102) ou une greffe, qui avait (n = 67) ou non un chronique hépatopathie ou qu’il s’agissait d’un transporteur (n = 18) ou non d’un néoplasme actif
et il n’y avait pas de différences selon la machine (n = 66) ou non filtre d’ET. Le LBP est corrélé de manière significative avec PCR (p = 0,000), fibrinogène (p = 0,000), ferritine (p = 0,033), IL-6 (p = 0,002) et if (p = 0,001) directement et inversement avec albumine (p = 0.000), Prealbumin (p = 0,000), hématocrite (p = 0,019) et hémoglobine (p = 0,041). Le coefficient de corrélation de PCR avec IL-6 (p = 0,07) était inférieur à celui de la LBP. Dans l’analyse factoriale par étapes, la LBP a été incluse dans les composants de la RFA, mais également chez l’anémie et la nutrition.
Conclusion: le LBP est lié à la RFA, avec une plus grande importance que IL-6. Il est également lié aux paramètres cliniques impliqués dans les SRIS et est donc un marqueur d’inflammation chez les patients en HD. Il est nécessaire de continuer à suivre ces patients pendant plusieurs années pour déterminer s’il s’agit d’un bon marqueur de risque de décès dans l’hémodialyse.
Evolution des niveaux LBP en fonction de l’utilisation d’un filtre pour les endotoxines dans le circuit hydraulique des machines HD.
Dans ce travail, le changement aux niveaux de la LBP des patients dans hémodialyse après avoir placé et filtres dans des moniteurs.
Patients et méthodes: Coîtant avec et placement de filtre chez 56 patients surveille en HD, polyéthersulfone (PS) dans 17 et polysulfone (PS) en 34, Basal LBP a été déterminé (avant de mettre le filtre) et à 3 mois de leur placement (immunoassay spécifique, immulite®). Le groupe témoin, 34 patients ont été formés, restés sans filtre. Simultanément, IL-6, PCR, albumine, préalbumine, fibrinogène, hémoglobine, ferritine et doses d’EPO ont été mesurées. Les caractéristiques cliniques des patients et de l’hémodialyse ont été collectées. Le Moyen Âge était de 64 ± 13 ans, 44 étaient des hommes et 46 femmes et le temps en HD de 69 ± 61 mois.
Résultats: Pendant le suivi des patients de l’étude, le ET NIVEAU ET DANS LE PRE-ULTRAFILTER DD augmenté de niveaux inférieur à 0,5 UE / ml à la hausse du temps, à des niveaux compris entre 0,5 et ML à 3 mois de placement ultrafilter.
Le LBP entre les deux déterminations augmenté de manière significative chez les patients sans filtre et (n = 34, p = 0,03) et est resté inchangé dans lequel il a été placé.Il n’y avait aucune différence dans les niveaux de base de la LBP entre le groupe qui a débuté avec le filtre PSE et PS, mais le LBP à trois mois était plus important dans ceux qui avaient filtre PS (P = 0,018). Chez les patients atteints de filtres PS, LBP diminue à trois mois de leur placement (n = 39, p = 0,025), cette diminution étant à la charge du sous-groupe avec des dialyseurs à faible perméabilité (n = 28, p = 0,049). Lorsque l’augmentation de LBP est analysée dans le groupe témoin (sans filtre) en fonction de la perméabilité de la membrane, il est objectif qu’il ne s’agit que de manière significative dans le sous-groupe de patients présentant des dialisateurs de coefficients UF supérieurs à 15 ml / heure / heure / mmHg ( n = 28; p = 0,049).
sur les 56 patients dans lesquels ultrafilter, IL-6 diminue de manière significative, p = 0,001, tandis que dans le groupe de contrôle, il n’est pas modifié.
Conclusion: le LBP augmente lorsque l’exposition à et existe et constitue donc un marqueur utile pour la surveillance du degré d’exposition aux contaminants bactériens et autres de la LD. Et les filtres sont capables de contrecarrer partiellement cet effet.
Références:
1.- GIMDT M, SESTER M, SESTER U, KOHLER H. Aspects moléculaires de la fonction T-et B-Cell En urémie. Rein INT 2001, 78: S206-11.
2.- GOICOECHEA M, MARTIN J, DE DERQUE P, QUIREGA JA, ORTIZ A, CARREÑO V, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, CARAMEL C, Rôle de Cytokines dans la réponse à l’érythropiétine Patients hémodialysis. Rein de 1998 54: 1337-1343.
3.- Zimmermann J, Herrlinger S, PRUY A, METZGER T, WANNER C: Les égarés inondent le risque cardiovasculaire et la mortalité dans l’hémodialyse. Rein de 1999: 55: 648-658.
4.- Bárány P., JC Divine., Bergström J.: La protéine haute C-réactive est une forte prédiction de la résistance à l’érythropiétine chez les patients hémodialysés. Je suis kid dis 1997; 29: 565-568.
5.- HAVERKATE F, THOMPSON SG, PYPE SDM, Gallimore Jr, Pepys MB: Production de protéines C-réactives et RISD d’événements coronaires dans une angine stable et instable. Lancet 1997; 349: 462-466.
6.- Bergström J, Heimbürger O, Lindholm B, Qureshi AR: protéine C-réactive en tant que prédicteur de l’albumine sérique et de la mortalité en hémodialyse. Gen am Soc Neprol 1995; 6: 573-577.
7.- Yeun JY, Levine Ra, Mantadilok V, Kaysen GA. La protéine C-réactive prédit la mortalité touta causa et cardiovasculaire chez les patients hémodialysis. Suis J. Rein Dis 2000; 35: 469-476.
8.- Stenvinkel P, Heimburger O, Paultre F et al. Une association forte entre la malnutrition, l’inflammmpion et l’athéroscelieros en insuffisance rénale chronique. Rein int 1999; 55: 1899-1911.
9.- Lindner A, Charra B, Sherrard DJ, Scribner BH. Atheroscélérose accélérée dans une hémodigène de maintenance prolongée. N Engl J Med 1974; 290: 697-701
10. Kerstin Amann, Christina Ritz, Marcin Adamczak, Eberhard Ritz. Pourquoi la maladie coronaire cardiaque des porteurs d’urémie est-elle si fréquente et aussi dévastatrice? TRANSPLANT DIALLE NEPHROL (2003) 18: 631-640.
11.- OH J, Wunsch R, Turzy M et al. Artérentiopathie coronaire et carotide avancée chez les jeunes adultes avec une défaillance rénale chronique d’enfance. Circulation 2002; 106: 100-105
12.- De Francisco ALM, Pérez García R. Ultrapure Diarsate et siège à l’effet sur les résultats des patients. Saudi J Rein Dis Transplant 2001; 12 (3): 406-412.
13.- Block GA, Hulbert-Shear Te, Levin NW, Port FK. Association de phosphore sérique et de calciumxphosphate avec risque de mortalité chez les patients chroniques d’hémodialyse: une étude nationale. Am j rein Dis 1998; 31: 607-617
14.- Brow S, Bentzon JF, Falk E, Nielsen LB, Olgaard K. Échec rénal chronique Améliorer Attique Atherosceleros dans les souris déficientes apicoproténiques. Transplantation de cadran de Néphrol 2002; 17: 46A
15.- Shoji T, Emoto M, Tabata T et al. Athéroscyclérose avancée chez les patients prédivalisis atteints d’insuffisance rénale chronique. Rein int 2002; 61: 2187-2192.
16.- Pérez-García R, Rodríguez Benítez P. Pourquoi et comment surveiller la contamination bactérienne de la diassate? Néphrol cadran transplant 15: 760-764, 2000.
17.- Pérez-García R., Anaya F., J., Valderábano F. Association des diayseurs de haut flux et une contamination bactérienne de la diatribe induite Libération chronique de cytokines chez les patients atteints de hémodialyse. Nephrol Dial Transplant 11:. 2,164 à 2,166, 1,995
18.- Deppisch RM, Beck W, Goehl H, Ritz E. Composants Complement comme urémique toxines et leur rôle potentiel en tant que médiateurs de Microinflamm. Rein int Sured 2001; 78: S271-S277
19.- KielleStein JT, Boger RH, Bode-Buger SM et al. Augmentation marquée de la diméthylarginine asymétrique chez les patients présentant une maladie rénale chronique primaire naissante. J am Soc Nephrol 2002; 13: 170-176.
20.- Panichi V, Migliori M, de Pietro S, Mételli Mr, Tacola D, Pérez García R, Palla R, Rindi P, Cristofani R, Tetta C. Plasma C Protéine réactive dans les Patatifs hémodialysis: une enquête clinique longitudinale transversale et longitudinale. Sang purif 2000; 18: 30-36.
21.- G. Lonnemann: Qualité bactériologique de dialyse et la perméabilité des membranes de dialyseur aux pyrogènes.Rein int 1993; 43, Suppl. 41: 195-200.
22.- Amore A, Coppo R. Intolérance d’acétate et synthèse de l’oxyde nitrique par des cellules endothéliales. J SOC SOC NEPHROL 1997, 8: 1431-1436.
23.- Baz M, Durand C, Ragon A, Jaber K, Andrieu D, Merzouk T, Purgus R, Olmer M, Reynier JP, Berland Y: L’utilisation de l’eau ultrapure dans l’hémodialyse retarde le syndrome du tunnel carpien. Int J Artf Organs.1991: 14: 681-685.
24.- Schwalbe S, Holzhauer M, Schaeffer J, Galanski M, Koch Km, Floege J: Beta2 Microglobuline Amyloïdose: une complication de la disparition de hémodialyse à long terme? Rein int 1997; 52: 1077-1083.
25.- Kaizu Y, Kimura M, Yoneyama T, Miyaji K, Hibi I, Kumagai H: Interleukin-6 Mai Médier la malnutrition chez les patients chroniques d’hémodialyse.AM J RISTNE DIS 1998 ; 31: 93-100.
26.- Kleophas W, Hasstert B, Backus G, Hilgers P, Westhoff A, Van Endert G Expérience à long terme avec un fluide de dialyse individuelle ultrapure avec une machine de type bain Néphrol cadran TraSplant 1998; 13: 3118-3125.
27.- Gunnell J, Yeun JY, Depner Ta, Kaysen GA. La réponse de phase aiguë prédit la résistance à l’érythropoïétine chez l’hémodialyse et les patients dialysées péritonéales. AM J RISTRE DIS 1999; 33: 63-72.
28.- Sitter T, Bergner A, Schiffl H: Induction Cytokine liée à la dialyse et réponse à l’érythropoïétine humaine recombinante chez les patients hémodialysis. Néphrol cadran transplant 2000, 15: 1207-1211.
29.- de Léo fr, Renee J, McCormick S, Nakamura M, Apicelle M, Weiss JP: Neutrophiles exposés à la lipopolysacharide bactérienne Supprimer l’assemblage NADPH oxydase: J Clin Invest 1998; 101: 455-463.
30.- Morena M, Cristol JP, Canaud B. Pourquoi les patients hémodialysis sont dans un état prooxydant? Ce qui pourrait être fait pour corriger le déséquilibre pro / antioxydant. Purif de sang 2000; 18: 191-199.
31.- Pertosa G., Gesualdo L., Bottalico D., Schena FP.: Les endotoxines Modulumes Facteur de nécrose tumorale chronique Alpha Ang Interleukine 6 libération par des monocytes urémiques . TRANSPLANT DE NEPHROL DIALLE 1995; 10: 328-333.
32.- Sundaram S, King AJ, Pereira BJ. Protéines liées au lipopolysaccharide et facteur bactéricidal / perméabilité-croissant au cours de l’hémodialyse: déterminants cliniques et rôle de différentes membranes. J SOC SOC NEPHROL 1997; 8: 463-470.
33.- Girndt M, Köhler H, Schiedhelm-Weick E, Schlaak JF, Büschenfelde KHM, Fleischer B. Production d’Interleukine-6, facteur de nécrose tumorale A et interleukine-10 Corrélate in vitro avec le défaut immunitaire clinique chez les patients chroniques d’hémodialyse. Rein int 1995; 47: 559-565.
34.- Scherberich Je, Nockher Wa: phénotypes de monocytes sanguins et récepteur de l’endotoxine soluble CD14 dans des maladies inflammatoires systémiques et des patients atteints d’insuffisance rénale chronique. TRANSPLANT DE DIALMENT DE NEPHROL 2000; 15: 574-577.
35.- PECOITS-FILHO R, Bárány P, Lindholm B, Heimbürger O, Stenvinkel P. Interleukin-6 est un prédicteur indépendant de la mortalité chez les patients de démarrage de diálisis. Transplantation de cadran de Néphrol 2002; 17: 1684-1688.
36.- Bologa RM, Levine DM, Parker Ts, Cheup JS, Serur D, STENZEL KH, RUBIN AL. Interleukin-6 prédit une hypoalbuminémie, une hypocholestérolémie et une mortalité chez les patients hémodialysis. Am j rein Dis 1998; 32: 117-114.