ARTICLE DE REVISIÓ
Immunopatogènia de la malaltia hipertensiva gravídica
Immune-Pathogenesis of Pregnant Hypertension
Alaín Alonso-Remei, Maité Pérez-Cutiño, Dania F. de Lleó Prim
Universitat de Ciències Mèdiques de Cienfuegos. Cuba.
RESUM
La malaltia hipertensiva gravídica constitueix una patologia obstètrica relativament freqüent. En els últims anys s’ha avançat en la comprensió de la patogènia de la malaltia, a l’ésser el sistema immune un dels actors de vital importància en l’aparició d’aquest trastorn. Les cèl·lules assassines naturals de la decídua constitueixen un component fonamental en el remodelat vascular durant la formació de la placenta. Quan hi ha alteracions en aquesta població cel·lular, s’indueix una isquèmia placentària que promou l’alliberament de factors vasculars i mediadors de la inflamació que promouen el dany sistèmic amb aparició dels símptomes de la malaltia.
Paraules clau: preeclàmpsia; sistema immune; patogènia.
ABSTRACT
Pregnant hypertension is a freqüent pregnancy disorder. Researchers has recentely advanced in understanding this disease Pathogenesis. The immune system plays a key role in this disease onset. Decidual natural killer cells are fonamental component in vascular remodeling during placental development. When Alterations occurs in this cell population, placental ischemia is induced promoting the release of vascular factors and Inflammation mechanisms that causi these disease symptoms.
Keywords: preeclàmpsia; immune system; Pathogenesis.
INTRODUCCIÓ
L’embaràs és considerat com un esdeveniment fisiològic i és rebut, en la majoria dels casos, com un regal concedit a l’sexe femenino.1 No obstant això, en aquesta etapa hi nombroses afeccions que constitueixen causa de morbiditat i mortalitat maternoinfantil.
La preeclàmpsia / eclampsia és una malaltia d’etiologia desconeguda en la qual apareix un substrat fisiopatològic d’hipòxia tissular generalitzada, particularment en la microcirculació, amb repercussió multisistèmica que afecta especialment, a l’ronyó, el fetge, els vasos sanguinis i el sistema nerviós central. La hipòxia, per altres raons (hipòxica, anèmica), agreujarà més la situació de la pacient a l’incrementar el dany a la microcirculación.2
Han transcorregut aproximadament 2 000 anys després que Paracels descrivís la malaltia per primera vegada; però, el progrés en la comprensió de la pre-eclampsia ha estat lent i només en els últims 10 o 15 anys ha canviat el coneixement d’aquest desorden.3
El quadre clínic es caracteritza per xifra de pressió sistòlica arriba 140 mmHg o més i de pressió diastòlica de 90 mmHg o més, acompanyada de proteïnúria; és freqüent que a més es presenti cefalea, acúfens, fosfens, edema, dolor abdominal i / o alteracions de laboratori. Se li coneix com eclàmpsia quan a més, les pacients amb malaltia hipertensiva gravídica presenten convulsions o estat de coma en absència d’altres causas.4
Entre els factors de risc coneguts que predisposen a la preeclàmpsia estan: la Nul·liparitat, l’adolescència, dones majors de 35 anys, obesitat, hipertensió arterial prèvia, embaràs múltiple, malalties cròniques com la diabetis mellitus, història de preeclampsia / eclampsia en embarassos previs, història familiar de preeclàmpsia i / o d’haver patit eclàmpsia, entre d’altres factors. 4
Recentment s’ha demostrat que durant l’embaràs hi ha un remodelat de les artèries espirals uterines amb invasió de les cèl·lules trofoblàstica, el qual és indispensable per a una correcta irrigació placentària. Quan aquest fenomen és deficient, s’obté com a resultat una placenta isquèmica, la qual constitueix un factor central en l’etiopatogènia de la preeclampsia.5,6
Components de el sistema immune com Macròfags i cèl·lules assassines naturals uterines (DNK de l’anglès decidual Natural killer) estan involucrades en el procés de placentació. Hi ha evidències que apunten a una relació directa entre les poblacions de cèl·lules immunes de la placenta, l’ambient de citoquines produïdes per aquestes cèl·lules i l’aparició de malalties associades a la gestació com creixement intrauterí retardat, avortaments i malaltia hipertensiva gestacional.5,7
Basats en les sòlides evidències que apunten a un paper important de el sistema immune en la patogènia de la malaltia hipertensiva gravídica hem decidit realitzar la present revisió amb el propòsit de descriure els principals mecanismes immunològics que participen en la patogènia de la pre-eclampsia a través del resum de les dades aportades per articles publicats respecte a el tema en els últims 10 anys.
MÈTODES
Es va realitzar una revisió bibliogràfica a la base de dades de Pubmed / Medline, usant els descriptors: pre-eclampsia, pre-eclampsia and Inflammation, pre-eclampsia and immune system , pre-eclampsia and citoquines. Es va prendre com a criteri d’inclusió tots els articles publicats en revista d’accés obert la data de publicació no antecediera a l’2005. Van aparèixer un total de 225 articles, dels quals van ser seleccionats 30 treballs en els resums trobem aspectes relacionats amb el propòsit de la nostra investigació . A més a es va revisar la Revista Cubana de Ginecologia i Obstètrica on es van emprar els descriptors: pre-eclampsia, etiopatogènia de la pre-eclampsia de la qual es van seleccionar 4 articles publicats de l’2005 a la data.
Immunopatogènia
Sistema immune a la placenta normal
La placenta constitueix l’òrgan d’intercanvi matern fetal, a més d’encarregar de la producció d’hormones. Cap al quart mes està formada per dos components; 1 fetal el cori frondós i un matern, la decídua basal. A la zona d’unió es barregen cèl·lules trofoblàstiques i deciduales. Entre la làmina coriònica i decidual es troben els espais intervellosos ocupats per sang materna.8 La interfície maternofetal es forma en els espais intervellosos i en la decídua basal (fig. 1) .9
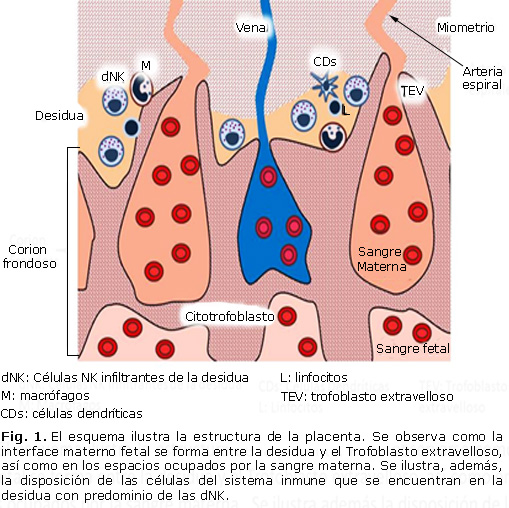
Les cèl·lules trofoblàstica estan en contacte directe amb la sang materna. El fetus es comporta com un trasplantament semi-al·logènic per tenir la meitat de la informació la informació genètica de la madre.10 Per evitar el rebuig, les cèl·lules trofoblàstica no expressen les molècules de l’complex principal d’histocompatibilitat (MHC de l’anglès: Major Histocompatibility Complex ) classe II (DP, DQ i DR). Tampoc presenten les molècules de l’MHC classe I A ni B; només expressen el MHC IC i formes no clàssiques de l’MHC I com l’HLA (de l’anglès: Human Leukocyte Antigens) E, F i G.11 D’aquesta manera les cèl·lules trofoblàstica eviten l’eliminació per les cèl·lules immunes maternes presents a la interfície materno fetal.
A la decídua es troben cèl·lules de el sistema immune com limfòcits, cèl·lules dendrítiques, cèl·lules assassines naturals i altres les quals són necessàries per a l’embaràs normal.12 Les cèl·lules assassines naturals (NK de l’anglès Natural Killer) constitueixen la principal població de leucòcits a la interfície maternoinfantil fetal.13 en humans aquesta població representa el 70% de totes les cèl·lules blanques trobades en la placenta durant el primer trimestre d’embaràs i s’anomenen NK infiltrant de la decídua (DNK). Aquesta població es distingeix pel fenotip CD56 bright CD16- a diferència de les cèl·lules NK tradicionals trobades en sang perifèrica i altres teixits, les quals es caracteritzen per expressar els marcadors CD56dim CD16 + (fig. 1) .14
La població de DNK al no expressar de el receptor de baixa afinitat per IgG (CD16) no té activitat citotòxica depenent d’anticòs (ADCC de l’anglès antibody-dependent cell-mediated cytotoxicity) .9 a més a les DNK tenen major expressió de l’receptor KIR (de l’ anglès: killer cell immunoglobulin-like receptors) 14 i ILT (de l’anglès: Leukocyte immunoglobulin-like receptor) 15 que les cèl·lules NK de la sang perifèrica.
Els KIR són una família polimòrfica de receptors on alguns tenen acció inhibidora mentre altres transmeten senyals activadores. Els lligands d’aquests receptors són les molècules de l’MHC classe I, particularment l’HLA-C.16 Addicionalment els lligant dels receptors ILT són les molècules de l’HLA-G i la seva senyalització també inhibeix l’activitat citotòxica de les cèl·lules NK.15 Al trofoblast usualment s’expressa altament el HLA-C i HLA-G; 14 això juga un paper important en la tolerància de l’fetus i la formació de la placenta.
Les DNK secreten citocines pro-inflamatòries com TNF-α (Factor de necrosi tumoral alfa, de l’anglès: Tumoral Necrosi Factor Alpha), IL-8 i IFN-γ (interferó gamma); a més de produir factors de creixement com el Factor de creixement de l’endoteli vascular (VEGF, de l’anglès Vascular-endothelium Growth Factor), 5 Factor de creixement de la placenta (PGF, de l’anglès: placental Growth Factor), ANGPT1 / 2 (de l’anglès : angiopoietin) i Factor de creixement Transformant beta1 (TGF-β1, de l’anglès: Transforming Growth Factor beta1) .14
Estudis in vitro i in vivo van demostrar que les senyalitzacions pel receptor activadors en les DNK afavoreixen la activitat secretora; a diferència de les NK de sang perifèrica, les quals alliberen factors citotòxics dels seus gránulos.17 La IL-8 produïda per les DNK intervé en els processos de migració i invasió de trofoblast, però el TNF-α augmenta l’activitat citotòxica de les DNK sobre les cèl·lules de trofoblast.5 De la mateixa manera l’PGF, ANGPT 1/2 i el VEGF intervenen en el procés de formació de la placenta i el remodelat dels vasos sanguíneos.14
A la interfície maternofetal a més de les DNK trobem altres cèl·lules immunes. Els limfòcits T representen menys de l’10% dels leucòcits trobats a la placenta. La majoria són limfòcits TCD4 encara que també podem trobar limfòcits T CD8 encarregats de la producció de citoquines i regulació de la invasió trofoblástica.18
Les cèl·lules dendrítiques (CDs) només representen entre 1 i 2% dels leucòcits (fig. 1). En l’úter predominen les CDs immadures caracteritzades per l’expressió de el marcador CD1a, a diferència de les CDs madures trobades en l’endometri durant de la fase menstrual, les quals expressen el CD38. Les CDs interaccionen directament amb el trofoblast mitjançant el receptor DC-SING (de l’anglès Dendritic cell-specific ICAM grabbing nonintegrin). Donada a la seva funció de presentar antígens, les CDs tenen la capacitat de regulen el patró de diferenciació dels limfòcits T.15
L’acció de les hormones durant l’embaràs també té efecte en els limfòcits. La progesterona indueix la producció de l’Factor d’unió induït per progesterona (PIBF de l’anglès Progesterone-induced binding factor). El PIBF afavoreix en els limfòcits TCD4 la diferenciació a el fenotip Th2 productor d’IL-4, IL-5 i IL-10. Les cèl·lules Th2 promouen l’adquisició de l’fenotip M2 en els macròfags amb la qual cosa contribueix a l’ambient tolerogénico de la placenta.19
Els macròfags representen aproximadament 20% dels leucòcits infiltrants de la decídua durant l’embaràs; però, constitueixen una font important de citocines per a la tolerància de l’fetus i la defensa davant d’infeccions. En l’embaràs normal predominen els macròfags de l’fenotip M2 (CD68 +) secretors de citoquines anti-inflamatorias5 i factors vasculars com VEGF, IL-8 i ANGPT ½ (fig. 1) .20
a Immunopatogènia de la preeclàmpsia
Durant molt temps es va considerar la malaltia hipertensiva gestacional (preeclàmpsia / eclàmpsia) com la malaltia de les múltiples etiologies; però, en la dècada de l’70 de el passat segle es va revelar que aquesta malaltia s’associava a la isquèmia úter-placentària. Avui dia es coneix que aquesta irrigació insuficient es deu a la formació inadequada dels vasos sanguinis a la placenta.21
Durant l’embaràs normal, les cèl·lules derivades de l’cito-trofoblast fetal migren a l’endometri i miometri reemplaçant el múscul llis i l’endoteli de les artèries espirals uterines, aquest remodelat garanteix gots de major calibre i menor resistència a l’flux sanguini. No obstant això, quan aquest procés no passa completament s’inicien complicacions associades a l’embarazo.5
S’han realitzat intensius esforços per entendre els factors involucrats en el procés de formació de la placenta. Recents evidències indiquen que la pobra proliferació, migració i invasió de les cèl·lules trofoblàstica són conseqüències de la infiltració aberrant per cèl·lules immunes a l’úter i l’acció de les citoquines produïdes per aquestes células.5
A la patogènia de la preeclàmpsia estan involucrats les molècules no clàssiques de l’MHC, les cèl·lules NK, cèl·lules dendrítiques, receptores de reconeixement de patrons, citocines i les subpoblacions de limfòcits TCD4 i TCD8. 22 És per això que el sistema immune juga un paper important en aquest trastorn. Experiments in vitro van demostrar que les DNK són importants per al procés de remodelat de les artèries espirals i correcta formació de la placenta. Per tant, alteracions en aquesta població cel·lular estan vinculades amb l’aparició de la enfermedad.23
En un model murí de malaltia hipertensiva gravídica es va demostrar que hi ha una reducció de la població de DNK amb la consegüent pèrdua de factors derivats d’aquestes células.24 Altres estudis, mitjançant el model murí de pre-eclampsia BPH / 5 van mostrar elevació de la IL-15 alhora que va disminuir la població DNK. En humans s’ha corroborat l’existència de relació entre els nivells d’IL-15 i la severitat de la preeclampsia.13
Estudis immunohistoquímics en humans han demostrat un augment en la població de cèl·lules NK (CD56) placentàries respecte a les placentes d’embarassades normals. No obstant això no s’han trobat diferències significatives entre la infiltració per cèl·lules NK placentàries entre dones amb pre-eclampsia i eclampsia.25 Aquests resultats aparentment contradictoris al trobat en models animals es deuen al fet que en pacients amb malaltia hipertensiva gravídica ocorre un procés inflamatori associat a la isquèmia placentària amb reclutament de cèl·lules NK perifèrica amb activitat citotóxica16 aquestes dades ens corroboren la teoria que hi ha un vincle entre inflamació i el desenvolupament de la malaltia.Encara que recentment s’han publicat noves evidències que confirmen el paper de la inflamació en la gènesi de la pre-eclampsia.26,27
Altres causes d’inflamació diferents de la isquèmia han estat relacionades amb la gènesi de la malaltia . Per exemple, s’hi descriu l’associació entre les infeccions de l’tracte genital i múltiples patologies en dones embarassades. Dins d’elles les fallades d’implantació, avortaments i parts pre-termes. No obstant això, l’ambient inflamatori ocasionat per aquests gèrmens alteren el patró de citocines en l’úter, el que pogués contribuir a l’aparició de la malaltia hipertensiva gestacional com a factor desencadenante.28
Estudis en models animals van mostrar que la injecció de LPS a l’inici de l’embaràs produïa símptomes similars a la pre-eclampsia. Aquestes troballes suggereixen que la senyalització pel receptor de reconeixement de patrons TLR-4 (de l’anglès: Toll-like receptor) és important en la gènesi d’aquesta malaltia. Hi dades clíniques d’increment d’aquest receptor en placentes humanes de dones amb pre-eclampsia.29 A més, apunten a una possible associació entre els bacteris Gram negatives i el desenvolupament de la malaltia hipertensiva gestacional.30 Cal recordar que una part important de la microbiota de l’tracte genital són bacteris Gram negatives.
La resposta inflamatòria no només apareix davant infeccions; per exemple, l’obesitat s’associa a un procés inflamatori crònic de baix grau. 31 Estudis han demostrat que l’obesitat i les dietes riques en sucres i greixos disminueixen la infiltració de DNK durant l’embaràs. Addicionalment els adipòcits produeixen leptina, la qual incrementa l’activitat citotòxica de les dNK.5 Els resultats són menors nivells dels factors necessaris per estimular la migració de trofoblast i per l’altre, una població de DNK amb capacitat de destruir les cèl·lules trofoblásticas. La combinació d’aquests fenòmens es tradueix en un menor remodelat de les artèries espirals, per tant, s’afecta el flux sanguini úter-placentari i la placenta es torna isquèmica.
La placenta isquèmica produeixes factors solubles com el sFLt1 i el VEGF, l’elevació d’aquests factors en la sang materna s’associa amb l’inici de la pre-eclampsia.32-34 L’ús d’anticossos monoclonals (ACM ) contra el sFLt1 i el VEGF van demostrar disminuir la proteïnúria en ratolins. Curiosament en humans la pre-eclampsia no es desenvolupa en totes les dones amb elevats valors de sFLt1.35 Aquests resultats es deuen al fet que els factors produïts per la placenta isquèmica indueixen un dany endotelial generalitzat responsable de la proteïnúria i de l’elevació de les xifres de tensió arterial. La combinació d’aquests dos factors i el dany endotelial són responsables de l’aparició d’edemes en aquestes pacients (fig. 2) .26

Les endoglin semblen jugar un paper important en la lesió endotelial i poguessin servir com a marcadors de risc per al desenvolupament de la malaltia. El factor induïble d’hipòxia alfa (HIF1-α d’anglès hypoxia induïble factors) sembla jugar un paper rellevant en l’inici de la malaltia hipertensiva gestacional.36 El HIF1-α es produeix en resposta a la hipòxia i el seu augment en la placenta s’associa a l’expressió de gens de resposta a hipòxia dins dels quals es troba el VEGF i el sFLt1.37
el factor HIF1-α no només intervé en la síntesi de factors vasculars derivats de la placenta si no té efecte en el sistema immune, el que afavoreix l’ambient inflamatori a la interfície maternofetal, 37 amb augment de les poblacions Th1, productores d’IFN-γ, IL-2 i IL-12, unit a una disminució de les poblacions de limfòcits T reguladores.38 Aquest ambient inflamatori, unit a el dany endotelial afavoreix el reclutament de NK amb activitat citotòxica, les quals destrueixen les cèl·lules trofoblàstica afectant encara més la circulació úter-placentària i reforça la isquemia.39 Per aquest motiu el inadequat aporti oxigen sigui el factor detonant de la malaltia.
La isquèmia placentària indueix a més un augment en la població de macròfags M1 productors de IFN-γ.5 Tot i que el IFN-γ augmenta la producció de CXCL12 per les cèl·lules endotelials, principal factor per al reclutament de NK CD56 bright CD16, -40 seva senyalització indueix apoptosi en les cèl·lules trofoblástica.11 Per tant, aquesta isquèmia inicial empitjora la gènesi de la malaltia convertint-se en un llaç d’amplificació en la immunopatogènia de la preeclàmpsia. Per aquesta raó, podem afirmar que l’efecte de l’IFN-γ en la immunopatogènia de la preeclàmpsia és controversial; no obstant això, molts autors han relacionat associació entre alts nivells d’aquesta citocina i el desenvolupament de la malaltia.22
Altres citocines produïdes pels macròfags de l’fenotip M1, com el TNF-α, afavoreix l’expressió aberrants de metaloproteinasas i produeix apoptosi directa en les cèl·lules trofoblàstica amb el que es alenteix la invasió trofoblàstica a les artèries espirals . 40 De forma general les citoquines proinflamatòries disminueixen la migració trofoblàstica i estan vinculades a el desenvolupament de la enfermedad.22
De la mateixa manera, el patró de resposta de limfòcits TCD4 també es relacionen amb l’aparició de la patologia, on algunes subpoblacions com els Th1 i Th17 afavoreixen la seva aparició; mentre que els Treg i Th2 constitueixen factors protectores.41,42 De forma general les citoquines de el patró Th1 promouen apoptosi de les cèl·lules trofoblásticas i retard en la invasió de trofoblast; mentre que les citoquines de el patró Th2 afavoreixen la proliferació i invasió de l’trofoblasto.11,22 Estudis clínics han demostrat que les dones amb preeclàmpsia tenen xifres de limfòcits Th17 elevados43 i Treg disminuïts respecte a embarassades normals i aquestes alteracions maternes transcendeixen a l’fetus, la qual cosa influeix en el sistema immune de l’nounat en les primeres setmanes de vida.44
a més, el desenvolupament de la malaltia gràvida gestacional té relació amb canvis epigenètics i genètics en la pacient. Un estudi bioinformàtic va demostrar que en l’expressió de gens polimòrfics en les vellositats cròniques influeixen en l’aparició de la preeclàmpsia, d’ells la major part estan vinculat a gens d’expressió diferencial. Molt dels productes d’aquests gens es relacionen amb l’activitat de les dNK.45
Estudis en humans van mostrar que les mares en les que els seus DNK només expressen receptors KIR inhibitoris com el KIR2DL1en combinació amb l’expressió de l’al·lel d’HLA-C2 pel fetus incrementa el risc de malaltia hipertensiva gravídica i creixement intrauterí retardat respecte a les mares que expressen l’al·lel KIR2DS1 de el receptor activador en les dNK.46 Això és explicat pel fet que la senyalització pels receptors activadors indueix en les DNK seves funcions secretores i no les citotóxicas.17
Polimorfismes en el HLA-G també han estat relacionats amb un major risc de preeclàmpsia, ja que els fetus portadors de l’al·lel +14 bp / + 14 bp HLA -G tenen una menor expressió d’HLA-G en les cèl·lules trofoblàstica el que afavoreix l’acció citotòxica de les NK. (11) Altres polimorfismes com el TGF-β 1869 TC; 47 així com en les proteïnes C6 MASP1 de l’complement també s’han associat a el desenvolupament de la enfermedad.48
A manera de resum en la patogènia de la malaltia s’imbriquen factors ambientals i genètics que porten com a conseqüència un menor infiltrat de cèl·lules DNK. A causa de la importància de les DNK a promoure la migració i invasió de les cèl·lules trofoblásticas, una disminució en aquesta població porta com a conseqüència que no es remplace les cèl·lules endotelials ni musculars llises de les artèries espirals amb la consegüent insuficiència de l’aportació de sang i nutrients . En resposta a aquesta isquèmia placentària s’alliberen factors i citoquines que transformen l’ambient de tolerogénico a inflamatori amb la qual cosa es destrueixen encara més les cèl·lules trofoblásticas. D’altra banda, l’excés de factors vasculars i la transformació de l’procés inflamatori local en sistèmic produeix dany endotelial, el qual és responsable de l’aparició de el quadre clínic en aquests pacients.
Conflictes d’interessos: Els autors no declaren tenir conflictes d’interessos.
1. García I, Alemany M. Riscos de l’embaràs en l’edat avançada. Rev Cubana Obstet Ginecol. . 2013; 39 (2): 120-7. Disponible a: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2013000200007&lng=es
2. Suárez J, Gutierrez M, Cairo V, Marín I, Rodríguez L, Veitia M. Preeclàmpsia anterior com a factor de risc en el embaràs actual. Rev Cubana Obstet Ginecol. . 2014; 40 (4): 368-77. Disponible a: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2014000400003&lng=es
3. Delgado J, Reyes E, Amador A, García M, Cubero O, Quesada F, et al. Malonildialdehid i pes a l’néixer en la pre-eclampsia. Breu revisió i associació entre tots dos. Rev Cubana Obstet Ginecol. . 2008; 34 (3): Disponible a: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2008000300003&lng=es
4. Álvarez V, Alonso R, Muñiz M, Martínez J. Caracterització de la hipertensió induïda pel embaràs. Rev Cubana Obstet Ginecol. . 2014; 40 (2): 165-74. Disponible a: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-600X2014000200004&lng=es.
5. Spradley F, Palei A, Granger J. Immune Mechanisms Linking Obesity and Preeclàmpsia. Biomolècules. . 2015; 5: 3142-36. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4693273/
6. Abbas I, Oefner C, Polacheck W, Gardner L, Farrell L, Sharkey A, et al. A Microfluidics assay to study invasió of human placental trophoblast cells. J R Soc Interface. . 2017; 14 (130). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5454302/
7. Matson BC, Caron KM. Adrenomedullin and endocrine control of immune cells during pregnancy.Cel & mol immunol. . 2014; 11: 456-9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4197213/
8. Salder tw. Embriologia mèdica de Langman. 8è ed. Mèxic: Ed Médica Panamericana; 2010.
9. Jabrane-Ferrat n, Seewiera J. El costat de les cèl·lules assassines naturals deciduals: nous desenvolupaments en immunologia de l’embaràs. Immunologia. . 2013; 141: 490-7. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3956423/
10. Göhner c, plösch t, FAAS M. Efectes immunes-moduladores de vesícules extracel·lulars sincronitzats en l’embaràs i preeclampsia. Placenta. . 2017; PII: S0143-4004 (17) 30288-6. http://www.sciencedirect.com/science/article/pii/S0143400417302886?via%3Dihub
11. SERRANO NC. Immunologia i genètica de la preeclampsia. CLION Desenvolupa Immunol. . 2006; 13 (2-4): 197-01. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/17162362
12. Lamarca B, Amaral L, Harmon A, Cornelius D, Faulkner J, Cunningham MJ. Isquèmia placentària i fenotip resultant en models animals de preeclampsia. Curr Hypertens representant. 2016; 18 (5): 38. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5127437/
13. Sones JL, LOB HE, ISROFF CE, Davisson RL. Paper de les cèl·lules assassines naturals deciduals, interleucina-15, i interferó-γ en el desenvolupament de la placenta i la preeclampsia. AM J Fisiol Regul Integry Comp Physiol. . 2014; 307 (5): 490-2. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4214833/
14. da lima p, zhang j, dunk c, lye sj, croy ba. Angiogènesi decidida per leucòcits en l’embaràs primerenc. Cel & mol immunol. . 2014; 11: 522-37. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4220841/
15. Martínez-Varea A, Pellicer B, Perales-Marín A, Pellicer A. Relació entre la resposta immunològica materna durant l’embaràs i l’aparició de Preeclampsia. J de immunol res. . 2014; 2014: 210241. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4060291/
16. Takeshita Lyc, Gonzalez-Galarza FF, dos Santos EJM, Maia MHT, Rahmam MM, Zain SMS, et al. Una base de dades per comportar les associacions entre els receptors i les malalties similars a les poblacions a tot el món. Base de dades. . 2013; 2013: BAT021. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3625957/
17. Hannaj Gwy. Les cèl·lules Decidal NK regulen els processos de desenvolupament clau a la interfície fetal-matern humana. Nat med. . 2006; 12: 1065-74. Disponible en: http://www.nature.com/nm/journal/v12/n9/full/nm1452.html?foxtrotcallback=true
18. Wallace AE, fraser r, cartwright je. Cèl·lules assassines naturals trofoblastes i deciduals extraviloses: una associació de remodelació. Actualització de la reproducció humana. . 2012; 18 (4): 458-71. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3373213/
19. Robinson DP, Klein SL. Les hormones associades a l’embaràs i l’embaràs alteren les respostes immunitàries i la patogènia de la malaltia. El comportament de l’hor. . 2012; 63 (3): 263-71. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3376705/
20. Smith SD, Dunk Ed, Aplin JD, Harris LK, Jones RL. Evidències de la participació de les cèl·lules immunitàries en la remodelació de l’arteriol espiral decidal en l’embaràs humà primerenc. AM J Pathol. . 2009; 174: 1959-71. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2671283/
21. Vázquez Cabrera J. Embaràs, parto i puerperio. Principals complicacions. La Habana: Editorial Ciencias Médicas; 2009.
22. Ning F, Liu H, Lash G. El paper de macròfags deciduals durant l’embaràs normal i patològic. Am J Reprodueix Immunol. . 2016; 75 (3): 298-309: p. 510-24. https://www.ncbi.nlm.nih.gov/pubmed/26750089
23. Robson A, Harris Lk, Innes Ba, Lash Ge, Aljunaidy MM, Aplin JD, et al. Les cèl·lules assassines naturals uterines inicien la remodelació de l’artèria espiral en l’embargament humà. FaseB J.. 2012; 26: 4876-85. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/22919072
24. Linzke N, Schumacher A, Woidacki K, Croy Ba, Zenclussen AC. El monòxid de carboni promou la proliferació de cèl·lules assassines naturals uterines i remodelació de les artèries en espiral en els ratolins d’oxigenasos-1 mutants. Hipertensió. . 2014; 63: 580-8. Disponible en: http://hyper.ahajournals.org/content/63/3/580.long
25. Akhlaq m, Nagi Ah, Yousaf aw. Morfologia placentària en preeclampsia i eclampsia i el paper probable de les cèl·lules NK. Indian J Pathol Microbiol. . 2012; 51 (1): 17-21. Disponible en: http://www.ijpmonline.org/article.asp?issn=0377-4929;year=2012;volume=55;issue=1;spage=17;epage=21;aulast=Akhlaq
26. Borzychowski am, Sargent Il, Redman CWG. Inflamació i preeclampsia. SEM en FET & Neon Med. 2006; 11: 309-16. Disponible en: http://www.sciencedirect.com/science/article/pii/S1744165X06000436?via%3Dihub
27. harmon A, Cornelius d, Amaral l, Faulkner J, Cunningham MJ, Wallace K, et al. El paper de la inflamació en la patologia de la preeclampsia. Clin Sci (Lond). . 2016; 130 (6): 409-19. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5484393/
28. Weiss G, Goldsmith LT, Taylor RN, Bellet D, Taylor HS. Inflamació en trastorns reproductius. Reproducció SCI. . 2009; 16 (2): 216-29. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3107847/
29. Koga k, Mor G. Receptors similars a la interfície matern-fetal en trastorns normals d’embaràs i embaràs. Am J Reprodueix Immuno. . 2010; 63 (6): 587-00. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3025804/
30. Rampersaud r, Randis TM, Ratner AJ. Microbiota del tracte genital superior i inferior. Semin Fetal Neonatal Med. . 2012; 17 (1): 51-7.Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3242913/
31. Romeo gr, Lee j, shoelson se. Síndrome metabòlica, resistència aïllant i paper de mecanismes inflamables i objectius terapèutics. Arterioescler. Tromb. Vasc. Biol. . 2012; 32: 1771-6. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4784686/
32. palmer k, tong s, kaita’u-lino T. sflt-1 de placental SFLT-1: Paper en la fisiopatologia pre-eclaminptica i les seves possibilitats de translació de predicció i diagnòstic clínic. Moleu mol. . 2017; 23 (2): 69-78. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4925329/
33. Almasry s, elfayomy A, Hashem H. Ultrestructura i anàlisi histomorfomètrica de vaixells de cordó umbilical humà a preeclampsia: un paper potencial de VEGF , VEGFR-1 i VEGFR-2. Embrió Rom J morphol. . 2016; 57 (2 suplements): 681-9. Disponible en: http://www.rjme.ro/RJME/resources/files/571216681689.pdf
34. liberis a, stanulov g, ali e, hassan a, pagalos a, kontomanolis E. pre-eclambsia i el creixement endotelial vascular Factor: un nou aspecte. Clin Exp Obstet Gynecol. . 2016; 43 (1): 9-13. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/27048010
35. Kanasaki k, Kalluri R. La biologia de la preeclampsia. Ronyó int. . 2009; 76 (8): 831-7. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4313558/
36. robb k, cotechini t, llaire c, sperou a, Graham C. La restricció de creixement fetal induït en la inflamació en rates s’associa Augment de l’acumulació de la placenta HIF-1α. Plos un. . 2017; 12 (4): E0175805. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5397034/
37. Hipòxia placentària de Charnock-Jones D., tensió endoplasmàtica i sensibilització endotelial materna de SFLT1 en preeclampsia. J Reproduir Immunol. . 2016; 114: 81-5: 38-42. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4822533/
38. Vianna p, mondadori a, bauer m, dornfeld d, chies J. hla-g i cd8 + regulador de cèl·lules t en la inflamació Medi ambient de preeclampsia. Reproducció. . 2016; 152 (6): 741-51. Disponible en: http://www.reproduction-online.org/content/152/6/741.long
39. Southcombe J, Redman c, Sargent I. La sang perifèrica Invariants de sang natural assassí de cèl·lules T Al llarg de l’embaràs i les dones preeclamptiques. J Reproduir Immunol. . 2010; 87 (1-2): 52-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2995212/
40. Lockwood CJ, Basar m, Kayisli UA, Guzeloglu-Kayisli o, Murk W, Wang J, et al. Interferon-G protegeix les cèl·lules decidents de primer trimestre contra la matriu aberrant metalloprotinases 1, 3 i 9 expressió en preeclampsia. AM J Pathol. . 2014; 184: 2549-59. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4188280/
41. Lamarca B, Cornelius D, Harmon A, Amaral L, Cunningham M, Faulkner J, et al. Identificar mecanismes immunes a la mediació de la hipertensió durant la preeclampsia. AM J Fisiol Regul Integry Comp Physiol. . 2016; 311 (1): R1-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4967235/
42. Figueiredo A, Schumacher A. L’ajudant de cèl·lules T tipus 17 / Regulador t de l’embaràs. Immunologia. . 2016; 148 (1): 13-21. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4819144/
43. Cornelius D, Amaral l, Wallace K, Campbell n, Thomas A, Scott J, et al. La reducció de la pressió uterina de la pressió Uterina T-Helper 17 cèl·lules causen fisiopatologia associada a la preeclampsia durant l’embaràs. AM J Fisiol Regul Integry Comp Physiol. . 2016; 311 (6): R1192-R1199. Disponible en: http://ajpregu.physiology.org/content/311/6/R1192.long
44. SAVA F, TOLDI G, Treszl a, Hajdú J, Harmath á, Rigó JJ, et al. Els subconjunts de cèl·lules immunitàries, els nivells de citocina i cortisol durant la primera setmana de vida en els neonats nascuts a les mares pre-eclamines. Am J Reprodueix Immunol. . 2017; 77 (6). Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/aji.12659/pdf
45. Rabaglino MB, post-uiterweer ed, jeyabalan A, hogge wa, conrad kp. Un enfocament de bioinformàtica revela evidències de la maduració endometrial deteriorada abans i durant l’embaràs primerenc en les dones que van desenvolupar preeclampsia. Hipertensió. . 2015; 65 (2): 421-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4290371/
46. Ivarsson ma, Michaëlson J, Fauriat C. Activar els receptors de la cèl·lula similar a la cèl·lula de l’assassí en salut i malalties. Immunol frontal. . 2014; 5 (184): 1-9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4001058/
47. Li x, Shen l, Tan H. Polimorfismes i nivell de plasma de transformació de creixement Factor-beta 1 i risc de preeclampsia: a Revisió sistemàtica. Plos un. . 2014; 9 (5): E97230. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4019528/
48. wu w, yang h, feng y, zhang p, li s, wang x, et al. Polimorfismes en complement gens i risc de preeclampsia a Taiyuan, Xina. Inflam res. . 2016; 65 (10): 837-45. Disponible en: https://link.springer.com/article/10.1007%2Fs00011-016-0968-4