TREBALLS ORIGINALS
Neoplàsia papil·lar mucinosa intraductal de pàncrees: resultats clínic-patològics
intraductal papillary mucinous neoplasms (IPMN) of the pancreas: clinic-pathologic results
J. A.-Cienfuegos1, F. Rotellar1, P. Martí Cruchaga1, V. Valentí1, G. Zozaya1, A. Bueno1, N. Pedano1, MD Lozano2, JJ Sola2 i F. Pardo1
1Departamento de Cirurgia General i Digestiva.
2Servei d’Anatomia Patològica. Clínica Universitat de Navarra. Pamplona, Navarra
Direcció per a correspondència
RESUM
Introducció: la neoplàsia papil·lar mucinosa intraductal (NPMI) de l’pàncrees comprèn una sèrie de lesions que evolucionen des de lesions benignes (adenoma) fins carcinoma ductal invasiu.
Objectiu: analitzar els resultats clínics i patològics de 15 pacients diagnosticats de NPMI i intervinguts segons les recomanacions de conferència de consens.
Material i mètodes: anàlisi retrospectiva de 15 pacients amb NPMI, intervinguts entre març de 1993 i setembre de 2009; segons pautes de conferències de consens internacionals. Es van recollir dades demogràfiques, proves diagnòstiques, tipus d’intervenció, histopatologia i supervivència actuarial amb un seguiment entre mes i mig i nou anys.
resultats: es van realitzar 6 duodenopancreatectomías cefàliques, 4 pancreatectomies totals, 2 pancreatectomies centrals, 2 pancreatectomies parcials i una pancreatectomia distal. Es va registrar una morbiditat de l’40%, sense mortalitat operatòria, amb una estada mitjana de 10 dies. En 5 casos la NPMI va ser de tipus mixt, en 4 afectava el conducte pancreàtic i en els 6 restants a branques accessòries. Dos pacients van presentar carcinoma in situ i 3 carcinoma invasiu amb ganglis negatius. Un pacient, sense carcinoma invasiu, va morir als 66 mesos per adenocarcinoma de pàncrees. La supervivència actuarial fins recidiva o mort va ser de 105,133 mesos; amb un rang de seguiment entre mes i mig i 9 anys. Conclusions: la NPMI tipus ductal i mixt exigeix la resecció completa causa de l’elevada incidència de carcinoma invasiu o de lesions precursores de malignitat. Pel seu caràcter multifocal els malalts han de ser revisats a llarg termini. Hi controvèrsies en les NPMI tipus accessori asimptomàtiques i menors de 3 cm.
Paraules clau: Neoplàsia papil·lar mucinosa intraductal. Factors pronòstics. Carcinoma invasiu. Supervivència.
ABSTRACT
Background: intraductal papillary mucinous neoplasm (IPMN) shows a sèries of lesions which evolve from benign lesions -adenoma- to invasive carcinoma.
Aim: to analyze the clinical and pathological results of 15 patients diagnosed of IPMN, and surgically treated according to the guidelines of International Consensus Conference.
Material and method: a retrospective analysis of 15 patients surgically treated between March 1993 and September 2009, according to the International Consensus Recommendation. Demographic, diagnòstic tools, surgical report, pathologic database and actuarial survival were analyzed with a follow-up from one and a half month through nine years.
Results: 6 patients underwent pancreaticoduodenectomies, 4 total pancreatectomies, 2 body or central pancreatectomies, 2 partial pancreatectomies (enucleation) and 1 distal pancreatectomy. A Morbidity of 46 and 0% hospital mortality were assessed, with a mit length hospital stay of 10 days. In five cases, the IPMN was combined type (both main and branch Pancreatic ducts involved) in four main duct-type and branch duct-type in the another six as well. Several atypia (IPMN carcinoma in situ) was observed in 2 patients and invasive carcinoma with negative lymph nodes was identified in 3 patients. A patient without invasive carcinoma died at 66 months of follow-up for pàncrees adenocarcinoma. The actuarial survival up to recurrence or death was 105,133 months with a range of follow-up from 1 month and a half until 9 years.
Conclusions: IPMN main duct or mixed type warrants completi resection due to its incidence of invasive carcinoma or precursor lesions of malignancy as well. Due to its multifocal pattern, patients should be followed in long-term surveillance. The management of asymptomatic IPMN type branch less than 3 cm is controversial.
Key words: intraductal papillary mucinous neoplasm. Prognosi factors. Invasive carcinoma. Survival.
Introducció
La neoplàsia papil·lar mucinosa intraductal de pàncrees (NPMI) comprèn un espectre de lesions amb característiques biològiques i clíniques que han suscitat gran interès en l’última dècada (1-6 ).
La primera sèrie de casos clínics de NPMI va ser descrita per Ohhashi el 1982 i va rebre el seu nom per Sessa el 1994 (7,8).El fet que el 20-30% de la NPMI sigui multifocal i que el 5-10% pugui afectar tota la glàndula, ha generat múltiples controvèrsies en el tractament quirúrgic i seguiment d’aquests pacients (1-5).
Els fets més significatius de la NPMI són les seves formes de presentació -variant ductal, de conductes pancreàtics accessoris i mixta- i la progressió seqüencial des de lesions incipients, com l’adenoma fins al carcinoma in situ i carcinoma invasiu; per la qual cosa se li ha de considerar com una lesió precursora de el càncer de pàncrees, especialment en les lesions de l’conducte pancreàtic principal (9-13).
Per tal d’aclarir les controvèrsies esmentades, s’han celebrat diverses reunions de consens pel que fa a la diagnosi i tractament. L’objectiu d’aquest treball és analitzar els resultats de l’tractament quirúrgic de la NPMI i la seva concordança amb les recomanacions de les conferències de consens (14-16).
Material i mètodes
Entre març de 1993 i setembre de 2009 es van intervenir 38 pacients per tumors quísticos de pàncrees, dels quals 15 estaven diagnosticats de neoplàsia papil·lar mucinosa intraductal (NPMI), objecte d’aquest estudi.
es va realitzar una anàlisi retrospectiva de les històries clíniques, objectivant els símptomes principals, els relacionats amb la cirurgia, la histopatologia, la supervivència i el patró de recurrència. La indicació quirúrgica es va establir en sessió interdisciplinari, basats en diferents proves d’imatge: tomografia computeritzada multitall (TC), ultrasonografia endoscòpica (USE) amb punció amb agulla fina (PAAF), colangiopancreatografia per ressonància magnètica (CPRM) i citologia segons les pautes les reunions de consens esmentades.
en les lesions localitzades al cap de pàncrees, procés uncinado i cos de pàncrees, es va realitzar duodenopancreatectomia cefàlica (intervenció de Krauss-Whipple). En les lesions centrals es va realitzar pancreatectomia central i en les lesions de cos i cua de pàncrees es va realitzar pancreatectomia cabal o distal. En els pacients amb afectació de tot el conducte de Wirsung, es va practicar pancreatectomia total. En tots els casos es va realitzar estudi intraoperatori de les vores de resecció pancreàtica.
El diagnòstic de NPMI es va realitzar d’acord amb la nomenclatura establerta per la World Health Organization (WHO) (17) i la conferència de consens celebrada a Osaka l’any 2004 (15). Es van excloure els tumors que presentaven un patró similar a l’estroma ovàric i que van ser diagnosticats com tumors quísticos mucinosos (17).
La NPMI es va classificar en tres categories: les que afectaven el conducte pancreàtic principal, les originades en les branques accessòries i les neoplàsies mixtes quan afectaven ambdós components. Els tumors es van classificar en NPMI no invasives i en NPMI invasives; d’acord amb els criteris de WHO i els publicats posteriorment per Singh i Maitra (9,17).
Les vores de resecció es van estudiar d’acord amb les normes de la AJCC (Cancer Staging Manual) (18) . El marge de resecció pancreàtic es va considerar positiu sempre que s’identifiqués microscòpicament qualsevol grau de NPMI.
La mortalitat operatòria es va definir com la mort en el mateix ingrés hospitalari o en els primers 30 dies de l’postoperatori. Es va definir fístula pancreàtica quan les concentracions d’amilasa eren tres vegades superiors a la valor en plasma en el drenatge percutani (19). La recurrència es va definir com “local” al llit pancreàtic, “regional” a la cavitat peritoneal i “a distància” si es produïa en fetge, pulmó, ossos, etc. Els intervals de confiança s’han calculat amb el programa Epi Info 6.0, 4C. Es va calcular la supervivència actuarial segons el mètode de Kaplan-Meier, amb el programa SPSS, versió 15.0.
Resultats
A la taula I es resumeixen les característiques clíniques més rellevants de la sèrie . La incidència va ser similar en ambdós sexes i amb un rang d’edat entre 33 i 79 anys (mitjana 61 anys; mitjana 63,2 anys); límit de confiança (LC): 95%; 55,95-70,44.
Els símptomes de presentació van ser generalment anodins, si bé 5 pacients van cursar amb símptomes específics, com icterícia, febre, episodis previs de pancreatitis i síndrome constitucional.
la prova diagnòstica més utilitzada va ser el CT-abdominal amb la ultrasonografia endoscòpica (USE), i punció amb agulla fixa. La citologia va ser positiva per tumor mucinós en 8 dels 9 casos en què es va realitzar (sensibilitat 88,8%). En dos pacients es va obtenir material insuficient.
Vuit de les neoplàsies es van localitzar al cap de l’pàncrees, en tres malalts afectava de manera difusa a l’conducte pancreàtic principal i en la resta de la NPMI afectava a cos-cua, procés uncinado i en dos casos a el cos de l’pàncrees.Es van realitzar sis duodenopancreatectomías cefàliques, quatre pancreatectomies totals, dues pancreatectomies centrals, dues pancreatectomies parcials i una pancreatectomia distal.
Es van registrar complicacions en 6 pacients (40%). Quatre van presentar “col·leccions al llit quirúrgic” dels quals 3 van requerir drenatge transgàstric mitjançant USE. Un malalt, a què se li va practicar una enucleació, va desenvolupar una fístula pancreàtica als quatre dies de l’alta i va ser tractada amb drenatge percutani. Un altre pacient va desenvolupar buidament gàstric retardat. L’estada hospitalària mitjana va ser de 10 dies (rang 4-22 dies). No va existir mortalitat operatòria.
En cinc casos l’NPMI va ser de tipus mixt i en quatre la NPMI afectava el conducte pancreàtic principal (fig. 1). En els sis restants la NPMI afectava branques pancreàtiques accessòries (fig. 2). En tres casos es va descriure displàsia lleu en el marge de resecció pancreàtic i no es va ampliar la resecció.
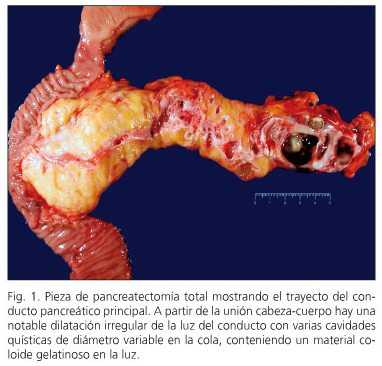
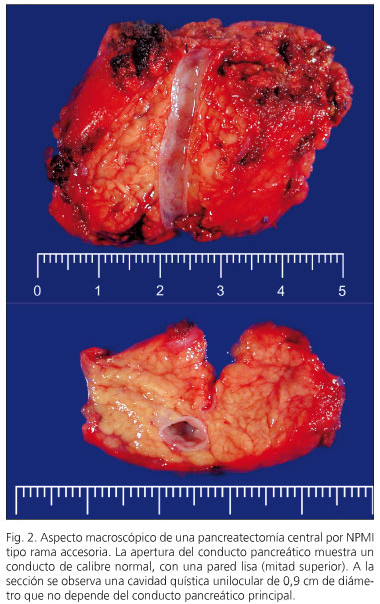
En tres pacients es va detectar neoplàsia intraepitelial pancreàtica ( “Panin”). En dos casos es tractava de l’tipus Panin-1A, lesions planes amb atípia mínima, i una lesió Panin-2 amb atípia moderada. Dos pacients presentaven NPMI amb displàsia d’alt grau -carcinoma in situ (casos 6 i 10) i tres pacients (casos 1, 2 i 3) presentaven un carcinoma invasiu amb ganglis negatius (fig. 3). Dos d’ells es troben lliures de malaltia als vuit i nou anys de seguiment, mentre que un es troba lliure de malaltia als tres anys de la pancreatectomia i després de ser reintervingut d’una recidiva regional als 15 mesos de la pancreatectomia.
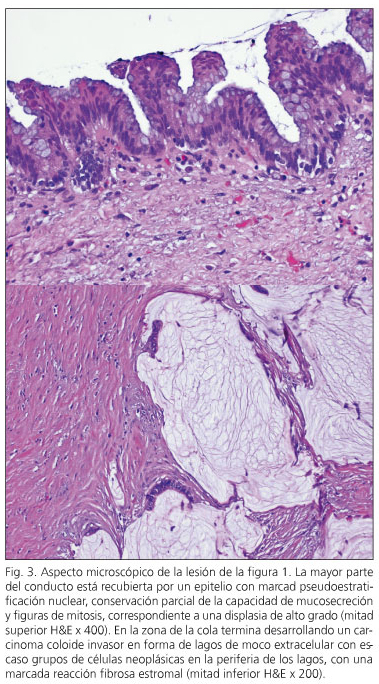
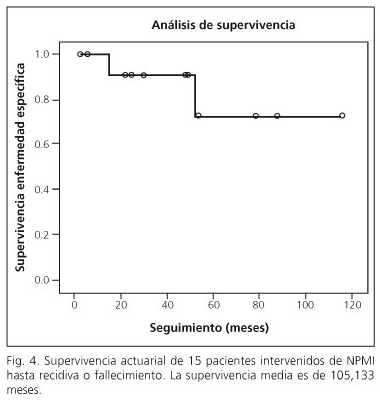
Un pacient (cas 4) va morir als cinc anys i mig d’una recidiva ganglionar locoregional d’un adenocarcinoma de pàncrees. La resta dels pacients romanen vius i lliures de malaltia. Tots els pacients van ser revisats amb un rang de seguiment entre un mes i mig i nou anys; obtenint-se una supervivència actuarial 105,133 mesos amb índex de confiança de 95% (86,264-124,003) i una supervivència fins a la recidiva o mort de 98,355 mesos (interval de confiança: 76,761-119,949). A la figura 4 es recull la supervivència actuarial fins a la presència de recidiva o mort.
Discussió
la primera sèrie de la NPMI va ser descrita per Ohhasi el 1982 (7,20). Posteriorment Sessa i cols. caracteritzar la lesió amb el terme actualment emprat (8).
Finalment, la World Health Organization (WHO) el 1996, amb motiu d’una classificació dels exocrins de pàncrees, va definir la NPMI com la proliferació papil·lar d’un epiteli columnar secretor de mucina en el conducte principal o en els conductes pancreàtics accessoris (17). Aquesta classificació ha aclarit una sèrie de termes confusos que han dificultat conèixer la seva evolució natural i realitzar valoracions comparatives entre diferents autors (5,6).
En l’última dècada hi ha hagut una gran proliferació de publicacions referides a la NPMI i s’estima que entre el 8 i 20% de les reseccions pancreàtiques en centres de referència es deu a aquesta entitat (22-24). Un dels aspectes més singulars són les seves formes de presentació -ductal, branca pancreàtica accessòria i mixta-, i el que se la consideri com una lesió premaligna, en què la seqüència displàsia lleu-carcinoma in situ, carcinoma invasiu està ben establerta. En les peces de resecció pancreàtica s’han descrit focus de neoplàsia intraepitelial pancreàtica (Panin), dividida al seu torn en diversos graus d’atípia cel·lular (Panin-1, Panin-2, Panin-3). Les lesions Panin-1, al seu torn, se subdivideixen en tipus pla (Panin-1A) i tipus papil·lar (Panin-1B).
A causa de les controvèrsies suscitades s’han celebrat diverses reunions de consens i emès guies d’actuació a l’respecte (14-16). Si bé la nostra sèrie és limitada, representa la segona en la literatura espanyola i expressa totes les lesions de la NPMI, des de la seva forma més benigna fins al carcinoma invasiu. El perfil demogràfic és similar a altres sèries, presentant-se en edats relativament avançades (70-80 anys); el que ha pogut suscitar una actitud “nihilista” respecte a el tractament quirúrgic d’aquests pacients.
La localització més freqüent en cap i cos de pàncrees (9 dels 15 casos), i els símptomes de presentació, coincideixen amb els descrits en altres treballs (3,21-25). En la nostra sèrie, els quatre casos amb signes de malignitat -carcinoma in situ o carcinoma invasivo- van ser aquells que tenien afectació de l’conducte principal o mixt, fet que concorda amb la majoria dels autors (24,26-29).
Un malalt va morir als 66 mesos, d’una recidiva ganglionar d’un adenocarcinoma de pàncrees (cas 3) i que va presentar el tipus d’afectació mixta, patró morfològic amb major incidència de lesions invasives en les grans sèries ( 24,26-30). La possible recidiva o tumor “de novo” pancreàtic va aparèixer als cinc anys i mig, que és el temps estimat (5-7 anys) en completar-se l’evolució d’adenoma a carcinoma (9,11,12,24,27). En una sèrie molt similar a la nostra, Adsay i cols. descriuen dos pacients amb una NPMI no invasiva que van morir als 65 mesos de la cirurgia per disseminació locoregional d’un adenocarcinoma de pàncrees (21). En un dels pacients i carcinoma invasiu (cas 13), es va produir una recidiva en peritoneu als 15 mesos de la pancreatectomia total. Aquesta malalta roman viva i lliure de malaltia als 3 anys després de ser reintervinguda.
S’ha descrit l’afectació multifocal en el pàncrees fins a un 30% dels pacients -amb variant “conducte accessori” – i es ha publicat un 10% de recurrències en pacients amb NPMI no invasives, sotmesos a pancreatectomies parcials i amb marges negatius (31,32). S’ha descrit adenocarcinoma de pàncrees sincrònic o metracrónico en el 9,2% de 76 pacients en NPMI (33). Tres dels pacients presentaven afectació de l’marge de resecció pancreàtica amb displàsia lleu. Hi acord en que no és necessària una resecció més àmplia de l’pàncrees (11,16,15,32,34).
La resta dels pacients romanen lliures de malaltia amb un rang de seguiment entre 6 mesos i 8 anys. No va existir mortalitat operatòria i la morbiditat de el 40% es troba en el rang referit per centres acreditats amb experiència en reseccions pancreàtiques (35,36). L’hospitalització mitjana va ser de 10 dies, amb un rang de 5 i 22 dies. De l’experiència publicada es conclou que les NPMI d’afectació ductal i mixta han de ser ressecades quirúrgicament amb la confirmació intraoperatòria d’absència d’invasió de les vores de resecció pancreàtica, estimant-se una supervivència de l’80% als cinc anys en el cas de la NPMI no invasiva i de l’30% en els casos amb carcinoma invasiu. A la taula II vam presentar l’experiència recent de grans sèries (26,31,37-41).
Anteriorment hem comentat que la incidència de carcinoma invasiu és més freqüent en les lesions de l’conducte principal de l’pàncrees (75 %), que en les lesions originades en conductes accessoris (25%) (15,24,30,42,43). Aquests antecedents justifiquen l’estudi de Salvia i cols. en què van realitzar el seguiment de 89 pacients amb NPMI tipus branca-accessori, asimptomàtiques, d’una grandària menor de 3,5 cm i valors de CA-19.9 normals. En aquest estudi només cinc pacients (6%) van desenvolupar un augment de grandària i van ser ressecats sense signes de malignitat (44,45). Resultats similars han estat publicats per Tanno i cols., En el seguiment de 81 pacients durant 61 mesos (46).
Arran d’aquest estudi -grau d’evidència 3- les guies pràctiques recomanen el seguiment d’aquelles lesions que afectin exclusivament als conductes pancreàtics accessoris asimptomàtics, menors de 3 cm de diàmetre i que no presentin nòduls en el seu interior (15,44,47,48). L’interval de seguiment -mitjançant CT i Euskadi no ha de superar els sis mesos; causa de la major incidència d’adenocarcinoma de pàncrees metacrònic a la resta de la glàndula pancreàtica (49,50).
Basats en experiències prèvies, podem concloure que la NPMI amb afectació de l’conducte principal i tipus mixt s’ha de ressecar amb confirmació histològica d’absència d’invasió de les vores de resecció. En els casos de NPMI no invasiva, s’estima una supervivència als 5 anys de l’80% i de l’30% en aquells casos que presenten un carcinoma invasiu. Latabla II resumeix l’experiència de les sèries més importants.
![]() Direcció per a correspondència: a Javier A. Cienfuegos. Del Departament de Cirurgia General.
Direcció per a correspondència: a Javier A. Cienfuegos. Del Departament de Cirurgia General.
Clínica Universitat de Navarra.
Avda. Pius XII, 36. 31008 Pamplona, Navarra.
e-mail: [email protected]
Rebut: 24-11-09.
Acceptat: 09-02-10.
Bibliografia
1. GARCÈA G, Ong SL, Rajesh A, Neal CP, Pollard CA, Berry DP, et al. Cystic lesions of the pàncrees. A diagnòstic and management dilemma. Pancreatology 2008; 8: 236-51.
2. Goldsmith JD. Cystic neoplasms of the pàncrees. Am J Clin Pathol 2003; 119 (1): S3-S16.
3. Basturk O, Coban I, Adsay NV. Pancreatic cysts: pathologic classification, differential diagnosi, and clinical Implications. Arch Pathol Lab Med 2009; 133: 423-38.
4. Adsay NV. Cystic lesions of the pàncrees. Modern Pathology 2007; 20: 571-93.
5. Seijo Rius S, Lariño Noia J, Iglesias García J, Lozano Lleó A, Domínguez Muñoz JE. Tumor papil·lar mucinós i intraductal: abordatge diagnòstic i terapèutic. Gastroenterol Hepatol 2008; 31: 92-7.
6. Fernández-Esparrach G, Pellisé M, Ginès A.Tumor Mucinoso Papilar Intraductatal del Páncreas: Una entitat más desconocida que infreqüent. Gastroenterol Hepatol 2003; 26: 562-70.
7. Ohhhashi K, Murakami y, Takekoshi T. Quatre casos de càncer de pàncrees pancreàtics secretor mucosos (Abstr). PROG DIGUNY ENDOSC 1982; 20: 348-51.
8. Sessa F, Solcia E, Capella C, Bonato M, Scarpa A, Zamboni G, et al. Els tumors papil·lars-mucinosos intraductals representen un grup diferent de neoplàsies pancreàtiques: una investigació de la diferenciació de cèl·lules tumorals i les anomalies K-RAS, P53 i C-ERBB-2 en 26 pacients. VIRCHOWS Arch 1994; 425: 357-67.
9. Singh M, Maitra A. Lesions precursores de càncer de pàncrees: patologia molecular i implicacions clíniques. Pancreatologia 2007; 7 (1): 9-19.
10. Hruban RH, Maitra A, Kern SE, Goggins M. Precursors al càncer de pàncrees. Gastroenterol Clin North am 2007; 36: 831-49.
11. Maitra A, Fukushima N, Takaori K, Hruban Rh. Precursors al càncer pancreàtic invasor. Adv Anat Pathol 2005; 12: 81-91.
12. Maitra A, Hruban Rh. Càncer de pàncrees. Annu Rev Pathol Mech Dis 2008; 3: 157-88.
13. Serikawa M, Sasaki T, Fujimoto Y, Kuwahara K, Chayama K. Gestió de la neoplàsia mucinosa intraductal del pàncrees: estratègia de tractament basada en la classificació morfològica. J Gastroenterol 2006; 40: 856-62.
14. Furukawa t, Klöppel G, Volkan Adsay N, Albores-Saavedra J, Fukushima N, Horii A, et al. CLASSIFICACIÓ DE TIPUS DE NOOPLASS DE PAPILLARI PAPILLARIS intraducTals del pàncrees: un estudi de consens. VIRCHOWS Arch 2005; 447: 794-9.
15. Tanaka M, Chari S, Adsay V, Fernández-del Castillo C, Falconi M, Shimizu M, et al.; Associació internacional de pancreatologia. Directrius de consens internacional per a la gestió de neoplàsies mucinoses papills intraductals i neoplàsies quística mucíniques del pàncrees. Pancreatologia 2006; 6: 17-32.
16. Hruban Rh, Takaori K, Klimstra DS, Adsay NV, Albores-Saavedra J, Biankin Av, et al. Un consens il·lustrat sobre la classificació de la neoplàsia intraepitelial pancreàtica i les neoplàsies mucinoses intraductals. Am J Surg Pathol 2004; 28: 977-87.
17. Kloppel G, Solcia E, Longnecker DS, Capella C, Sobin LH. Escriviment histològic de tumors del pàncrees exocrí. A: Organització Mundial de la Salut Classificació Internacional de Tumors. 2n ed. Berlín: Springer; 1996. p. 11-20.
18. Edge SB, BYRD DR, Compton CE, Fritz AG, Green Fl, Trotti A, editors. Pàncrees exocrins i endocrins. EN: AJCC. Manual d’estadificació del càncer. 7è ed. Nova York: Springer-Verlag; 2010. p. 241-9.
19. Bassi C, Dervenis C, Buturrini G, Finginghut A, Yeo C, Izbicki J, et al.; Grup d’estudi internacional sobre definició de fístula pancreàtica. Fístula pancreàtica postoperatòria: com a grup d’estudi internacional (ISGPF) Definició. Cirurgia 2005: 138: 8-13.
20. Ohhhashi k, Takagi K. ERCP i diagnòstic d’imatge del càncer de pàncrees (Abstr). Endoscòpia 1980; 77: 1493-5.
21. Adsay NV, Conlon KC, Zee Sy, Brennan MF, Klimstra DS. Neoplàsies papil·lars-mucinoses intraductals del pàncrees: una anàlisi de carcinomes in situ i invasius en 28 pacients. Càncer 2002; 94: 62-77.
22. Raut CP, Cleary Kr, Staerkel Ga, Abbruzzesse JL, Wolff Ra, Lee Jh, et al. Neoplàsies mucinoses papil·la intraductals del pàncrees: efecte de la invasió i l’estat de marge pancreàtic en la recurrència i la supervivència. Ann Surg Oncol 2006; 13: 582-94.
23. Ubiña Aznar E, Rivera Irigoin R, Méndez Sánchez I, Fernández Moreno N, García Fernández G, Sánchez Cantos A. signes endoscòpics de tumor muchós del pàncrees. Rev ESP ENFERM DIG 2007; 7: 413-4.
24. Sohn Ta, Yeo CJ, Cameron JL, Hruban RH, Fukushima N, Campbell Ka, et al. Neoplàsies mucinoses papills intraductals del pàncrees: una experiència actualitzada. Ann Surg 2004; 239: 788-97.
25. Marín Serrano E, Macías Rodríguez MA, Rendón Unceta P, Pérez Requena J, Guillén Mariscal P, Martín Herrera L. Pancreic Pàncer de tumor muchós intraductístic. Rev ESP ENFERM DIG 2005; 11: 836-7.
26. Schnelldorfer t, Sarr Mg, Nagorney DM, Zhang L, Smyrk TC, Qin R, et al. Experiència amb 208 reseccions per a la neoplàsia mucinosa de papil·les intraductables del pàncrees. Arch Surg 2008; 143: 639-46.
27. Salvia R, Fernández-del Castillo C, Bassi C, Thayer Sp, Falconi M, Mantovani W, et al. Principals ducts intraductuals Neoplàsies mucinoses del pàncrees: predictors clínics de malignitat i supervivència a llarg termini després de la resecció. Ann Surg 2004; 239: 678-85.
28. Yang AD, Melstrom LG, Bentrem DJ. Resultats després de la pancreatectomia per a neoplasmes mucinoses papills intraductals del pàncrees: una experiència institucional. Cirurgia 2007; 142: 529-34.
29. D’Angélica M, Brennan MF, Suriawinata AA, Klimstra D, Conlon KC. Neoplàsies mucinoses papills intraductals del pàncrees: una anàlisi de característiques i resultats clínica. Ann Surg 2004; 239: 400-8.
30. Rodríguez Jr, Salvia R, Crippa S, Warshaw Al, Bassi C, Falconi M, et al.Branca-conducte neoplàsies mucinoses intraductals intraductals: observacions en 145 pacients que van patir la resecció. Gastroenterologia 2007; 133: 72-9.
31. White R, d’Angelica M, Katabi N, Tang L, Klimstra D, Fong Y, et al. Fate del pàncrees romanent després de la resecció de la neoplàsia mucinosa intraductual no invasiva. J am Coll Surg 2007; 204: 987-93.
32. Chari St, Yadav D, Smyrk TC, Dimagno EP, Miller LJ, Raimondo M, et al. Estudi de la recurrència després de la resecció quirúrgica de la neoplàsia mucinosa papil·la intraductal del pàncrees. Gastroenterologia. 2002; 23: 1500-7.
33. Yamaguchi K, Ohuchida J, Ohtsuka t, Nakano K, Tanaka M. Tumor muchós-mucinós intraductal del pàncrees concomitant amb carcinoma ductal del pàncrees. Pancreatologia 2002; 2: 484-90.
34. Andea a, sarkar f, adsay vn. Correlats clínicament de la neoplàsia intraepitelial pancreàtica: una anàlisi comparativa de 82 casos amb i 152 casos sense adenocarcinoma ductal pancreàtic. Mod pathol 2003; 16: 996-1006.
35. Joseph B, Morton JM, Hernández-Boussard T, Rubinfeld I, Faraj C, Velanovich V. Relació entre el volum de l’hospital, els recursos clínics del sistema i la mortalitat en la resecció pancreàtica. J am Coll Surg 2009; 208: 520-7.
36. Van Heek NT, Kuhlmann KF, Schoid RJ, de Castro SM, Busch o, van Gulik Tm, et al. Volum de l’hospital i mortalitat després de la resecció pancreàtica: una revisió sistemàtica i una avaluació de la intervenció als Països Baixos. Ann Surg 2005; 242: 781-8.
37. Wada K, Kozarek Ra, Traverso W. Resultats després de la resecció de neoplàsies mucinoses intraductuals intraductables invasores i no invasives del pàncrees. Am jurg 2005; 189: 632-7.
38. Raut CP, Cleary Kr, Staerkel Ga, Abbruzzesse JL, Wolff Ra, Lee Jh, et al. Neoplàsies mucinoses papil·la intraductals del pàncrees: efecte de la invasió i l’estat de marge pancreàtic en la recurrència i la supervivència. Ann Surg Oncol 2006; 13: 582-94.
39. Nakagohri t, Kinoshita T, Konishi M, Takahashi S, Gotohda N. Resultat quirúrgic de les neoplàsies mucinoses papil·les intraductals del pàncrees. Ann Surg Oncol 2007; 14: 3174-80.
40. Nara S, Shimada K, Kosuge T, Kanai Y, Hiraoka N. Minimament invasives papills mucinosos-mucinosos del pàncrees: estudi clínicopatològic de 104 neoplàsies papillars-mucinoses intraductals. AM J Surg Pathol 2008; 32: 243-55.
41. Nagai K, doi r, kida a, kami k, kawaguchi y, ito t, et al. Neoplàsies mucinoses papills intraductals del pàncrees: característiques clínicopatològiques i seguiment a llarg termini després de la resecció. World J Surg 2008; 32: 271-8.
42. Terris B, Ponsot p, Paye F, Hammel P, Sauvanet A, Molas G, et al. Els tumors mucinosos papills intraductals del pàncrees confinat a conductes secundaris mostren característiques patològiques menys agressives en comparació amb els que impliquen el conducte pancreàtic principal. AM J Surg Pathol 2000; 24: 1372-7.
43. KOBARI M, EGAWA S, SHIBUYA K, SHIMAMURA H, SUNAMURA M, Takeda K, et al. Els tumors muchosos papills intraductals del pàncrees comprenen 2 subtipus clínics: diferències en característiques clíniques i gestió quirúrgica. Arch Surg 1999; 134: 1131-6.
44. Salvia R, Crippa S, Falconi M, Bassi C, Guarise A, Scarpa A, et al. Neoplàsies muchas mucinoses intraductals de sucursals del pàncrees: per operar o no operar? GUT 2007; 56: 1086-90.
45. GHANEH P, NEOPTOLEMOS J. Un nou enfocament per a la gestió de les neoplàsies pancreàtiques muchas muchas muchas. GUT 2007; 56: 1041-4.
46. Tanno S, Nakano Y, Nishikawa T, Nakamura K, Sasajima J, Minoguchi M, et al. Història natural de la branca conducte intraductals de neoplàsies mucíniques del pàncrees sense nòduls murals: resultats de seguiment a llarg termini. GUT 2008; 57: 339-43.
47. Bassi C, Sarr Mg, Lillemoe KD, Reber HA. Història natural de les neoplàsies mucinoses papills intraductals (IPMN): evidències i implicacions actuals per a la gestió. J Gastrointest Surg 2008; 12: 645-50.
48. Woo Sm, Ryu Jk, Lee Sh, Yoon WJ, Kim Yt, Yoon Yb. Muc de branca de neoplàsies mucinoses intraductals intraductals en una sèrie retrospectiva de 190 pacients. BR J Surgu 2009; 96: 405-11.
49. Tanno S, Nakano Y, Koizumi K, Sugiyama Y, Nakamura K, Sasajima J, et al. Adenocarcinomes ducals pancreàtics en pacients de seguiment a llarg termini amb neoplàsies mucinoses papil·lars papills de sucursals. Pàncrees 2010; 39: 36-40.
50. Belyaev O, Seeling MH, Muller Ca, Tannapfel A, Schmidt Nosaltres, UHL W. Neoplàsies muchas mucinoses intraductals del pàncrees. J CLIN Gastroenterol 2008; 42: 284-94.