Introducció
L’esclerosi lateral amiotròfica (ELA) té com a característica principal la pèrdua selectiva de neurones motores en el cervell, el tronc cerebral i la medul·la espinal1. La majoria dels casos d’ELA són esporàdics, però aproximadament el 10% dels pacients tenen un historial familiar2, i d’aquests pacients, el 20% tenen mutacions en el gen de Cu2 + / Zn2 + superòxid dismutasa1 (SOD1) març. A més, la TDP-43 i la proteïna FUS / TLS podrien estar associades en pacients amb ELA familiar i esporádica4,5, i el major percentatge de casos han estat vinculats a una expansió intrónica d’una repetició GGGGCC de l’hexanucleótido en el gen C9ORF726.
el mecanisme pel qual les neurones motores esdevenen selectivament vulnerables i moren en pacients amb ELA és encara desconegut. El patró de progressió clínica trobat en ratolins transgènics mutats de SOD1 podria indicar que la malaltia es propaga de forma centrífuga des d’una regió afectada a una zona adjacent; per tant, es podria especular que productes tòxics generats en una àrea difonguin la lesió, afectat les neurones adjacents i d’aquesta manera propagant la malaltia, i una possibilitat és que aquests factors podrien ser vehiculats a través del líquid cefaloraquidi (LCR) 7 . Aquesta suposició va portar a diversos investigadors a desenvolupar experiments per investigar si la incubació in vitro en cultius de neurones i de línies de cèl·lules neuronals amb el LCR de pacients amb ELA (ELA-LCR) podria causar dany cel·lular, el que es va confirmar en la majoria dels estudios7-22 com a revisió, encara que no en todos23. El nostre grup ha determinat que ELA-LCR afecta la viabilitat de neurones motores corticals de cervell de rata mantingudes en cultius primaris; però, aquest efecte sembla que està mediat per un mecanisme independent de glutamat, tot i que l’ELA-LCR va causar una elevació de la concentració basal de Ca2 + citosòlic () de les neurones motoras24,25. Aquestes dades donen suport a la presència de factor (és) tòxic (s) en l’ELA-LCR responsable (s) de provocar dany de les neurones motores en experiments in vitro, però és possible que no en tots els pacients o en totes les fases de la enfermedad26. La pregunta és si l’ELA-LCR també podria causar dany cerebral in vivo. De fet, la injecció intratecal o intracerebroventricular (ICV) aguda d’ELA-LCR produeix canvis en l’activitat neuronal, en l’expressió dels receptors de glutamat i canals iònics, en la fosforilació de proteïnes a el cap de només 2dies després de la inyección27- 29 o indueix alteracions mitocondrials, estrès oxidatiu o disfunció lisosomal30.
Aquests experiments produïts amb injeccions puntuals no imiten el curs temporal de l’ELA i per tant no la reprodueixen. Per tant, semblava apropiat dur a terme els experiments que descriurem aquí: l’examen dels canvis cerebrals histopatològics i funcionals que es produeixen després de la infusió contínua d’ELA-LCR durant 20 o 43días, aconseguit mitjançant l’ús d’una minibomba connectada a l’ ventricle cerebral de rata a través d’una cànula, a fi per determinar les conseqüències de l’exposició més prolongada d’ELA-LCR citotòxic. Encara que no trobem canvis funcionals similars a l’ELA, trobem major expressió primerenca de molècules de senyalització d’neuroprotectors, una reacció neuroinflamatòria primerenca acompanyada de microglia activada i astrogliosis, així com la sobreexpressió de les proteïnes citoplasmàtiques ELA-vinculades com TDP-43, cistatinaC i transferrina.
Material i métodosRecolección de líquid cefaloraquidi i preparació d’ELA-LCR citotòxics (CELA-LCR)
Les mostres de LCR van ser recollides per punció lumbar en 32 pacients amb ELA diagnosticats segons els criteris de diagnòstic del Escorial31 (25). ** Van ser extrets entre 1,5 i 3cc de cada pacient, centrifugats a 1.500rpm durant 10min, i dividits en 4 a 5 alíquotes per a propòsits de l’estudi. Es va obtenir un consentiment informat de cada pacient. Setze pacients eren dones; l’edat mitjana de la sèrie va ser de 59años a el moment de l’extracció de l’LCR. Quatre pacients tenien ELA familiar i la resta eren esporàdics; 11casos van ser presentats com una forma d’aparició bulbar, 20 casos van patir el tipus de la columna vertebral, i un pacient presenta símptomes en tots dos llocs. Dels pacients amb ELA, sol 4 presentaven mutacions en el gen SOD1 i un era asimptomàtic, el que significa que el LCR de pacients amb un mecanisme de genètica SOD1 tenia una molt baixa presència en el grup ELA-LCR.Vint mostres (68,7%) van mostrar una citotoxicitat significativa (CELA-LCR) utilitzant el mètode descrit a continuació. Les mostres de LCR utilitzades com a controls (no ELA LCR) van ser obtingudes de pacients que pateixen mal de cap o convulsions i van requerir punció lumbar durant un examen de rutina. Es va obtenir també un consentiment informat dels controls. Les mostres de LCR es van mantenir congelades a -80 ° C fins que van ser utilitzades.
Amb la finalitat de demostrar citotoxicitat, van ser utilitzats en els experiments cultius cel·lulars de neurones motores in vitro, com ha estat descrit previamente24. Per a aquests experiments, les neurones es van obtenir de l’escorça motora cerebral d’embrions de rata de 20días d’edat. Les cèl·lules obtingudes es van sembrar a una densitat de 105células / ml en plaques de 48 pouets que contenien 0,25mL de mig neurobasal suplementat amb B-27 i conreat durant 8-10días. Després d’aquest temps, els cultius es van incubar durant 24 hores amb 10% ELA-LCR i la viabilitat de les neurones va ser mesurada amb assajos MTT32. L’ELA-LCR administrada als animals va ser preparada per la posada en comú de vials de LCR que exhibien efectes citotòxics in vitro (almenys 20% de pèrdua de les neurones motores), i la majoria de l’LCR inclòs en aquest grup va ser pres de pacients amb ELA esporàdica. Les mostres de LCR control per als no-tòxics de 3 pacients també van ser considerats abans de l’administració ICV.
Animals
Els animals van ser manipulats segons els principis de cura d’animals de laboratori publicats pel Comitè Ètic Espanyol ( RD 1201/2005) i la Directiva Europea 86/609 / CEE; el procediment va ser aprovat pel Comitè d’Ètica per a la cura i ús d’animals d’investigació a l’Hospital Clínic San Carlos de Madrid, Espanya. Les 28 rates Wistar albines mascle adults van ser obtingudes de Charles River Laboratories. Tots els animals van ser allotjats sota un cicle de llum / foscor de 12h amb accés lliure a menjar i aigua. Van ser engabiats individualment sota condicions de colònies estàndard en les instal·lacions dels animals Hospital Clínic San Carlos. El grup LCR es va administrar a les rates en 4 períodes. En el primer període, 14 rates entre 1 i 5meses d’edat (mitjana de 3,25meses) i en el segon període, 12 rates entre 2,5 i 5meses d’edat (mitjana de 4,1meses) van ser injectades amb el LCR descrit anteriorment . L’interval entre els 4 períodes va ser d’aproximadament 3 mesos.
Grups experimentals
Tres grups experimentals van ser dissenyats per a aquest estudi. El grup1 va incloure setembre rates a les que van ser implantades ICV minibombes plenes de LCR de pacients no-ELA (no ELA-LCR). El grup2 va ser compost per 15 rates implantades ICV amb minibombes plenes d’ELA-LCR citotòxic (CELA-LCR). Finalment, 4 rates implantades ICV amb minibombes plenes de solució salina fisiològica van formar el Grup3 (grup de tractament simulat o sham).
Administració intracerebroventricular de Cela-LCR o no-ELA-LCR
Les rates van ser anestesiades amb tribromoetanol , i se’ls va implantar per via subcutània un minibomba osmòtica (cabal d’0,15l / h; Alzet 2006, Alzet Palo Alto, CA, EUA) entre les escàpules i va romandre allà fins al punt final de l’estudi. Abans de l’implant, les minibombes osmòtiques es van omplir amb la preparació corresponent per a cada grup experimental. Les minibombes es van adjuntar a una cànula d’infusió de cervell (Alzet) a través d’un tub de polietilè i són preparades per immersió en solució salina normal a 37 ° C durant 24 hores. Aquests procediments van ser duts a terme en condicions estèrils. La cànula va ser implantada en el ventricle cerebral lateral dret (-0,5mm anteroposterior, -1,4mm lateral i -3,3mm dorsoventral (coordenades basades en l’Atles Paxinos) 33 i van ser fixades a l’crani amb ciment dental.
el volum de dipòsit de les bombes assegura el bombament a l’almenys durant 42días. el LCR va ser injectat per via intratecal a una taxa de 0,15l / h durant un període de 43días, excepte les rates sacrificades a el dia 20. Els animals restants en l’estudi que van romandre fins al dia 82 van ser implantades amb un tub de polietilè segellat mecànicament per prevenir la irritació local a causa de la contínua atracció d’aigua a la bomba.
Avaluacions clíniques
Els animals van ser provats clínicament a l’ menys un dia per setmana a partir d’una setmana després de la cirurgia. Totes les proves es van realitzar amb els examinadors cecs a el grup experimental a què pertanyia cada rata. les avaluacions de l’estudi van incloure el mesurament de pes corporal, la resposta a la prova de pla inclinat i l’escala motora Matsumoto34. Per mesurar el pes corporal, els animals es van pesar cada 4semanas amb una escala digital.Per a la prova de pla inclinat, 20 rates van ser col·locades lateralment contra l’eix llarg de el pla inclinat per mesurar l’angle màxim en què podien mantenir la seva posició en el pla durant 5s. Per avaluar la força de les dues extremitats per igual, els animals van ser col·locats sobre el pla inclinat amb el seu costat dret de el cos enfront de la part descendent de la superfície inclinada, posteriorment amb la banda esquerra de el cos que va costa avall. Una puntuació de menys de 70 ?? en la prova de pla inclinat es correlaciona bé amb l’aparició de debilitat muscular en ratolins transgènics SOD1-G93A34. Per determinar l’escala motora de Matsumoto34 es va posar a prova la capacitat dels animals de redreçar-se a si mateixos dins dels 30s de ser manipulat a banda i banda (reflex de redreçament). Les rates que eren capaços de redreçar des d’ambdós costats van ser examinades per a la seva capacitat de romandre a la seva gàbia d’allotjament de manera espontània durant 1min. Si mostraven poc moviment en les seves gàbies, es traslladaven a una altra gàbia per activar la motivació d’exploració. Si les rates no van mostrar anomalies d’acord amb aquestes avaluacions, eren examinades a fons per veure si tenien algun dèficit funcional observable, tal com paràlisi de les extremitats o símptomes de debilitat muscular general en el camp obert. Una puntuació de 5 significa que l’animal és normal i una puntuació de 0 és un rat completament paralitzada. L’escala motora de Matsumoto ha demostrat estar correlacionada amb la pèrdua de neurones motores espinals en un model de ratolí transgènic mutat d’ELA SOD1-G93A34
Examen electromiogràfic
Un electromiograma de les rates Cela-LCR i rates no-ELA -LCR va ser realitzat a el dia 82 per un neuròleg expert en aquesta tècnica. L’agulla va ser inserida en les extremitats davanteres i posteriors i en els músculs paravertebrals per intentar trobar signes d’denervació com a activitat espontània d’inserció (ones positives, fibril·lacions o fasciculacions). Les rates van ser sedadas amb isoflurano a l’1,5% en 0,7l / min d’oxigen durant el procediment.
Sacrifici dels animals
Als 20, 45 o 82días després de la cirurgia les rates de cada grup van ser profundament anestesiades amb una dosi de pentobarbital (60 mg / kg) i fentanil (0,3mg / kg). En primer lloc, es va injectar 10μl de colorant d’Evans blava a través d’un catèter ventricular per confirmar la correcta localització. Els animals van ser sacrificats per perfusió intracadiaca amb 0,9% de solució salina seguit de paraformaldehid a el 4% tamponat (tampó fosfat 0,1M). Després de la perfusió, l’encèfal i la medul·la espinal van ser disseccionats, rentats amb PB 0,1M i crioprotegidos per immersió en 30% de sacarosa i compost OCT. El material es va emmagatzemar a -80 ° C fins al seu ús. Es van tallar criosecciones (50μm) de l’escorça motora i dels segments cervical i lumbar de la medul·la espinal (C5-C6 i L3-L5); els talls van ser col·locats en una solució de crioprotecció que conté etilenglicol i sulfòxid de dimetil i és utilitzat per a preservació de teixits cerebrals. De les 9 rates en el grup de no-ELA-LCR, una va ser sacrificat a el dia 20, 7 als 45días i una a el dia 82. De les 15 rates en el grup de Cela-LCR, 4 van ser sacrificats a el dia 20, 7 a el dia 45 i 6 a el dia 82 després de l’implant. Finalment, de les 4 rates en el grup de tractament simulat, una va ser sacrificada a el dia 20, 2 als 45días i una als 82días.
Anàlisi de histoquímica i immunofluorescència
Es van rentar 4 talls de tinció d’immunofluorescència amb PBS, permeabilizados amb 0,1% Triton X-100 i bloquejats amb 10% de sèrum de cabra normal. Després es van aplicar els següents anticossos primaris durant la nit a 4 ° C: anti-periferina (1: 200, Millipore, AB 9282); anti-S100B (1: 200, Millipore, 04-1054); anti-caspasa-3 (1: 200, Millipore, 04-1090); anti-proteïna àcida fibril·lar glial (GFAP) (1: 500, DakoCytomation, Z0334); anti-GTL1 (1: 200, Millipore, AB 1783); anti-GFAP (1: 600, Millipore, MAB360); anti-TARDBP (1: 200, Abcam, ab42474); anti-ubiquitina (1: 100, Abcam ab7780); anti-transferrina-r (1: 200, Abcam, ab22391); anti-colin acetiltransferasa (1: 100, Abcam, ab68779); anti-metal·lotioneïna (1: 100, Abcam, ab12228); anti-Stefin (1: 100, Abcam, ab68290); anti-MHC II (1: 500, Abcam, ab6403); anti-Anava-I (1: 1.000, Wako, des 019-19741); anti panAKT (cell signaling 2920S) i anti fosfoAKT (cell signaling 4060S). Es van rentar els portaobjectes en PBS 3 vegades, i els anticossos primaris van ser provats amb Cy3 (1: 1.000, Jackson) o amb anticossos secundaris conjugats Alexa 488, 555 o 647 (1: 500, Invitrogen). Es van rentar les seccions 3 vegades en PBS, contrastades amb DAPI, i muntades amb el reactiu Fluorsave (Calbiochem).
Quantificació de dades immunohistoquímics
Les imatges de fluorescència van ser adquirides amb un microscopi confocal Olympus AF1000.Es va dur a terme un estudi immunohistoquímic descriptiu dins dels 3 períodes de temps establerts, una anàlisi dels canvis observats en els marcadors immunohistoquímics amb el temps i la seva comparació entre els grups control i ELA-LCR. Les anàlisis histològics van examinar les àrees estretament relacionats amb ELA, específicament l’escorça motora, bulb raquidi i segments espinals C5-C6 i L3-L5.
GFAP, IBA1, caspasa-3 i MHC-II
Les imatges confocals van ser adquirides amb la mateixa configuració i distribució de fluorescència utilitzant Olympus Confocal Software (Olympus FluoView FV1000). Es va realitzar l’anàlisi quantitativa utilitzant la versió 1.42q de programari d’anàlisi ImageJ (EUA). El nombre de cèl·lules positives d’immunohistoquímica va ser comptat prenent a l’atzar 368μm2 de cada àrea analitzada de 3 a 4 diferents seccions de cervell coronal.
Periferina, S100B, panAKT, fosfoAKT i mesurament de metal·lotioneïna
Per mesurar S100B, panAKT , fosfoAKT, metalotioneína i periferina, es va seguir una versió modificada de l’mètode físic dissector descrit per Reed, utilitzant el principi de maó imparcial de el dissector 3D35. L’anàlisi va ser realitzat mitjançant mesuraments de densitat òptica (processament d’imatge binària de blanc i negre), obtenint el percentatge d’àrea de camp analitzat. Es van seleccionar 8 àrees per animal a l’atzar per un experimentador cec utilitzant el programari ImageJ 1.42 (NIH).
Anàlisi estadística
Les dades van ser processats utilitzant el programari GraphPad Prism 5. Van ser reportats com a valors mitjans ± error estàndard de la mitjana (SEM). Els gràfics dels resultats van ser realitzats utilitzant el mateix programa. El criteri per a la significació estadística va ser p
0,05.Resultados
Tots els animals van sobreviure a l’implant ICV de la minibomba osmòtica i cap d’ells va mostrar signes d’infecció (abscés, edema o secreció purulenta en l’implant) ; cap va patir convulsions, agressió, piloerecció o prostració. La infusió va ser realitzada durant 20 o 43días i el curs temporal dels efectes de LCR o infusió de solució salina es va avaluar als 20, 45 i 82días després de l’implant de la bomba miniosmótica.
Avaluacions clíniques i electromiogràfiques
no es van trobar diferències significatives entre les rates de el grup de Cela-LCR i els altres grups en cap de les avaluacions clíniques, incloent el pes corporal, el comportament durant la prova de pla inclinat i les escales de Matsumoto, que van ser totes normals. Pel que fa als electromiogrames, es van trobar ones agudes positives en les extremitats posteriors, les extremitats davanteres i els músculs paravertebrals sense potencials de fibril·lació o fasciculación en 6 de les rates de el grup CELA-LCR als 82días després de l’implant, el que no va passar en els controls, tot i que no es va observar un patró de denervació.
activació microglial i expressió de GFAP, S100B, GLT1 i la caspasa-3
es va observar gliosi reactiva evident, activació microglial i expressió de caspasa-3 a la escorça motora en els 3 grups experimentals als 20días després de l’implant. Aquestes troballes podrien ser atribuïts a una resposta inflamatòria secundària a la intervenció quirúrgica. No obstant això, als 45días després de la cirurgia es va observar un important increment en la reactivitat glial i la resposta microglial en totes les regions en el grup de Cela-LCR (figs. 1 i 2). En els segments de la medul·la espinal dels animals que van rebre Cela-LCR es va observar que algunes motoneurones estaven embolicades per cèl·lules microglials. La quantificació immunohistoquímica de el marcador IBA-1 va revelar alteracions en la morfologia de la microglia, passant d’un estat en repòs caracteritzat per un soma microglial amb processos fins i ramificats a una microglia activada amb escasses ramificacions. Es van observar cossos cel·lulars allargats amb processos llargs i més gruixuts als 20días després de l’implant, mentre que es van trobar les cèl·lules ameboides amb cossos rodons amb processos curts, gruixuts i robustos als 45 i 82días, el que indica una activació de cèl·lules fagocítiques en la proximitat de les neurones motores. Aquestes cèl·lules expressen MHC-II, que marca fases inflamatòries. En els grups de tractament simulat i no-ELA-LCR, l’expressió de MHC-II va ser 3 vegades inferior a l’observada en el grup de Cela-LCR (fig. 3). Un punt interessant va ser la forta expressió d’astròcits i el descobriment d’astròcits hipertròfics que sobreexpresaban GFAP en les proximitats de les neurones motores corticals i de la medul·la espinal. Es van observar canvis més pronunciats als 45días després de la cirurgia. També es va observar expressió de MHC-II, però a nivells més baixos, als 82días (fig. 3). Contràriament les dades observades en el grup de Cela-LCR, es va constatar una disminució de l’expressió de GFAP i de caspasa-3 en els altres 4 grups, fins i tot als 82días després de la cirurgia.Així mateix, es va observar un lleuger augment en l’expressió de l’transportador de glutamat GTL1, que s’ha relacionat amb l’ELA, i la seva expressió està modificada per ELA-LCR36. GTL1 es va trobar en les proximitats de les neurones motores espinals de el grup CELA-LCR que es correlaciona amb l’expressió de GFAP com un marcador d’activació d’astròcits. La sobreexpressió de S100B aparèixer als 45 i 82días en el grup de Cela-LCR només.
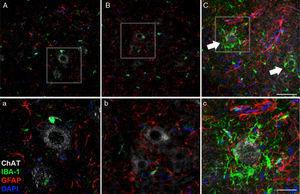 a
a Als 45 dies després de la cirurgia, l’augment de la reactivitat glial i la resposta microglial en el grup de Cela-LCR en totes les regions cerebrals estudiades va ser evident. Per exemple, a la banya anterior (segment lumbar) de rates CELA-LCR, trobem una major expressió de GFAP amb abundants astròcits hipertròfics (panell C, c); a més, es va identificar una major densitat de cèl·lules IBA-1 positives amb processos engrandits, sovint en estreta proximitat a les neurones motores o fins i tot envoltant a aquestes neurones (fletxes en panell C, fletxes i detall de el panell c). Aquests canvis no es van observar en els grups sham i no ELA-LCR, en els quals les cèl·lules de microglia aïllades es van observar ocasionalment a prop de les neurones motores. Escala: A-C: 60μm; detalls ac: 30μm.
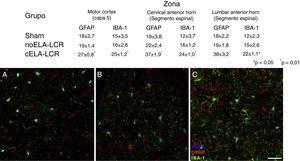 a
a Imatge de microscòpia confocal de l’escorça motora, exemplificant les dades presentades en taules (diferents moments de l’estudi). És evident l’augment de cèl·lules positives IBA-1 i GFAP en els animals de el grup CELA-LCR (C), en comparació amb el grup sham (A) i el grup de Noela-LCR (B). Escorça motora capa 4-6, 45días després de la cirurgia. Escala de barres: 50μm.
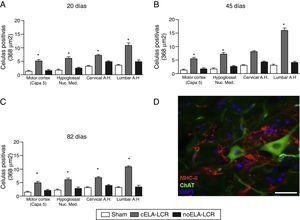 a
a AC) Anàlisi quantitativa de l’expressió de MHC-II en diverses regions de l’ cervell i medul·la espinal, en els 3 períodes de temps estudiats. El grup CELA-LCR va mostrar un augment significatiu de el nombre de cèl·lules microglials, que és una evidència clara d’una etapa neuroinflamatòria. D) Imatge representativa de cèl·lules positives per MHC-II a la regió lumbar. Aquestes cèl·lules també es van observar en les proximitats de les neurones motores. Escala: 50 m; * P0,05; les dades es mostren com a mitjana ± DE.
expressió de panAKT i fosfoAKT
Per tal de comprendre si l’increment de caspasa-3 s’acompanyava d’un augment en l’expressió de proteïnes estretament relacionades amb la supervivència i la resistència a l’apoptosi, com ara fosfoAKT i panAKT, es va dur a terme la seva quantificació. Bàsicament, el grup de tractament simulat i el grup no-ELA-LCR no van mostrar canvis significatius al llarg de l’estudi (20, 45 i 82días).No obstant això, en el grup de Cela-LCR es van trobar increments significatius de panAKT i fosfoAKT als 45días, amb una expressió immunohistoquímica que era 3 vegades més gran que els nivells observats en els altres grups, però als 82días després de la cirurgia aquestes dades eren similars a el grup de tractament simulat (fig. 4).
 a
a Expressió de panAKT (AKTpan) i fosfoAKT (AKTfosfo) en diverses regions de el sistema nerviós central dels 3 grups de rates. A) Imatges de microscòpia confocal de l’expressió de panAKT, fosfoAKT i periferina (PERIP). B) Anàlisi de fosfoAKT i panAKT de quantificació de densitats òptiques. Es van observar majors expressions de AKTpan i fosfoAKT als 45días en el grup de Cela-LCR (A i B). Un fenomen interessant en el grup de Cela-LCR va ser l’increment en l’expressió de periferina, fosfoAKT i panAKT a les neurones (A). En el dia 82 després de la cirurgia, les concentracions de AKT (pa i fosfo) van ser similars als dels grups sham i no ELA-LCR, l’expressió s’havia tornat a nivells similars als observats en els altres grups als 82días de la cirurgia dies post (B). Escala: 50μm.
Expressió de periferina
La periferina juga un paper important en el transport axonal en les neurones motores espinals. Recentment la periferina també s’ha associat amb algunes neuropatologies que caracteritzen l’ELA esporàdica, ja que es troba en els cossos Bunina37. Per tant, hem considerat rellevant analitzar la periferina a les neurones motores, ja que la seva expressió es relaciona amb formes d’ELA esporàdica. Totes les seccions de el grup CELA-LCR van mostrar neurones motores amb expressió positiva de periferina (figs. 5 i 6), però en els animals sacrificats als 45días es van observar nivells 4 vegades més alts que en els dels altres grups i els punts de temps analitzats (fig. 6). D’altra banda, les cèl·lules amb més inmunorreactividad de periferina també co-van expressar amb panAKT i fosfoAKT. Aquestes cèl·lules mostraven el marcador d’periferina amb un patró filamentós, que s’observa també en les condicions normals; però, en el grup de Cela-LCR també es van observar cèl·lules que contenien el marcador de periferina en inclusions citoplasmàtiques que recorden estructures rugoses o granulars, que possiblement podrien desencadenar la formació de precipitats o inclusions de proteïnes (fig. 5).
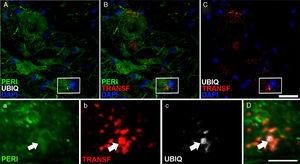 a
a Expressió de periferina (peri), ubiquitina (Ubiq) i transferrina després de la infusió de Cela-LCR. Als 45 i 82días després de la cirurgia dels animals amb tractament Cela-LCR van mostrar inclusions en el citoplasma i tenien marcatge positiu d’ubiquitina a les neurones. Inclusions (fletxes) d’ubiquitina es colocalizaron amb periferina i, ocasionalment, amb transferrina. Escala A-C: 20μm; ac i D: 2μm.
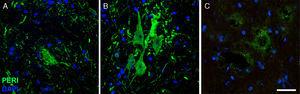 a
a Imatges d’immunofluorescència que mostren l’expressió de periferina (peri) al llarg de el curs de l’estudi en el grup de Cela-LCR (A: 20días; B: 45días; C: 82días). Es va observar un augment temporal de periferina a les neurones motores en el dia 45, que havia tornat a condicions basals a el dia 82. L’augment d’expressió de periferina s’ha associat amb esdeveniments de lesió en columna, mentre que l’expressió és baixa en condicions normals. Escala: 40μm.
Co-expressió de cistatina C, transferrina, ubiquitina i TDP-43
En el grup de Cela-LCR, als 45 i 82días després de la cirurgia es van observar cèl·lules amb una major expressió de la ubiquitina, transferrina (fig. 5) i cistatinaC. Aquestes dades estan estretament vinculats a formes esporàdiques de ELA38. D’altra banda, es va observar que hi havia una translocació de TDP-43 en el citoplasma de les neurones motores (fig. 7). Curiosament, l’anàlisi immunohistoquímic per microscòpia confocal va revelar inclusions de TDP-43, ubiquitina i cistatinaC, i aquestes proteïnes es colocalizaron en el citoplasma de les neurones motores. L’increment d’aquestes inclusions als 82días va ser acompanyat per una disminució en l’expressió de periferina (fig. 6).
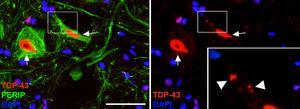 a
a Imatges en què s’observa que els animals tractats amb CELA-LCR van mostrar inclusions citoplasmàtiques de TDP- 43 a les neurones de la medul·la espinal (fletxes). En el detall s’observen les inclusions (caps de fletxa). Escala: 40μm.
Metal·lotioneínes
Com alguns estudis han suggerit que la homeòstasi de l’coure i de el zinc podria contribuir a la patogènesi de l’ELA, es va estudiar l’expressió de metalotioneína39,40. L’expressió de metal·lotioneïnes estava relacionada amb el curs temporal dels canvis després de la cirurgia (45 i 82días) i només es va produir en el grup de Cela-LCR, en el qual es va observar en les neurones motores que co-expressaven ubiquitina i transferrina . L’augment de la S100B mesurat als 45 i 85días després de la cirurgia estava estretament relacionat amb l’augment de la periferina en les proximitats de les neurones motores. Les cèl·lules que expressen S100B van correspondre a el fenotip d’astròcits (GFAP +) de neutròfils adjacents a neurona motora. Els astròcits que expressen S100B estan estretament relacionats amb l’equilibri de calci, zinc i coure. S100B és una proteïna d’unió a calci expressada exclusivament per les cèl·lules glials.
Discussió
El present estudi té com a objectiu determinar les conseqüències de l’administració sostinguda ELA-LCR en rates per tal de comprendre els efectes que podrien ocórrer en pacients que presenten citotoxicitat en el seu LCR. Això demostra que la infusió ICV sostinguda de Cela-LCR en rates produeix canvis citohistoquímicos en cervell i medul·la espinal que s’assembla als trobats en pacients amb ELA esporàdica. Aquests canvis no es van observar en rates infundidas amb solució salina o en animals infosos amb no-ELA-LCR. La infusió es va realitzar durant 20 o 43días i els teixits es van analitzar als 20, 45 i 82días després de l’implant de la cànula. Els animals de l’estudi que es van sacrificar als 82días van rebre la infusió durant els primers 43días només.
Els canvis rellevants en les cèl·lules als 45días van ser una activació microglial seguida per astrogliosis. L’activació i la proliferació de microglia abans de l’aparició dels signes clínics també es produeixen en pacients amb ELA41, així com en ratolins transgènics SOD1-G93A42. A més, en els ratolins transgènics ELA la microglia activada apareix abans de l’aparició de la pèrdua neuronal43. Això es manté en línia amb l’observació que l’expressió reduïda de SOD1-G93A en les cèl·lules microglials alenteix la progressió de la malaltia i perllonga la supervivencia44. Per contra, les cèl·lules microglials que expressen SOD1-G93A presenten augment de neurotoxicitat i augment en la producció de citocines, NO i MCP-1 després de la seva activació in vitro45. Aquestes troballes recolzen la idea que l’activació de microglia pot jugar un paper rellevant en el desenvolupament de ELA46,47. Als 45días després de l’implant (43días d’infusió amb ELA-LCR) trobem cèl·lules de microglia en contacte proper amb les neurones de la medul·la espinal.Aquestes cèl·lules mostraven la morfologia típica de l’activació concomitant amb l’expressió augmentada de MHC-II, que es considera que és un marcador de la resposta inflamatòria dependent de l’complemento48,49. La astrogliosis està clarament present, tot i que encara es desconeix la seva implicació en la patogènesi de l’ELA i si apareix abans o després de l’activació microglial. Una altra troballa notable va ser la sobreexpressió de S100B en astròcits als 45 i 82días. Aquesta proteïna s’ha correlacionat amb la supervivència en ELA50,51 i és regulada en astròcits i neurones motores de la medul·la espinal en els pacientes52, així com en rates infundidas durant 48 hores amb ELA-LCR53. Els astròcits amb inclusions són presents també en els ratolins mutants SOD154. Així mateix, es va observar que la astrogliosis i la sobreexpressió de GFAP aparèixer després de l’activació de microglia. Això podria donar suport a la idea d’un mecanisme de neuroinflamació com un esdeveniment d’hora en la patogènesi de la malaltia.
En els últims anys s’ha posat èmfasi en la translocació citoplasmàtica de TDP-43, una proteïna codificada pel gen les mutacions de TARDBP s’han associat amb ELA4. Hem observat que TDP-43 es troba en inclusions d’ubiquitina en l’ELA esporàdica, però no en els casos SOD1 mutat. La presència citosòlica de TDP-43, colocalizada amb ubiquitina, als dies 45 i 82días en el grup de Cela-LCR dóna suport a la idea que aquests canvis estan relacionats amb l’ELA esporàdica. Això es veu reforçat pels nostres troballes que els primers canvis en les neurones motores van incloure la sobreexpressió de la cistatinaC, transferrina i periferina, 3 proteïnes que estan estretament vinculades als cossos Bunina en l’ELA esporádica37,55,56. De fet, les mutacions de periferina ja s’han associat amb l’ELA esporádica57.
Una altra variable que es va valorar va ser la via de senyalització PI3K / AKT relacionada amb la supervivència celular58. Hem trobat un augment en l’expressió de panAKT i fosfoAKT a el dia 45 en rates tractades amb CELA-LCR. Aquest va ser una troballa interessant tenint en compte que periferina és també un substrat de PI3K. Val la pena assenyalar que l’augment de l’expressió de PI3K, però no d’AKT, s’ha trobat a la medul·la espinal de pacients amb ELA59. No obstant això, l’increment de fosfoAKT s’ha observat en les medul·les espinals de ratolins SOD1-G93A en la fase asintomática60. D’altra banda, els estudis in vitro indiquen que la PI3K / AKT s’altera en cèl·lules procedents de rates mutades SOD1-G93A61. Per tant, la periferina i la via PI3K / AKT podrien augmentar com una resposta a l’estrès cel·lular causat per Cela-LCR. L’augment de caspasa-3 com un signe de l’apoptosi en aquestes rates és compatible amb aquest punt de vista i amb la troballa de les neurones motores apoptòtiques en la ELA62-64.
L’última troballa que cal esmentar és l’increment en l’expressió de la metal·lotioneïna en rates infundidas amb CELA-LCR. Això està d’acord amb informes de nivells més alts de les metal·lotioneïnes en ratolins mutats SOD165-67; un augment similar en el seu ARNm s’ha descrit també en aquests ratones68. En consistència amb això és l’observació que en ratolins que procedeixen de l’encreuament de rosegadors amb ELA i deficients de metal·lotioneïna s’accelera la progressió de la enfermedad68 i que la seva major expressió suposa una mejoria69. En contrast, l’expressió de metal·lotioneïna i el seu ARNm està disminuïda en la ELA70. Les metal·lotioneïnes són proteïnes Cu / Zn-vinculants que redueixen els productes reactius de l’oxigen i contraresten la toxicitat per metalls. En aquest context, la recerca d’una major expressió metalotioneína podria significar que una reacció neuroprotectora es desenvolupa en resposta a la infusió crònica de Cela-LCR en la rata; això es manté en línia amb la troballa, de l’expressió incrementada de metal·lotioneïna a les neurones motores de la medul·la espinal de ratolins mutats amb ELA, el que tracta d’evitar la pèrdua de neurones i inhibeix la progressió de la enfermedad71.
les troballes histopatològiques descrits són compatibles amb la hipòtesi que la citotoxicitat de LCR en rates, induïda per setmanes d’infusió ICV perllongada de Cela-LCR, produeix canvis en cervell i medul·la espinal similars als de les formes esporàdiques d’ELA. El nostre estudi mostra algunes limitacions. En primer lloc, els símptomes clínics estan absents en els 3 períodes estudiats (20, 45 i 82días). En els ratolins SOD1-G93A-ELA, els primers símptomes clínics apareixen als 90-100 dies de edad72, però els rosegadors amb altres mutacions poden començar a mostrar símptomes clínics més tarde38. S’han observat anomalies primerenques, com la fragmentació de Golgi als 31días de edad73; també sembla possible que es produeixin canvis subtils abans d’aquesta edad74. En els ratolins amb mutacions SOD1, les primeres alteracions apareixen a la medul·la espinal cervical38.També s’han observat canvis en la medul·la espinal cervical i lumbar similars als observats en l’escorça motora cerebral, el que indica que l’efecte nociu de Cela-LCR infós en el ventricle cerebral havia propagat distalment a la medul·la espinal. Aquesta observació és compatible amb la hipòtesi que la progressió de la malaltia podria estar mediada en part a través de l’LCR. En segon lloc, encara es van detectar diversos marcadors de proteïnes que es sobreexpressen als 45días, encara que en concentracions menors, als 82días (és a dir, periferina, GFAP, panAKT i fosfoAKT); en altres es sobreexpressa per igual als 45 i 82días (és a dir, la cistatinaC, transferrina, ubiquitina i translocació TDP-43), encara que amb la limitació que les mides de mostra de grups d’estudi no eren similars i el nombre de rates dels grups de control va ser baix. No obstant això, l’expressió anormal d’aquestes proteïnes en el grup CELA-LCR és clara i els diferents resultats en els grups de control confirmen que els canvis no són causa de artefactes de l’mètode. En tercer lloc, Cela-LCR va ser infós per ICV durant 43días, que era el termini màxim per al volum de la minibomba. Tot i el fet que el CELA-LCR no va ser administrat entre el dia 43 i el dia 82, les neurones motores apoptòtiques només es van observar en animals examinats en el día82. Això suggereix que el procés nociu podria romandre actiu després del dia 43, i per tant sembla possible que l’extensió de la infusió de Cela-LCR més enllà de 43días i / o a el següent curs temporal de la malaltia més enllà de 85días podria revelar les manifestacions clíniques d’una neurona motora semblant a les de les formes esporàdiques d’ELA.
En conclusió, aquest estudi presenta les primeres conseqüències de citotoxicitat LCR-ELA després de setmanes d’infusió ICV sostinguda amb LCR de pacients amb ELA , que prèviament s’havia provat que mostraven efectes citotòxics en un cultiu primari de neurones motores. Als 45 i 82días després de l’inici de la infusió l’escorça motora, el tàlem i la medul·la espinal cervical-lumbar van mostrar diversos canvis en els marcadors típics de la malaltia d’ELA humana. Aquestes troballes poden millorar la nostra comprensió de la patogènesi i l’evolució de l’ELA i ajudar a trobar noves dianes terapèutiques útils per al desenvolupament de nous compostos que retardin o fins i tot puguin arribar a aturar la progressió de la malaltia.
Finançament
Aquest estudi va ser recolzat per quatre subvencions concedides a JMG per la Mutua Madrileña, Espanya, el 2008 i 2009. També va ser recolzat per les següents subvencions concedides a AGG per institucions espanyoles: 1) NDE07 / 09, Agència Laín Entralgo, Comunitat de Madrid ; 2) Fundació Eugenio Rodríguez Pascual; 3) Fundació CENT, Institut de Salut CarlosIII; 4) RENEVAS-RETICS-RD06-026, Institut CarlosIII; 5) SAF 2010 a 21795, Ministeri d’Economia i Competitivitat, Espanya, i 6) MAT2011-28791-C03.
Conflicte d’interessos
Els autors declaren que no hi ha conflictes d’interessos.
Agraïments
els autors volen agrair la col·laboració de Pablo González i M. Cruz Rodríguez per la coordinació dels procediments de cura dels animals, ia la Fundació Teófilo Hernando pel seu continu suport.