En l’Antiguitat, va existir una gran controvèrsia entre els estudiosos de la Física pel que fa a la composició essencial de tota la matèria que aquests observaven. En aquest context, alguns filòsofs de l’Antiga Grècia plantejaven que cada forma de matèria estava composta per partícules que constituïen tal substància: un tros de paper podria ser dividit gairebé incomptables vegades fins descompondre en partícules primordials de paper; un tros d’os estaria conformat per partícules primordials d’os; l’aigua de mar estaria constituïda per milers de petites partícules d’aigua de mar. Tals partícules elementals van ser cridades “homeomeries” i representaven la idea incipient que les coses materials estaven compostes per diminuts maons eterns, idea que evolucionaria més endavant en el concepte de “àtom”. De fet, la paraula “àtom” va ser encunyada igualment pels filòsofs grecs (atribuint el mèrit especialment a Demòcrit i el seu plantejament de “què passaria si als grans de sorra, que procedeixen de fragmentar les roques, els segueixo fragmentant?”) , per designar a les partícules “indivisibles” i “indestructibles” que construïen tot el que veiem.
En l’actualitat, sabem que, efectivament, la matèria que coneixem està constituïda per unitats que seguim trucant àtoms. No obstant això, a diferència de la concepció original, tenim evidències suficients per poder afirmar que els àtoms no pertanyen a un nombre il·limitat de substàncies: no hi ha àtoms d’os, de carn, de pèl o d’aigua. Totes aquestes substàncies complexes sorgeixen, en realitat, de la combinació d’un nombre determinat d’espècies químiques pures que coneixem com a “elements químics”, que recollim en el model de la Taula Periòdica, cadascuna de les quals està constituïda per un tipus concret de àtom. els àtoms dels diferents elements químics es combinen entre ells per donar lloc a totes les substàncies que existeixen i, a més, són els que donen peu a que les reaccions químiques succeeixin. per àtom entenem, doncs, a la unitat més petita de matèria amb identitat pròpia i que és capaç de participar en una reacció.
d’altra banda, també sabem avui que els àtoms són divisibles en unitats menors que coneixem, en conjunt, com “partícules subatòmiques”. Hi ha una quantitat considerable de partícules subatòmiques i no totes formen part de la matèria, però en els àtoms tenim una estructura molt definida: un nucli constituït per un conglomerat de partícules amb càrrega positiva (protons) i càrrega neutra (neutrons) en nombre variable i una escorça de partícules amb càrrega negativa (electrons). Les càrregues positives compensen a les càrregues negatives, de manera que, en els àtoms neutres, el normal és que hi hagi el mateix nombre de protons que d’electrons.
El nombre de protons ve donat pel “nombre atòmic “, que identifica l’element químic que sigui. Per exemple: l’àtom amb un protó en el seu nucli és de l’element” hidrogen “; l’àtom amb dos protons, de “heli”; l’àtom de tres protons, de “liti”, etc. A la Taula Periòdica, els elements estan ordenats de menor a major en funció del seu nombre atòmic (Z). D’altra banda, el nombre màssic (A) representa el nombre de protons i de neutrons, que són els que concentren la major part de la massa de l’àtom. No obstant això, el nombre màssic d’un element pot variar, de manera que cada element té diverses versions de si, el que coneixem com isòtops. En els isòtops, varia el nombre de neutrons, que canvien la massa de l’àtom; així, molts isòtops són inestables i es descomponen amb el pas el temps, el que causa la “radioactivitat”.
Aquest coneixement ha estat resultat de l’acumulació progressiva, al llarg de segle XIX i XX, de evidències experimentals que han anat millorant els models atòmics que s’han anat desenvolupant a partir de la concepció original de l’àtom. el model de Thompson concebia l’àtom com una esfera massissa de càrrega positiva amb els electrons enfilats en ella. va ser el primer model que va associar les càrregues elèctriques a l’àtom; l’anterior, el de Dalton, no ho contemplava. no obstant això, amb els experiments de Rutherford, es va veure que l’àtom era en la seva majoria espai buit, amb les càrregues positives en un nucli envoltat d’una escorça de electrons. Bohr va definir que aquests electrons es distribuïen en diferents nivells d’energia, basant-se en els espectres atòmics. Amb el desenvolupament, al segle XX, de la teoria quàntica, el model de l’àtom de Bohr va ser modificat fins al model actual, el model mecanocuántico, influenciat per les aportacions de científics com Sommerfield, Schrödinger, De Broglie o Planck.
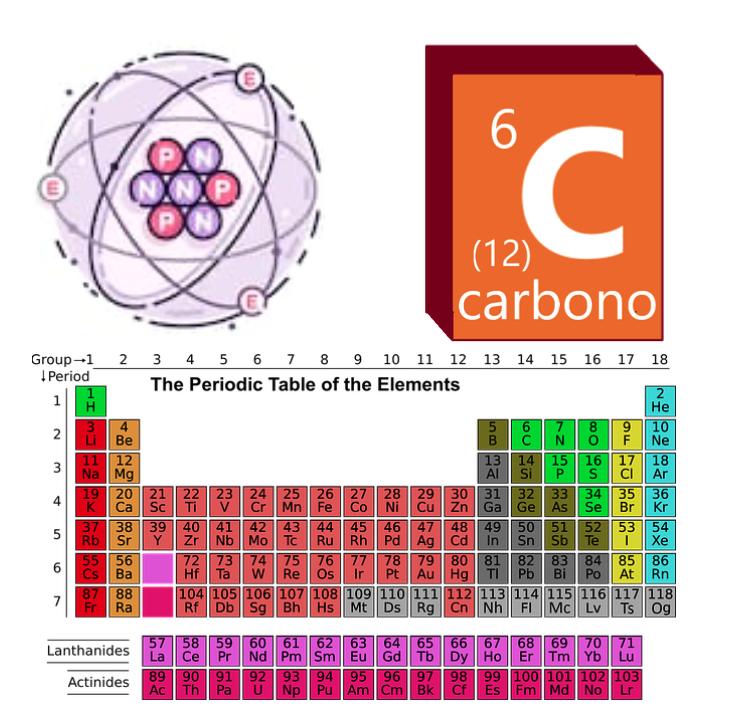
els àtoms no són com se’ls sol representar, però realment no tenim moltes maneres millors de dibuixar-se de manera entenedora.Per això, solem adoptar models didàctics senzills com el model de Rutherford o el model de Bohr, on podem visualitzar fàcilment que els àtoms es constitueixen d’un nombre de protons, neutrons i electrons de manera intuïtiva. A la Taula Periòdica, els àtoms s’ordenen d’acord al seu nombre atòmic (Z). El nombre màssic pot canviar. El carboni, per exemple, té Z = 6 i un nombre màssic variable. L’isòtop més comú és el carboni-12 (A = 12), però també hi ha altres isòtops molt comuns, com el carboni-14 (A = 14), que es desintegra radioactivament amb certa facilitat i s’usa per datar restes arqueològiques.
 Projecte Dodociencia és un projecte per Hidden Nature està sota llicència internacional Creative Commons Reconeixement – No Comercial – CompartirIgual 4.0. Creat sota el projecte Hidden Nature. Podeu trobar permisos addicionals dels concedits amb aquesta llicència en les nostres polítiques de privacitat
Projecte Dodociencia és un projecte per Hidden Nature està sota llicència internacional Creative Commons Reconeixement – No Comercial – CompartirIgual 4.0. Creat sota el projecte Hidden Nature. Podeu trobar permisos addicionals dels concedits amb aquesta llicència en les nostres polítiques de privacitat